
今天介绍的文章对 7 例不适合立体定向体放射治疗 (SBRT) 的肺癌患者的外周血样本进行了免疫表型分析。目的是确定 SBRT 对宿主免疫系统的影响。
其中 4 例患者接受 60 Gy (7.5 Gy X 8 疗程), 3 例患者接受 50 Gy (12.5 Gy X 4 疗程)。分别在 SBRT 前、SBRT 后 72 h 以及 SBRT 结束后 1 个月、3 个月和 6 个月进行检测和分析。值得注意的是,免疫系统的免疫活性成分特异性增加,CD56+CD16+自然杀伤 (NK) 细胞升高 (基线时 0.95% 至 6 个月时 1.38%),免疫系统的免疫抑制成分降低,CD4+CD25+Foxp3+CD45RA-Treg 细胞减少 (从基线 4.97% 降至 6 个月时 4.46%), G-MDSCs 细胞减少 (从基线时的 66.1% 到六个月时的 62.6%), Mo-MDSCs 细胞也减少 (从基线时的 8.2% 到六个月时的 6.2%)。这些变化在 72 小时就已经很明显,并持续了 6 个多月。
SBRT 显示了对全身免疫细胞群的影响,这是支持未来 SBRT 联合免疫疗法治疗肺癌患者的相关发现。
背景介绍
立体定向体放疗 (SBRT) 或立体定向消融体放疗 (SABR) 已成为不适合手术的非小细胞肺癌 (NSCLC) 患者的非手术治疗选择。在可手术的 I 期 NSCLC 患者中,对比较 SBRT 与手术的 3 期随机试验的汇总数据进行分析,可能初步支持这两种治疗方法同样有效,但在接受 SBRT 治疗的患者中没有更高的区域转移率。局部放射治疗的一种罕见的临床反应是放射区外的肿瘤消退,通常称为异位效应。实验研究表明,T 淋巴细胞作为抗肿瘤效应因子在肿瘤对辐射的反应中起着关键作用。此外,局部放疗已被证明可在几种类型的癌症中诱导异位效应,包括黑素瘤、转移性 NSCLC、淋巴瘤和肾细胞癌。虽然这种效应背后的生物学特征还不清楚,但它可能是由免疫机制介导的。SBRT 的免疫调节作用在不同的研究中一直存在争议,这些研究假设 SBRT 联合免疫治疗具有协同作用。两种治疗方式的协同效应可能改善临床结果。SBRT 通过多种机制促进抗肿瘤免疫反应,但对 SBRT 与宿主免疫系统相互作用的详细了解尚不清楚。我们评估了不适合手术的原发性和转移性肺癌患者在 SBRT 免疫功能变化。这一信息可能有助于优化未来免疫治疗方法与 SBRT 在癌症治疗中的组合或时机。
材料与方法
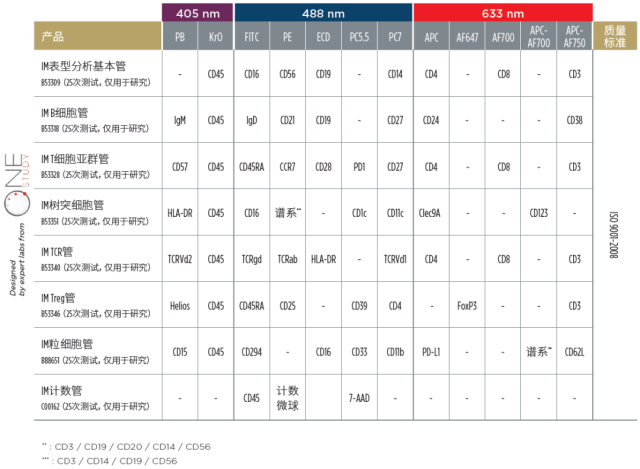
7 例原发性 NSCLC 或转移性肺癌患者,经院内肿瘤多学科委员会评估均认为不适合手术,分别于 SBRT 前、SBRT 后 72 小时、治疗结束后 1、3 和 6 个月在肝素化管中采集外周血样本。采用如下图的贝克曼库尔特公司生产的预混 DuraClone IM Antibody Panels®于 Navios 流式细胞术分析。本实验使用了 IM 表型分型基础管,IM Treg 管及 IM 粒细胞管。
结果
1、免疫分型方案
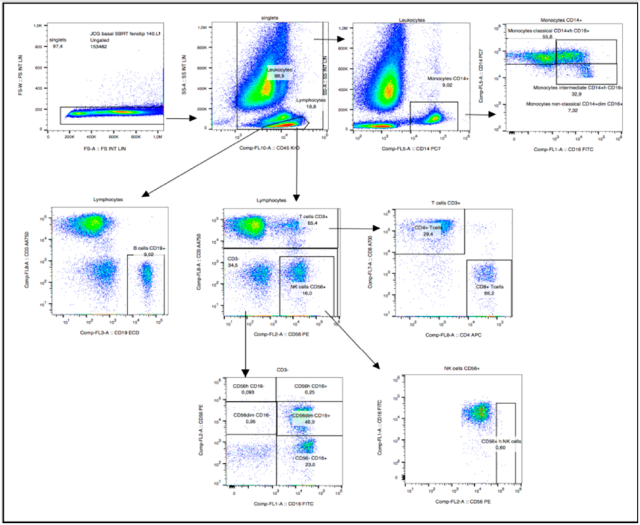
在免疫细胞类型的门控策略中,首先根据淋巴细胞的侧散射和正向散射特性筛选淋巴细胞,进一步检测淋巴细胞特异性标记物,以识别各种免疫细胞。用于分析所有细胞类型的流式细胞仪图如图 1 所示。
2、淋巴细胞
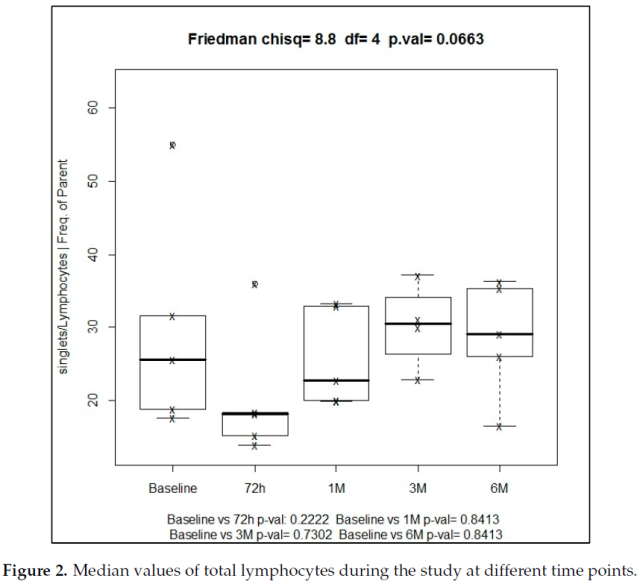
7 例患者 SBRT 前总淋巴细胞阳性率中位基线值为 19.9%。放射治疗后,这种免疫细胞类型的频率增加,6 个月时中位数为 29.1%,治疗 3 个月时达到最高值 30.4%。
经 Friedman 单因素方差分析,SBRT 治疗后研究期内淋巴细胞总数的变化具有统计学意义 (p = 0.066)。然而,配对样本在不同时间点与基线的比较,采用 wilcoxon 符号秩检验,差异无统计学意义 (p = 0.840)(图 2)。
3、细胞毒性 T 细胞
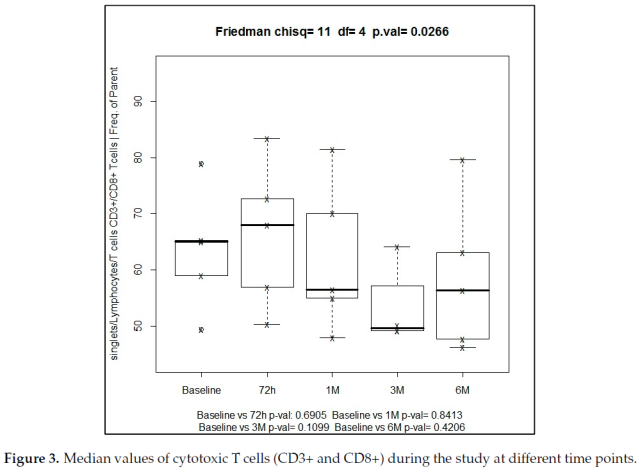
与淋巴细胞亚群相关,细胞毒性 T 细胞 (CD3+CD8+) 从基线到 SBRT 治疗 72 小时从 65% 增加到 68%,尽管这种增加没有统计学意义 (p = 0.690),随后在 6 个月时该亚群呈下降趋势,达到 56.4%。CD3+CD8+细胞毒性 T 细胞的变化具有统计学意义 (Friedman 检验,p = 0.026),这表明这一发现是相关的 (图 3)。
4、辅助性 T 细胞
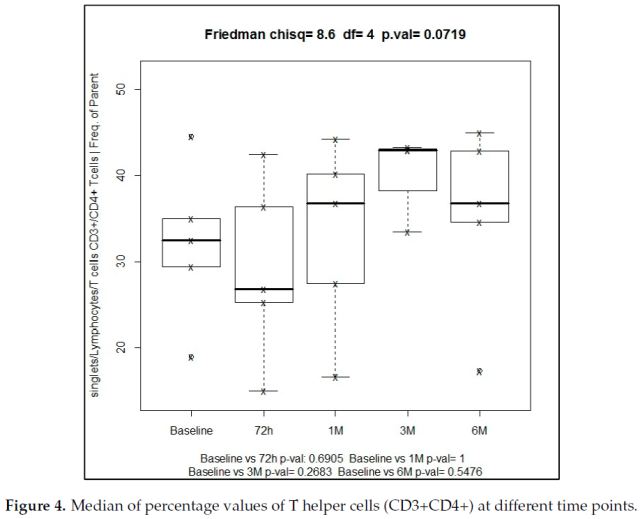
辅助 T 细胞亚群 (CD3+CD4+) 在治疗 6 个月时从基线的 32.2% 逐步增加到 36.8%,在治疗 3 个月时最高达到 43%。无论是使用 Friedman 检验 (p = 0.07),还是使用 wilcoxon 检验,在不同时间点与基线进行配对比较,这些变化都没有统计学意义 (图 4)。
CD4+/CD8+比值从基线时的 0.50 逐步增加到 6 个月时的 0.65,3 个月时达到最大峰值 0.87。
5、NK 细胞
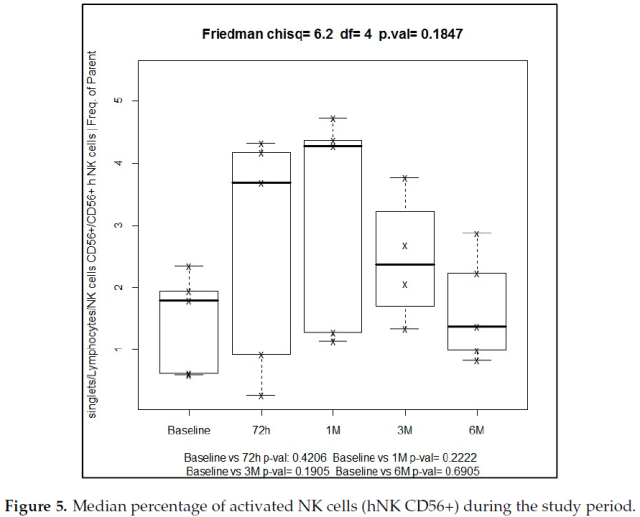
具有活化表型的自然杀伤细胞 (NK) 亚群,定义为 CD56+CD16+ (hNK CD56+),在随访期间从基线的 0.95% 增加到 6 个月时的 1.38%。然而,在不同时间点与基线进行配对比较时,使用 Friedman 检验 (p = 0.180) 和 Wilcoxon 检验,这些差异不具有统计学意义 (图 5)。
6、调节性 T 细胞(Treg)
不同表型和功能 Treg 亚群的分析策略是根据侧面散射和正向散射特征筛选淋巴细胞,对 CD4+T 细胞进行阻断。然后,CD4+T 细胞检测 CD4+CD25+Foxp3+Helios 细胞群。根据 CD45RA 和 Foxp3 的表达将 treg 分为功能亚群。流式细胞术分析所有细胞类型的代表性图表如图 6 所示。
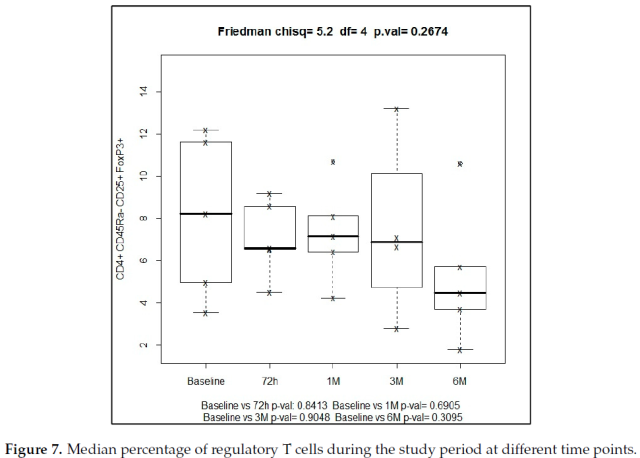
记忆性调节 T 细胞 (CD4+CD25+Foxp3+CD45RA-) 和 CD45RA-亚群在基线和 6 个月时的时间进程分别为 4.97% 和 4.46% (图 7)。

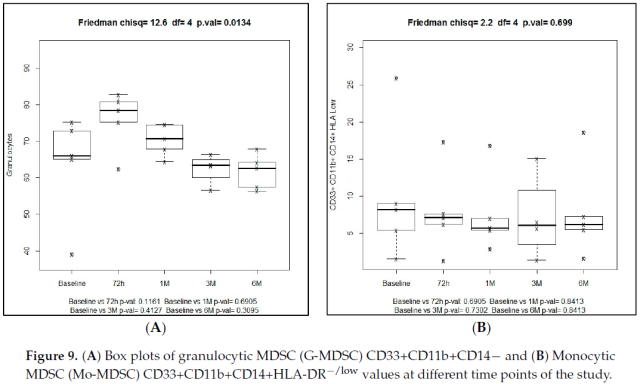
7、髓源性抑制细胞(MDSC)
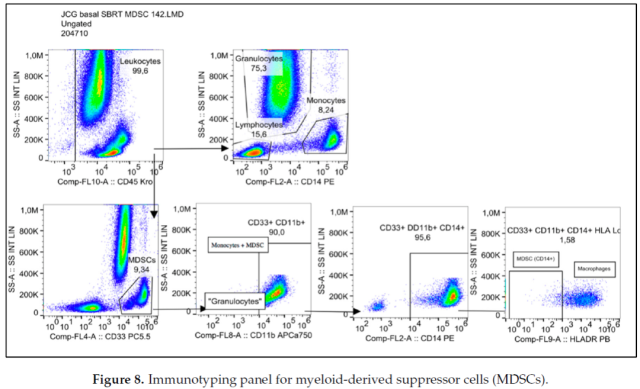
粒细胞性 MDSC (G-MDSC) 特征为 CD33+CD11b+CD14-,单核细胞性 MDSC (Mo-MDSC) 特征为 CD33+CD11b+CD14+HLA-DR-/low。流式细胞术分析所有细胞类型的代表性图表如图 8 所示。
总体而言,使用 SBRT 后 MDSCs 减少。在 G-MDSC 人群中,SBRT 给药 72 小时后增加,随后从基线的 66.1% 显著下降到 6 个月时的 62.6% (Friedman 检验,p = 0.01)。在整个研究期间,观察到 Mo-MDSC 群体的水平下降,从基线的 8.2% 下降到六个月时的 6.2%,但差异无统计学意义 (friedman 检验,p = 0.267)。在 G-MDSC 和 Mo-MDSC 人群中,不同时间点的中位数百分比与基线的比较没有统计学意义 (图 9)。
讨论
近年来,SBRT 对宿主免疫系统的影响受到越来越多的关注,特别是探索辐射在某些特定环境下诱导抗肿瘤免疫反应的能力,抗肿瘤 T 细胞是通过放疗实现肿瘤控制的关键角色。本研究提供了新的证据,证明 SBRT 对免疫系统有全身作用,外周血中活化的 NK 淋巴细胞增加 (从基线时的 0.95% 增加到 6 个月时的 1.38%),Treg 细胞中度减少 (从基线时的 4.97% 减少到 6 个月时的 4.46%)。有趣的是,这些变化在 SBRT 给药后 72 小时就已经被检测到。此外,观察到 MDSCs 在研究期间被放疗更广泛地修饰,免疫抑制成分减少,这是该研究的一个显著发现。
活化 NK 表型的增加,定义为 CD56+CD16+,与高细胞毒活性和低细胞因子产生有关,其在异体外周血干细胞移植中的应用已经证明,这种细胞亚群可以诱导肿瘤消退。在我们的研究中,我们发现从基线的 0.95% 增加到六个月时的 1.38%。这种效应可能在一定程度上解释了文献中一直报道的 SBRT 的良好结果。辐射导致细胞表面蛋白上调,因为肿瘤相关抗原或主要组织相容性 (MHC) 分子增强了活化淋巴细胞的活性。这种现象增加了外周血的交叉呈现和细胞转运。在 SBRT 后,可以假设我们增加了效应 T 细胞反应的启动和激活,这反过来可能是在随访中看到活化 NK 淋巴细胞增加的原因。
具有免疫抑制活性的 Treg 亚群的循环频率与肺癌和其他实体肿瘤患者较差的生存率相关。在我们的研究中,活化表型的调节性 T 细胞在 6 个月时显示出从基线值到值的系统性下降 (4.97%vs.4.46%),这可能代表了 SBRT 治疗这类肿瘤的治疗优势。
结论
本研究对接受 SBRT 治疗肺肿瘤的患者进行了初步研究,观察到循环血液免疫细胞群的一些变化。这些变化没有达到统计学意义,但包括免疫系统的免疫活性成分增加,CD56+CD16+nk 细胞增加,免疫抑制成分减少,CD4+CD25+Foxp3+CD45RA-调节性 T 细胞和 G-MDSC 和 Mo-MDSC 减少。值得注意的是,这些免疫反应早在 SBRT 给药后 72 小时就已经很明显了,并且在治疗后持续了 6 个多月。值得注意的是,不显著的结果受到少量样本的影响。为了检验 SBRT 对宿主免疫系统的影响,还需要基于能量计算的样本数量和参与者数量的进一步研究。了解 SBRT 引起的免疫反应可能有助于确定 SBRT 联合免疫治疗的潜在作用,如过继免疫治疗和/或检查点抑制作为肺癌患者未来的治疗选择。

图文来源:贝克曼库尔特生命科学