分子克隆 最强攻略
注意!!敲重点!!
小编为你呕心沥血整理了超多干货
以下可能是史上最全、最基础的
分子克隆知识



分子克隆是一个实验室最基础、也是最重要的实验技术,照例先介绍原理!
▋ 基本原理
分子克隆是在分子水平上提供一种纯化和扩增特定 DNA 片段的方法。也就是用体外重组的方法将目的基因插入克隆载体,形成重组克隆载体,通过转化或转导的方式,引入适合的受体细胞内,使目的基因得到复制与扩增,然后再从筛选后的受体细胞内分离提纯所需的克隆载体,可以得到插入 DNA 的许多拷贝,从而获得目的基因的扩增,并使宿主细胞获得新的遗传特征。
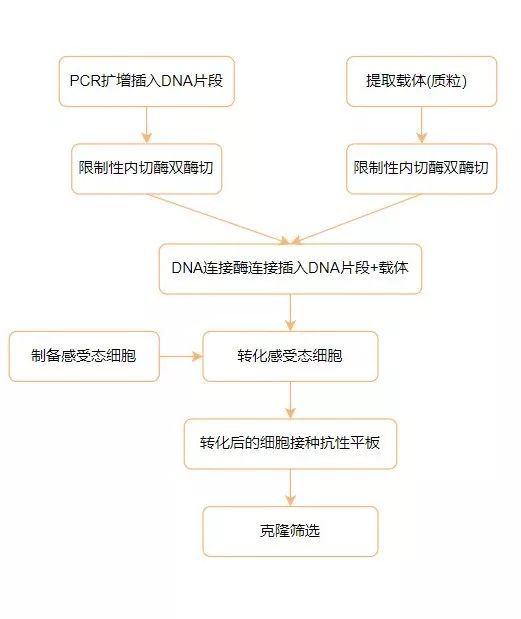
还是一脸懵逼?我们可以先了解传统的分子克隆技术,下面的流程示意图可以帮助你在脑海中形成一个初步的印象。
▋ 传统分子克隆基本流程
孔子曰:「敏而好学,不耻下问」。
老实说,上面的好多内容我都不懂……
没关系,那我们就从最基础的各种名词开始,为大家一一详解!
▋ 知识小点
PCR
分子克隆的第一步一般为 PCR,以获得大量的可供连入载体的目的基因。PCR 反应的基本成分包括:模板 DNA、引物、4 种脱氧核苷酸、DNA 聚合酶和适宜的缓冲液。PCR 由变性-退火-延伸三个基本反应步骤构成,具体步骤就在此省略。得到的 PCR 产物经琼脂糖凝胶电泳检测,有杂带的需要切胶回收目的片段。
详情可查看:实验技术入门高能小课堂-凝胶电泳篇
您可能会用到:
● 高保真的 Pfu DNA Polymerase
● 快速从凝胶中回收 PCR 产物 Wizard® SV Gel and PCR Clean-Up System
插入 DNA 片段
就是你想要克隆的 DNA 片段,也被称为插入片段(Insert)。它可以来自原核细胞或真核细胞,可以是基因组 DNA、另一质粒的一部分或线性 DNA 片段、实验室中人工合成的 DNA 片段,或者是从 mRNA 反转录产生的 cDNA。
无论来源类型如何,制备插入 DNA 片段时常用的第一个步骤是进行限制性内切酶酶切,产生匹配的粘性末端,以便接下来将片段插入载体中。
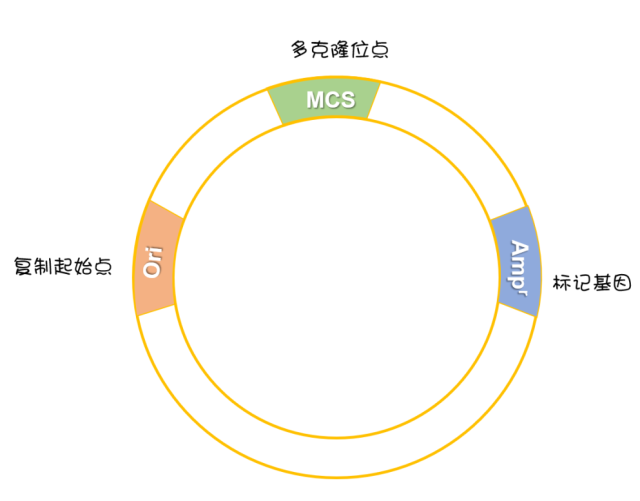
载体
载体(Vector)是能携带外源基因(或 DNA 片段)进入细胞复制、整合或表达的工具。载体一般是质粒,也可以是噬菌体。
可以作为克隆载体的条件:
● 具有对受体细胞的可转移性,能携带外源基因进入宿主细胞;
● 能在宿主细胞中自主复制,并实现外源基因的增殖;
● 具有由单一限制酶识别的位点组成的多克隆位点 (MCS);
● 具有用于选择克隆子的标记基因,例如抗生素耐受。如果宿主整合了质粒,它将可以在含有抗生素的培养基中存活,这样允许我们选择已经成功转化了的细胞。
● 克隆载体必须是安全的,不能含有对受体细胞有害的基因,并且不会任意转入受体细胞外的其他生物的细胞,尤其是人的细胞。
您可能会用到:
● 快速纯化质粒系统 PureYield™ Plasmid Miniprep System
在此小编额外为大家介绍几个小小小小的基础知识点:
限制性酶切位点
Restriction Enzyme cutting site
DNA 上一段碱基的特定序列,DNA 限制性内切酶能够识别出这个序列并在此将 DNA 序列切成两段。限制性内切酶位点外一般需要有保护碱基。
多克隆位点
Multiple Cloning Site, MCS
是包含多个(最多 20 个)限制性酶切位点的一段很短的 DNA 序列。每个限制性酶切位点通常是唯一的,即它们在一个特定的载体质粒中只出现一次。
在一些载体中,MCS 位于标记基因内,可筛选已经成功拼接进插入 DNA 片段的克隆子。例如后面会讲到的蓝白筛选。
宿主细胞
宿主细胞也叫受体细胞,指在转化或转导中接受外源基因的细胞。进行基因工程的宿主细胞一般为限制酶缺陷型,便于后续的克隆筛选。宿主细胞有原核受体细胞、真核受体细胞 (最主要是酵母菌)、动物细胞和昆虫细胞(其实也是真核细胞)。原核受体细胞中, 最常用的宿主细胞是大肠杆菌,它生长迅速,可广泛获得不同克隆载体。
一般可根据插入 DNA 片段的类型选择最佳载体及宿主细胞。
以下视频详细介绍了质粒载体的制备,
还有中英文双语对照哦 ~
How to perform plasmid prep
双酶切
分子克隆中通常将插入 DNA 片段和载体进行双酶切,即选择一种内切酶同时切割插入 DNA 片段和载体 DNA,以生成连接所需的互补末端 ,由于载体和插入 DNA 片段末端之间的兼容匹配性,二者仅可沿一个方向连接,因而这种方法可实现目的 DNA 片段的插入。进行双酶切时,同时提供两种酶所需最优的反应缓冲液和反应条件至关重要。因此,为确保酶切成功,应严格遵守供应商提供的双酶切反应建议。
您可能会用到:
● Promega 限制性内切酶
连接
连接 (Ligation) 是插入 DNA 片段和载体连接成为重组质粒的过程,需要 DNA 连接酶,最常用的就是 T4 DNA 连接酶,可连接 DNA 末端的 5′磷酸基和 3′羟基。连接反应通常还需要 ATP、DTT 和镁离子等成分,为了提高连接效率可优化反应条件。
您可能会用到:
● T4 DNA Ligase
点击链接观看视频,视频对连接的步骤进行了非常详细的介绍:
How to ligate a insert into a vector
感受态细胞
感受态细胞(Competent cell):通过理化方法诱导细胞,使其处于最适摄取和容纳外来 DNA 的生理状态。主要原理就是使细胞的通透性变大,便于外源基因或载体进入感受态细胞。一般可使用 CaCl2 法或电转法处理受体细胞制备感受态细胞,或直接进行购买。
您可能会用到:
● JM109 Competent Cells
● HB101 Competent Cells
转化
转化(Transformation)是受体细胞直接摄取供体细胞的 DNA 片段而获得新的遗传性状的过程。一般情况下质粒载体的转化效率很低,因此需要先制备感受态细胞。可根据下游应用的不同选择不同的感受态细胞。一般的转化步骤为将连接体系加到感受态细胞中冰上孵育,然后 42°C 下热激活,再至于冰上。处理后,部分质粒 DNA 会被受体细胞吸收,并在体内开始复制。亦可采用电转化的方法,使用低盐缓冲液或水洗制备的感受态细胞,通过高压脉冲的作用将载体 DNA 分子导入受体细胞。
具体的转化相关介绍请点击以下视频:
How to perform transformation
转化后即可在平板上接种细胞进行培养,点击下方链接观看视频查看详细步骤:
How to plate cells for culture
克隆筛选
接下来我们以最常用的蓝白筛选为例介绍克隆筛选,由于蓝白筛选使用 T 载体进行,因此不需要做双酶切。平板上最终产生的蓝、白菌落中,白色菌落为我们要的目的菌落。蓝白斑筛选是一种分子克隆中常用的克隆筛选方法。
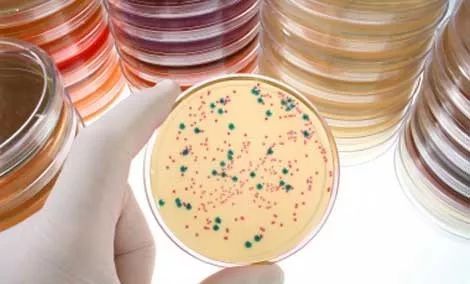
蓝白筛选原理
野生型大肠杆菌可以产生 β-半乳糖苷酶,可以将无色的化合物 X-gal(5-溴-4-氯-3-吲哚-β-D-半乳糖苷)切割成半乳糖和蓝色物质,使菌落呈现蓝色。也就是说在 X-gal 底物的平板中可以生长且菌落呈蓝色的是能产生 β-半乳糖苷酶的菌落。
适用于蓝白筛选的基因工程菌为 β-半乳糖苷酶缺陷型菌株。这种宿主细菌的染色体基因组中编码 β-半乳糖苷酶的基因发生突变,导致其编码的 β-半乳糖苷酶失去一个 α 肽段,从而不具有生物活性,及无法产生完整的 β-半乳糖苷酶。未转入质粒载体的受体细胞单独培养只能产生白色菌落。
您可能会用到:
● pGEM®-T Easy Vector Systems
一般的蓝白筛选都会和抗性筛选结合使用,抗性筛选可确定受体细胞是否吸收质粒载体。如选择带有抗生素基因标记的载体,不含载体的细菌不带有抗性基因,无法在含有抗生素的平板上生长;经过转化含有载体的细菌(不管是否含有插入 DNA 片段)都可表达抗生素耐受基因,因而可以在含有抗生素的平板上生长。
您可能会用到:
● Antibiotic G-418 Sulfate
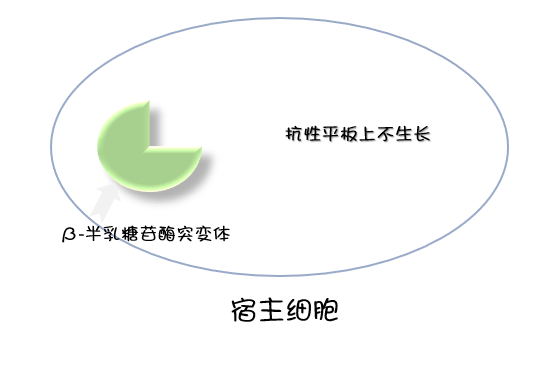
用于蓝白筛选的载体上具有 β-半乳糖苷酶启动子和编码 α 肽段的基因,编码 α 肽段的基因区段中包含一个多克隆位点(MCS),但其本身不影响载体编码的 α 肽链的活性。当该载体被转入宿主细胞中后,载体产生的 α 肽链与宿主细胞产生的 β-半乳糖苷酶突变体互补,具有完整酶的活性,即可将 X-gal 底物分解产生蓝色物质,这种现象叫 α 互补。也就是说转入细胞的载体的多克隆位点上没有插入 DNA 片段时,该菌落呈现蓝色。
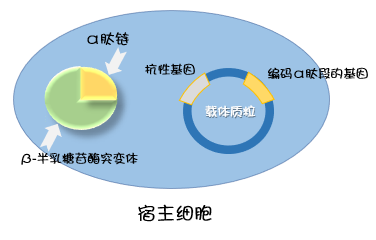
实验中通常添加 IPTG 激活载体中的启动子,携带空载体的细胞呈蓝色,插入 DNA 片段与外源基因连接后,重组质粒载体不表达 α 肽链,因此不能分解底物产生蓝色物质,培养表型呈现白色菌落。但是未转入质粒载体的细菌,由于不能形成完整的 β-半乳糖苷酶,菌落也呈现白色。
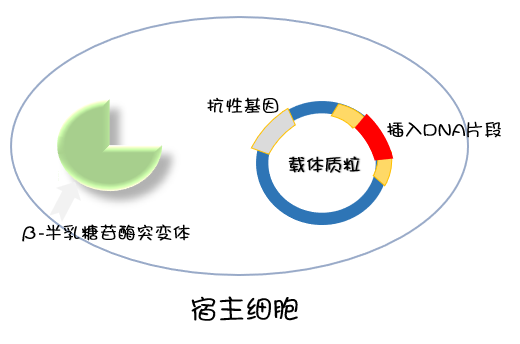
蓝白筛选步骤
具体了解蓝白筛选步骤可点击下方视频哦
Blue-White cloning

图片、视频来源:普洛麦格