「基因型鉴定」别让这些细节毁了你的 Genotyping!

基因型鉴定是应用基因工程小鼠的过程中必不可少的步骤。
此时你的耳边有没有回响起:啊——怎么又没 P 出来!这样的哀嚎呢?
虽然这个工作很基础,但真的常常会遇到问题,并不是几个字——鼠尾 DNA PCR——就简单搞定了。究其原因往往在于你不曾注意的细节哦。
也许很多同学觉得整个基因型鉴定过程就只是 PCR 反应。出了问题就拼命回想 PCR 过程中的操作:有没有忘加引物、忘加 DNA 模板、忘加酶,这一类「一不留神」的失误...... 发现都 OK 的啊,然后就一脸茫然了......
其实,基因型鉴定中,小鼠基因组 DNA 的制备也直接决定结果的好坏。
DNA 质量不高
为了能快速得到基因型结果,采用碱变性快速抽提 DNA 的方法,虽然过程很简单,但这样制备的 DNA 质量较差,很容易发生做不出结果的情况;或者使用直接 PCR 扩增试剂盒(将鼠尾在试剂中浸泡 20 分钟后取上清直接作为模板),由于试剂盒选择的种类比较多,不是所有的基因型鉴定方案都适合这种方式,特别是不同厂家的试剂盒扩增效率也不一样,如果发生 PCR 结果不理想的状况,还是建议用传统的 DNA 提取方法,先获得高纯度 DNA 模板,再进行 PCR 反应。
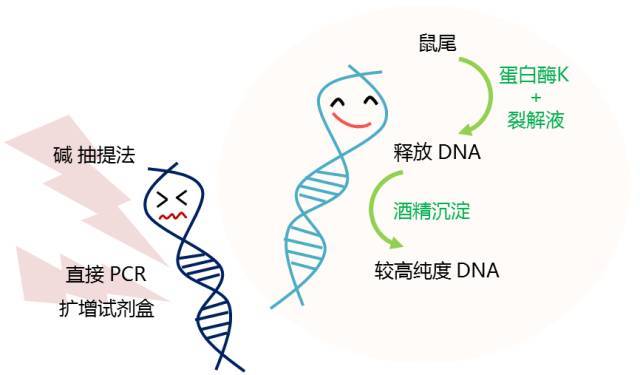
综合时间成本与成功率两大因素,利用裂解液加蛋白酶 K 配方裂解鼠尾,释放 DNA,并通过酒精沉淀的方法得到纯度较高的 DNA,是高效简便的小鼠基因组 DNA 制备方法。Protocol 如下,收好不谢!
小鼠基因组抽提 Protocol
• 蛋白酶 K 贮存液的配制:
用超纯水彻底溶解蛋白酶 K 粉剂, 使终浓度为 10 mg/ml,分装成 1 ml/vial, -20 度保存。
• 裂解液的主要成分:
SDS、EDTA、Tris/HCl、NaCl。
• 小鼠尾基因组 DNA 提取步骤:
(1)剪取小鼠尾端约 0.5 厘米(视鼠龄及鼠尾粗细可调整, 尽量使鼠尾体积相互接近),将鼠尾放入已编号 1.5 ml 离心管中并盖好盖子。
(2)每管加 0.5 ml 裂解液和 50µl 蛋白酶 K 贮存液并将盖盖紧。
(3)将离心管置于杂交管中并用纸团稍加固定。
(4)将离心管置杂交炉中,56℃ 转动过夜。
(5)次日将样本于室温,12000rpm 离心 10 分钟。
(6)上清倒入 1.5 ml 离心管中,加 1 ml 无水乙醇(约 2 倍上清体积),盖紧盖子后轻摇,可见絮状沉淀。13000rpm, 15 min, 弃上清。
(7)加 70% 乙醇 1 ml,洗涤,13000rpm 离心 10~15 min,弃上清,收集沉淀,室温晾 10~15 min。
(8)每管加 80~100µl 灭菌水,盖好后置室温或 37℃ 一小时充分溶解。在室温中放置数小时,待 DNA 全部溶解后-20℃ 保存,或直接进行 PCR 或杂交等实验。如 DNA 溶解不完全, 在 37℃ 水浴中放置 30~60 min,但不可过夜。DNA 样品的 OD260/280 在 1.8-2.0 之间。
注意:
裂解鼠尾一定要充分,有条件尽量使用杂交炉。因为如果裂解过程中组织与裂解液始终保持静止,而没有翻转的过程,这会导致 DNA 和鼠毛之类的杂质没有完全分开。离心去除杂质的过程中,DNA 就会随着这些杂质一起被抛弃了。
DNA 模板浓度过高
做人不能太贪心。DNA 模板不是越多越好的。一般建议将模板浓度控制在 50-100ng/µl 进行 PCR 扩增。
PCR 酶不合适
DNA 质量很好,浓度也控制在标准浓度,PCR 还是做不出来,原因可能是 PCR 酶没有选择好,不同的 PCR 产物 GC 含量不一样,遇见 GC 含量很高的产物往往常规的 PCR 酶没法做出很好的结果。一般在定制的基因工程小鼠鉴定方案中会指出适合的 PCR 酶的货号,按照已验证的方案以及推荐的酶体系,一般不会出错。
看一看基因工程小鼠的鉴定方案一般长什么样子:
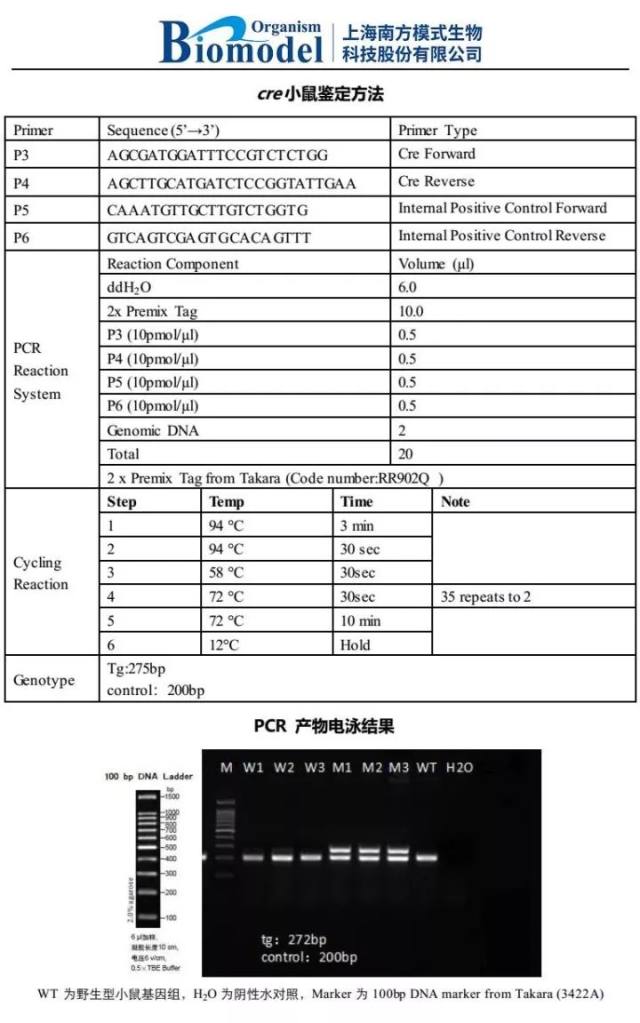
+此处有 Tips +
上面的电泳图中你是不是发现了什么?为什么转基因 Cre 小鼠的鉴定结果会有两条带?除了待检测的样品以外,还有两个 Control 对照孔?
没错!这里小编要提醒大家,对照 Control 的设置非常重要!这恰恰是很多同学所忽略的。在一般的 Genotyping 里面,每一次鉴定至少要设置一个 WT Control 和一个 H2O,也就是 Blank Control。
WT Control 的意义:
(1)帮助我们快速判断基因型。在 Flox 小鼠或片段 knockin 小鼠的鉴定中,如果产物条带仅有一条或其中有一条与 WT Control 一致,那么可以判断该样本为 WT 或 杂合子。
(2)帮助我们判断 PCR 体系是否 work。如果 PCR 产物在跑电泳的时候连 WT Control 的样品都没有出条带,那么说明 PCR 体系有问题,需要做相应的调整,比如考虑更换引物或 PCR mix 等。
Blank Control 的意义:
H2O 对照主要是用来质控 PCR 体系是否发生了污染。如果 H2O 对照都有条带,说明整个 PCR 体系存在污染的问题,这个 PCR 结果不可信。
Internal Positive Control Primers 的意义:
Internal Positive Control 一般用在随机插入转基因小鼠的鉴定中。通常转基因鉴定引物是只针对插入的外源 DNA 序列的,所以没有发生随机整合的小鼠 DNA 模板不会有 PCR 产物产生。这样一来很容易发生假阴性的问题。也就是说电泳没有条带,我们无法判断到底是外源基因未整合的阴性结果,还是由于 PCR 体系本身的问题造成阴性结果。所以需要另一对在所有小鼠中都能获得 PCR 产物的阳性对照引物作为内控,即 Internal Positive Control,用于判定 PCR 体系和模板质量是否合适。
PCR 仪
如果 PCR 仪长期未做温度校准,那么仪器显示的温度和实际温度就存在差异。即使拿到定制小鼠的鉴定方案,还是建议在自己常用的 PCR 仪上摸一个退火温度的温度梯度,找到最合适的 PCR 退火温度再进行整体 PCR 鉴定。
找不到鉴定方案
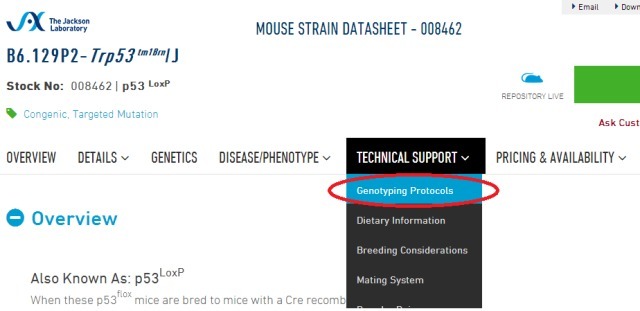
如果是从 jaxlab 购买的小鼠品系,可以从 jaxlab 的官网上查找对应的鉴定方案。方法如下:
品系信息页面的 「Technical support」 菜单,下拉第一栏 「Genotyping Portocols」
跳转到下方链接处,点击即可查看
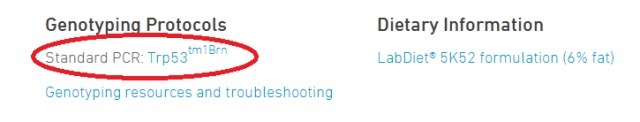
有时候 jaxlab 提供的方法中,退火温度不明确,你会看到一个降落 PCR 的方法,例如:
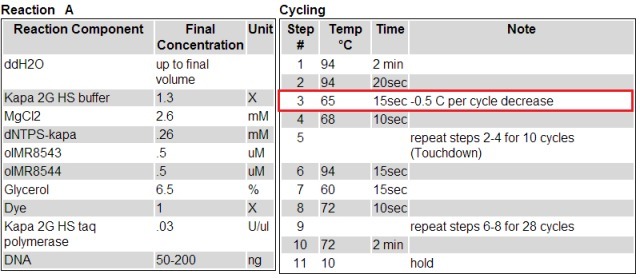
如果你觉得降落 PCR 太麻烦,还是想用一个明确的退火温度进行 3 步法 PCR,那么建议还是先摸一个退火温度的温度梯度,找一个合适的退火温度。当然,也会有官方提供的引物不适合单一退火温度的情况,那么就可能需要自己重新设计引物、建立 PCR 鉴定体系了。
文章来源南模生物,更多技术资料详见:http://c.biomart.cn/modelorg/animal