前言:脑部基因转导工具如何选择?是否可轻松跨越血脑屏障,不用再进行复杂的外科手术?阅读全文,神经研究不用再烦“脑”了,参与文末答题赢好礼!
神经系统疾病的主要研究对象有:1. 神经退行性疾病:包括阿尔茨海默病(Alzheimer's disease,AD)、帕金森病(Parkinson's disease,PD)等;2. 脑瘤;3. 疼痛;4. 精神疾病等。本文从神经性疾病研究模型、基因转导病毒工具、以及病毒注射方式的选择等几个关键问题展开,分述如下:
一、神经系统疾病研究的主要动物模型
(一)阿尔茨海默病
1、前脑胆碱能系统损害模型
前脑胆碱能系统损害模型是用机械的、化学的或免疫的方式损害前脑胆碱能系统,造成动物前脑胆碱能系统病变和相关的认知缺失。
2、自然衰老认知障碍 AD 动物模型
自然衰老认知障碍模型是用行为筛选的方式,将老年灵长类或鼠类认知能力下降较严重的个体选择出来,它们通常表现出较为严重的脑老化的病理特征。
3、转基因动物模型
转基因动物模型是用实验方法将外源性 App 基因(野生或突变型)导入,使动物过多地表达 App 基因或突变产物,引起中枢神经系统的 Aβ的沉积和相关病理损害或临床症状。
4、其它损害造成的 AD 动物模型
慢性脑缺血痴呆模型:结扎脑供血动物,脑长期供血不足,造成认知缺失和病理损害。
(二)帕金森病
1、6-羟多巴胺制备 PD 模型
根据 6-OHDA 的注射部位及注射剂量不同,来造成模拟不同阶段帕金森病的动物模型。
2、用 1-甲基-4-苯基-1,2,3,6 四氢吡啶(MPTP)制备 PD 动物模型
常采用皮下、静脉、腹腔注射和肌肉给药。
3、其他建立模型的方法
利血平模型,去氧麻黄碱(METH)模型,3-硝基酪氨酸(3-NT)模型,鱼藤酮模型,甲基苯丙胺模型,除草剂模型,白酶抑制剂模型,基因模型,脑炎病毒感染大鼠 PD 模型,Fe3+模型,机械损伤模型等。
(三)脑瘤
1、裸鼠成瘤模型
2、颅内接种的脑胶质瘤动物模型
3、可用甲基胆蒽等化学致癌物质埋于皮层
(四)疼痛
疼痛主要分为以下五大类:炎症痛,中枢神经痛,外周神经痛,癌症痛,内脏痛,都是不同的神经机制,都有不同的动物模型。
(五)精神疾病
1、药物诱导精神病模型
地卓西平马来酸盐诱发近交系 BALB/c 小鼠产生类似精神分裂症
2、精神病相关基因敲除转基因动物模型
基于中枢神经递质失调以及神经发育假说的遗传模型,多巴胺转运体基因敲除(DAT-KO)是一个研究较多的模拟精神分裂症的动物模型。
二、病毒的选择
在体动物模中常常需要提高或者降低某个基因的表达,那么该选择哪种病毒工具来达到处理的效果,汉恒生物专业提供以下三种病毒:慢病毒、腺病毒、腺相关病毒:
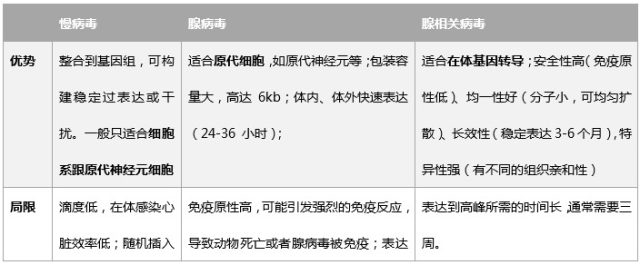
表 1:汉恒生物三种常用病毒优缺点比较
慢病毒因其滴度低,一般用于感染细胞;
腺病毒虽然载体容量最大,表达快速,但其分子比较大,会被体内免疫系统识别而清除,故表达周期短且免疫原性高,一般不用于神经性疾病的动物模型;
腺相关病毒分子机比较小,易于扩散,均一性好且不易被免疫系统识别,因而能在体内稳定表达 3-6 个月;另外有研究证明大于 70% 的人都携带一种或者几种血清型的 AAV,AAV 不参与任何一种人或者动物疾病的发生,故安全性高;还可以选择不同的血清型感染,相对特异性强。三种病毒在小鼠脑部的表达图可以参考下图,明显 AAV 更适合(图 1)。
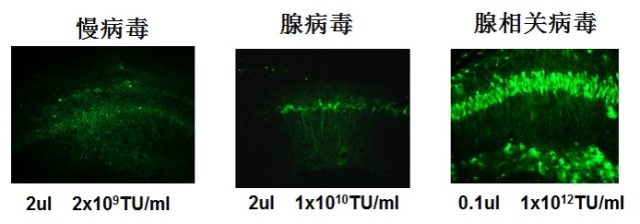
图 1:针对小鼠海马组织注射不同的病毒效果图
三、腺相关病毒的选择
1、不同的血清型和特异性启动子:
AAV 有不用的血清型,可以特异性亲和不同的组织,对于脑部,一般选择 AAV2/AAV9。但是,脑部有不同种类的神经细胞,无论是 AAV2 还是 AAV9,都不能只在某种神经细胞中绝对特异性表达,于是针对不同的神经细胞,我们研发出了不同的启动子类型,以期能在特定细胞中表达:
Syn-感染全脑神经元细胞
CaMKII-感染全脑兴奋性神经元细胞
GFAP-感染全脑星形胶质细胞
图 2 所示的是用 GFAP 特异性启动子特异性感染星型胶质细胞示意图(图 2)。
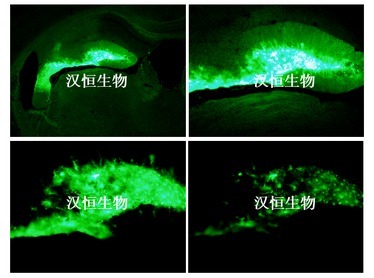
图 2:星型胶质细胞特异性启动子的 AAV 注射小鼠海马组织效果图
病毒:HBAAV-GFAP-GFP,10^12vg/ml
实验动物:C57 小鼠,8 周龄
注射方法与体积:脑定位注射,海马区,1ul
检测方法:注射 3 周后冰冻切片,荧光显微镜检测
2、DIO 元件:
对于特异性更高的实验,比如只需要在脑区表达某个基因,可以用含有 DIO 元件的病毒。DIO 原件的病毒只有在 cre 动物模型中才会表达。因此,只需用 cre 敲入动物某个脑区,再将含有 DIO 元件的病毒打入特定脑区,便能实现绝对的特异性表达。
3、穿透血脑屏障的 AAV/BBB:
因为血脑屏障的存在,通过尾静脉或者其他脑部以下部位给药,很难到达脑部,但是脑部注射操作麻烦而且对动物伤害比较大,汉恒生物研发出了一种可以穿透血脑屏障的 AAV,可以直接通过尾静脉注射感染全脑。
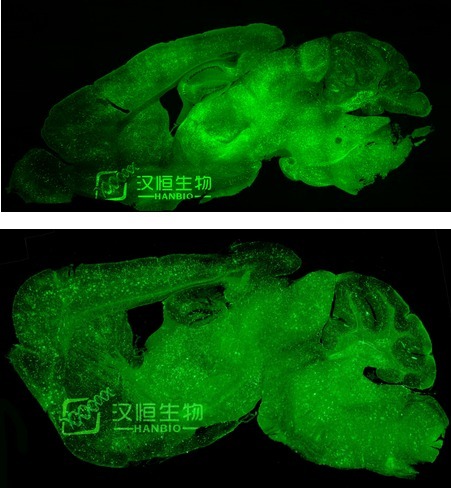
图 3:HBAAV/BBB 注射小鼠尾静脉可透过血脑屏障感染脑组织
病毒:汉恒生物穿血脑屏障 AAV2/BBB-CAG-Zsgreen
滴度:1.4x10^12 vg/ml
注射量:100 微升
注射部位:尾静脉
检测方法:注射感染 3 周,取材切片,confocol 检测拍照
4、神经逆行标记 AAV-Retro:
人体的感知、运动等功能都和神经元的长距离信号传导密切相关。在科学研究中,如何高效标记和操作投射神经元一直是广大科研工作者所面对的难题。标记物在神经元中沿其轴突从胞体行末梢进行示踪为顺行标记,从末梢行胞体进行示踪的为逆行标记,而拥有逆行标记能力的研究工具比较缺乏。
汉恒生物采用自包装神经逆行标记病毒 AAV2/retro-EGFP 病毒注射小鼠 SNc(黑质致密部)部位,3 周后取材切脑片检测其他脑区的荧光表达情况。发现在 MGP(内侧苍白球)、LGP(外侧苍白球)、PFC(前额叶皮层)等部位可以检测到明显荧光表达,证明 SNc 神经元对 MGP、LGP、PFC 等区域均有大量投射。
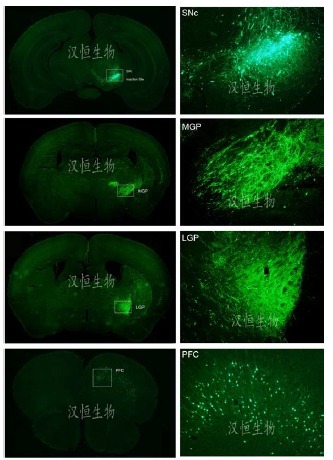
图 4:AAV2/retro-EGFP 病毒注射小鼠 SNc 部位可逆行标记至 MGP、LGP、PFC 部位
病毒:AAV2/retro-EGFP
滴度:1.3x10^12 vg/ml
注射量:1 微升
注射部位:SNc(核质致密部)
检测方法:注射感染 3 周,取材切片,confocol 检测拍照
5、光遗传学和化学遗传学 AAV:
光遗传学(optogenetics)是结合了光学(optics)及遗传学(genetics)的技术,能在活体动物甚至是自由运动的动物脑内,精准地控制特定种类神经元的活动。光遗传学在时间上的精确度可达到毫秒级别,在空间上的精确度则能达到单个细胞级别。这项技术目前在神经科学领域应用非常广泛,未来可能会应用于多种神经和精神疾病的治疗,如帕金森氏病、阿尔茨海默病、脊髓损伤、精神分裂症等。
化学遗传学是指:对一些生物大分子实行改造,使其能和先前无法识别的小分子进行相互作用的过程。化学遗传学和分子遗传学一样,均是遗传学的一个分支,由于其可控的、可逆的(可以随时加入或除去化合物,从而启动或中断特定的反应)特性,已经在信号转导、药物开发、功能基因组学等方面的研究中得到了广泛的应用。如下左图为光遗传学原理,右图是化学遗传学原理:
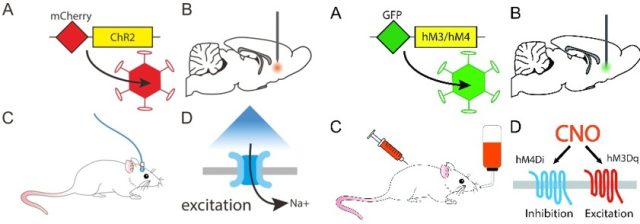
图 5:左图为光遗传示意图;右图为化学遗传示意图
四、注射方式
1、脑部立体定位注射:AAV9
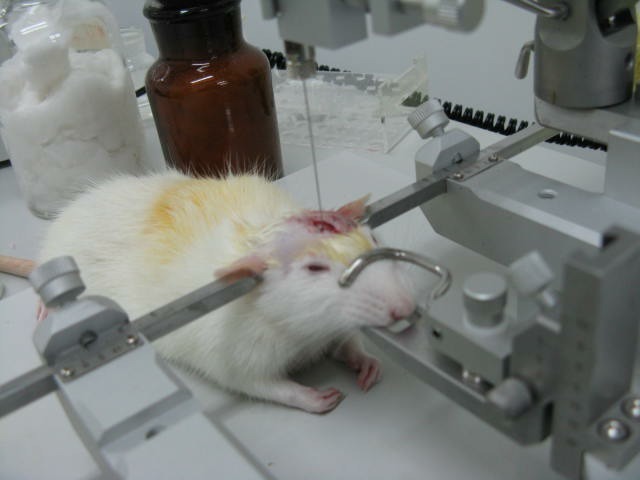
图 6:脑立体定位注射图
中枢神经系统内具有多种中枢核团,掌握确定中枢某一核团的方法对研究神经疾病的发生发展机制具有重要的意义。脑部立体定位注射是通过立体定位仪将病毒或者药物直接注入大脑特定组织。但是这种方法有一个弊端,需要采用开颅手术,对操作者要求比较高,而且动物伤害性比较大。具体操作步骤如下:
大/小鼠禁食后水合氯醛麻醉(如果不禁食,术后很容易引起大鼠腹胀气)。将大鼠固定于脑立体定位以上。碘伏消毒后,剪开头皮,找到大鼠脑部前囱位置。通过查询脑立体定位图谱确定需要定位的核团位置,并使用微孔牙科钻打孔,随后缓慢进行注射。定位注射后缝合头皮,即可完成脑立体定位注射。
2、尾静脉注射:
汉恒生物研发的穿透血脑屏障的病毒 AAV/BBB 可以直接从尾静脉注射到达脑部,是最简单的一种注射方式。具体操作步骤如下:
将小鼠放在金属笼或鼠夹中,通过金属笼或鼠夹的孔拉出尾巴,用左手抓住小鼠尾巴中部。小鼠的尾部有 2 条动脉和 3 条静脉,2 条动脉分别在尾部的背侧面和腹侧面,3 条静脉呈品字型分布,一般采用左右两恻的静脉。拔去沿尾部静脉走向的毛,置尾巴于 45~50℃ 温水中浸泡几分钟或用 75% 酒精棉球反复擦拭尾部,以达到消毒和使尾部血管扩张及软化表皮角质的目的。行尾部静脉注射时,以左手拇指和食指捏住鼠尾两恻,使静脉更为充盈,用中指从下面托起尾巴,以无名指夹住尾巴的末梢,右手持 4 号针头注射器,使针头与静脉平行(小于 30°角),从尾巴的下 1/4 处进针,开始注入药物时应缓慢,仔细观察,如果无阻力,无白色皮丘出现,说明已刺入血管,可正式注入药物。有的实验需连日反复尾静脉注射给药,注射部位应尽可能从尾端开始,按次序向尾根部移动,更换血管位置注射给药。拔出针头后,用拇指按住注射部位轻压 1~2 min,防止出血。
尾静脉注射示意图如下:

图 7:尾静脉注射示意图
3、其他注射方式介绍:
①皮下注射:
做皮下注射常选项背或大腿内侧或者腋下的皮肤。操作时,常规消毒注射部位皮肤,然后将皮肤提起,注射针头取一钝角角度刺入皮下,把针头轻轻向左右摆动,易摆动则表示已刺入皮下,再轻轻抽吸,如无回血,可缓慢地病毒或者细胞注入皮下。拔针时左手拇、食指捏住进针部位片刻,以防止药物外漏。皮下注射示意图如下:

图 8:皮下注射示意图
②脊髓注射:
老鼠的后脸由无菌纱布覆盖,中部有一个孔,在 Th12-L3 脊椎动物的水平上形成一个矢状面(约 1 厘米长)的皮肤。皮肤切口由手术刀制成,出血通过棉花互换停止。小鼠的脊柱被分别用脊椎夹钳装置固定在切口的头部和尾部。Th13 和 L2 椎骨表面的同侧(相当于神经损伤)脊柱肌肌肉被微观小心切除。Th13 和 L1 的表面通过棉花互换清除。用颅骨钻头去除 L1 椎骨的左侧部分(与神经损伤同侧),Th13 和 L1 之间的椎间隙中的软结缔组织用微型力量清除以暴露脊髓硬膜。使用 30 G 胰岛素注射器(中线的 0.5 mm)小心地去除三层脊髓膜。手术在手术显微镜下进行。将 30 G 胰岛素注射器的尖端倾斜插入膜中,然后轻轻拉起。在膜上形成孔,玻璃毛细管通过孔插入脊髓。将玻璃毛细管固定在立体定位仪器中,并使用 Legato 注射器泵填充 0.5μl 慢病毒工作溶液,然后插入脊髓背角。玻璃毛细管的速度和深度由数字立体定位仪控制。毛细血管尖端达到脊髓 IV 水平(脊髓背根进入区域的深度约 0.4 毫米)。在允许神经组织容纳玻璃毛细管 2 分钟后,以 50nl / min 的速度注入慢病毒溶液。同时,以 50μm/ min 的速度取出玻璃毛细管,以确保从层板 IV 到层板 I 的感染。对于每只动物,每次注射 0.5μl。显微注射后,用 4-0 丝缝合背肌。使用镊子将切口皮肤拉到一起,并使用手术针缝合。将小鼠保持在加热垫上,直到小鼠醒来。
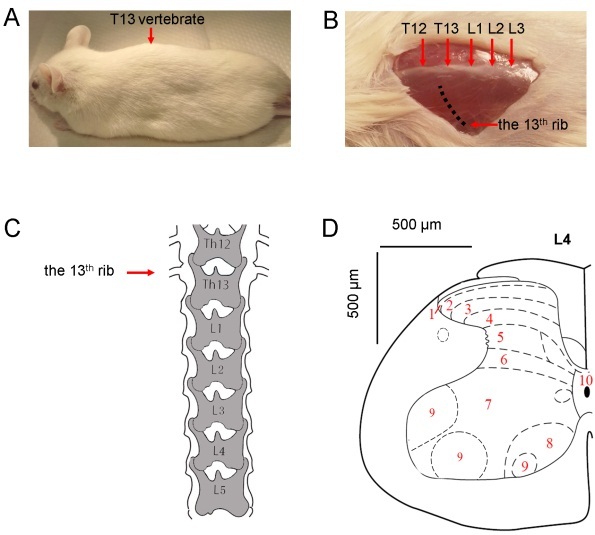
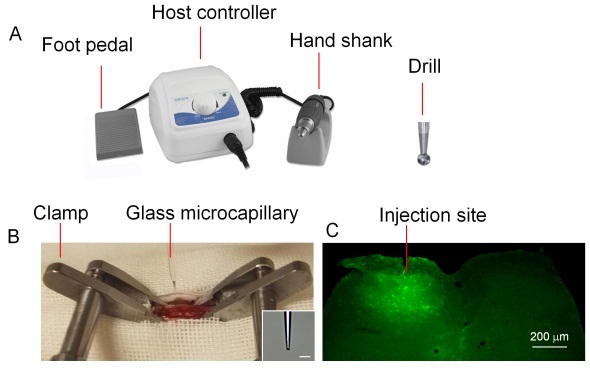
图 9:脊髓注射示意图
看完上面的内容,赶紧来做个小测试吧!
1、共包含 6 个答题,每个答题包含 10 道题目,包含单选题和多选题;
2、每位会员需登录之后才能答题,每个答题限定 2 次机会;
3、得分相同的选手,答题用时较短者获胜;
4、每个答题排名前 5 名站友将获得 5000mAh 小米移动电源一台,每人限一份奖品;
5、答题之前请先查看文章;
6、活动结束后统一公布中奖名单。
