在精准医疗快速发展的今天,液体活检作为一种非侵入性的癌症监测手段,正逐渐成为临床实践的重要组成部分。然而,传统的液体活检技术主要依赖于循环肿瘤 DNA(ctDNA),其在反映肿瘤异质性和细胞表面蛋白表达方面存在局限。循环肿瘤细胞(Circulating Tumor Cells, CTCs)作为从原发或转移灶脱落到血液中的完整癌细胞,携带了 DNA、RNA、蛋白质等多维度信息,是理想的液体活检分析对象。但由于 CTCs 在血液中极为罕见,且其表面标记物存在高度异质性,如何从数十亿血细胞中高效、无偏倚地富集 CTCs,一直是领域内的核心挑战。
链霉亲和素-生物素系统,凭借其近乎不可逆的高亲和力,已成为生物分离领域的「黄金标准」。近期,一项发表于《Nature Communications》的研究,正是将链霉亲和素包被的磁珠与创新的微流控技术相结合,成功开发了高通量 CTC-iChip 平台,实现了从白细胞分离术产品中大规模富集 CTCs,为细胞水平的液体活检带来了突破性进展。
该技术通过生物素化抗体标记白细胞,再利用链霉亲和素磁珠进行高效去除,实现了对大量血液样本中 CTCs 的无偏倚富集,为癌症的分子分型、耐药机制研究和治疗策略优化提供了全新路径。文献题目为《Tumor cell-based liquid biopsy using high-throughput microfluidic enrichment of entire leukapheresis product》。

一、技术背景与问题意识:从「稀有」到「丰富」的 CTC 富集革命
循环肿瘤细胞(CTCs)在血液中的稀有性一直是制约其临床应用的瓶颈。传统方法如 CellSearch 系统仅能处理少量血样,且多依赖于上皮细胞粘附分子(EpCAM)等表面标记物进行阳性筛选,这导致许多不表达 EpCAM 的 CTCs 亚群(如发生上皮-间质转化的细胞)被遗漏。
本研究的核心创新在于采用了 「负向富集」策略。该策略不直接捕获 CTCs,而是通过去除血液中大量的白细胞来实现 CTCs 的纯化。这其中,链霉亲和素磁珠扮演了至关重要的角色。研究团队首先使用生物素化的抗体混合物靶向白细胞表面的 CD45、CD16 和 CD66b 抗原,随后引入链霉亲和素磁珠。磁珠通过其表面的链霉亲和素与抗体上的生物素迅速、稳固地结合,从而将白细胞「武装」起来。最后,这些被磁珠标记的白细胞在特制的高通量微流控磁力分选芯片中被高效剔除,最终得到高纯度的 CTCs 群体。
该方法的最大优势在于其表位无关性,它不依赖于任何肿瘤特异性标记物,因此能够捕获所有类型的 CTCs,包括那些低表达或不表达上皮标志物的细胞,确保了信息的完整性。
二、技术核心优势:高通量、高纯度、多表位无关的 CTC 捕获平台
CTC-iChip 技术的成功源于以下几大核心优势,而链霉亲和素磁珠是实现这些优势的基石:
(1) 高通量处理能力:通过并行化 16 组惯性分离单元与两级磁力分选系统,该平台可每小时处理超过 100 mL 样本,相当于 30 亿个细胞。
(2) 高纯度富集与链霉亲和素磁珠的关键作用:采用磁透镜技术,并结合链霉亲和素磁珠的高效标记,实现了对 WBCs 的 99.96% 去除率。磁珠与生物素化抗体之间的高亲和力确保了标记的特异性和牢固性,是达成极高白细胞去除效率的根本。
(3) 表位无关的负向富集策略:不依赖于 EpCAM 等标记物,适用于各类癌症类型,包括低表达上皮标志物的肝癌、三阴性乳腺癌和黑色素瘤。
(4) 细胞完整性保护:微流控过程中无细胞固定,避免了化学损伤,保障了下游单细胞 RNA 与 DNA 测序的可行性。
(5) 防堵塞设计:通过惯性聚焦与磁力偏转将细胞引导至流道中心,有效防止了因细胞聚集或 NETs 引起的微流控堵塞。
三、关键实验与发现:从 CTC 捕获到单细胞多组学解析
1. 构建高通量 CTC 富集技术平台
本研究建立了一套完整的高通量 CTC 富集与分析流程。首先通过诊断性白细胞分离术从患者体内采集约 100 mL 白细胞富集样本,随后采用生物素化抗体靶向白细胞表面标志物 CD45、CD16 和 CD66b。样本经过微流控去碎片芯片去除红细胞和血小板后,与链霉亲和素包被的磁珠进行孵育,最后通过两级磁力分选芯片实现白细胞的高效去除。整个流程确保了 CTC 的高回收率和高纯度,为下游分析提供了优质样本。
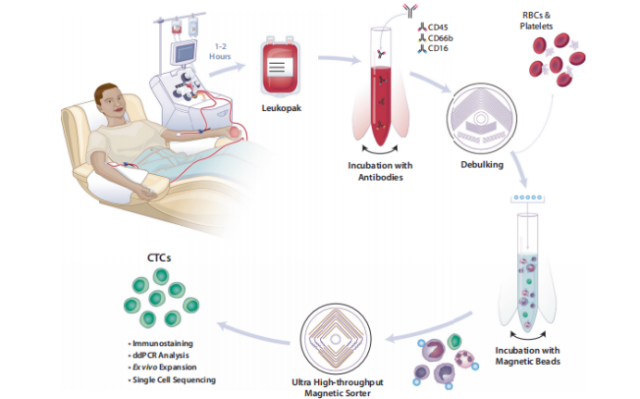
图 1. 使用微流控技术富集诊断性白细胞单采样本中高体积 CTC 的示意图
重要实验结论:
(1) 建立了从样本采集到单细胞分析的全流程技术体系,实现了 CTC 的系统性研究(图 1 整体流程)
(2) 负向富集策略避免了对肿瘤表位的依赖,确保了各类 CTC 亚群的完整捕获【图 1 中 "Immunostaining"(免疫染色)部分】
(3) 链霉亲和素磁珠与生物素化抗体的高效结合是实现高纯度富集的技术关键【图 1 中 "Incubation with Magnetic Beads"(磁珠孵育)环节】
2. 患者样本特征与白细胞分离术参数优化
研究团队对七名转移性癌症患者进行了诊断性白细胞分离术,系统评估了分离过程中的关键参数。通过 Spectra Optia 系统在连续单核细胞收集模式下,平均处理 5.32 升血液体积,获得了 108.9 mL 的白细胞富集产物。对产物的细胞组成进行了详细表征,包括白细胞浓度、血小板计数和红细胞残留量等指标。
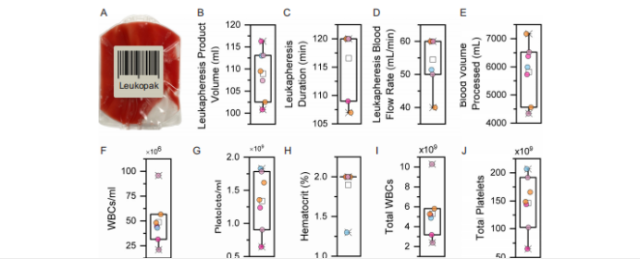
图 2. 七名癌症患者来源的白细胞袋(n = 7 个生物学重复)的患者诊断性白细胞单采参数和细胞含量
重要实验结论:
(1) 白细胞分离术产品中白细胞浓度达到 48.7×106 cells/mL,是正常全血的 8 倍(图 2F)
(2) 血小板浓度提升至 1.3×109 cells/mL,为正常血液的 4 倍(图 2 G)
(3) 红细胞含量得到严格控制,平均红细胞比容低于 2%(图 2 H)
(4) 单个白细胞分离术产品可获得 53 亿个白细胞,是 10 mL 血样的 88 倍(图 2I-J)
3. 微流控芯片实现高效细胞分选
研究团队设计了专门的微流控去碎片芯片和磁力分选芯片。去碎片芯片利用惯性分离原理,通过矩形微柱阵列实现有核细胞与红细胞、血小板的高效分离。磁力分选芯片则采用磁透镜技术,将磁场梯度提升至 15,400 T/m,通过两级分选策略分别去除高表达和低表达白细胞标志物的细胞群体。
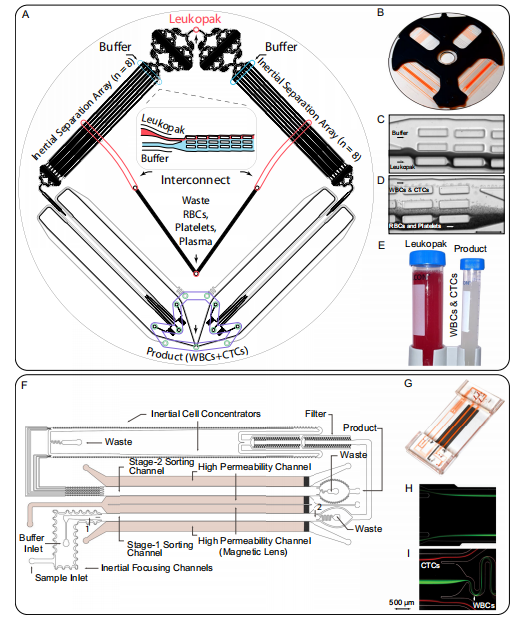
图 3. 用于处理白细胞袋的高通量微流控设备
重要实验结论:
(1) 去碎片芯片可去除 99.95% 的红细胞和 99.98% 的血小板,同时实现白细胞和 CTC 的高回收率(图 3C-E)
(2) 磁透镜技术使分选通量达到 48 mL/小时,处理能力比传统的 CTC-iChip 高 60 倍(图 3F-G)
(3) 两级分选设计有效解决了白细胞表面标志物表达异质性问题(图 3 H-I)
(4) 防堵塞设计确保了大体积样本处理的稳定性(图 3I)
4. CTCs 形态异质性及分子验证
通过多光谱免疫荧光成像技术对富集的 CTC 进行表征。使用 DAPI 标记细胞核,肿瘤标志物抗体混合物标记 CTC,白细胞标志物抗体混合物鉴别残留白细胞。结合数字化图像分析和人工验证,系统评估了 CTC 的形态特征和分子表型。同时通过液滴数字 PCR 验证 CTC 的组织来源特异性。
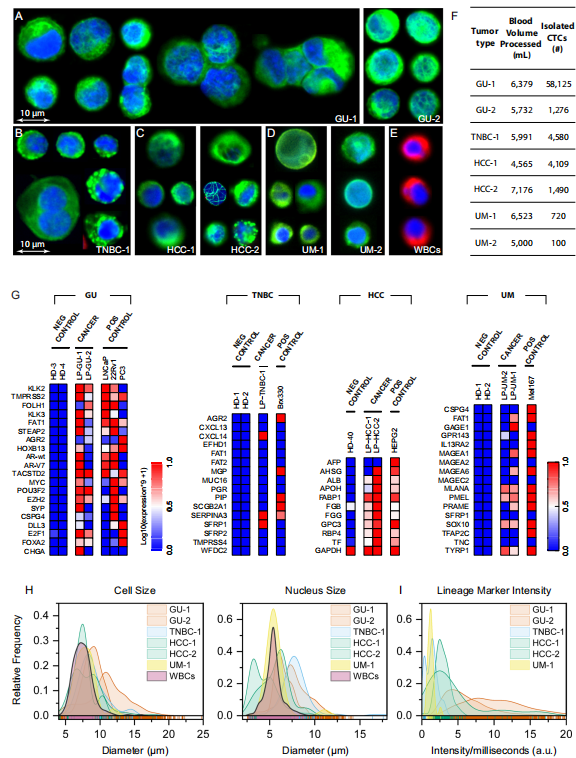
图 4. 微流控富集的 CTC 群体分析
重要实验结论:
(1) 七名患者 CTCs 数量差异显著,平均捕获 10,057 个,最高达 58,125 个(图 4F)
(2) CTC 与白细胞在细胞大小上存在显著重叠,67% 的 CTC 直径落在白细胞范围内(图 4 H)
(3) 微滴数字 PCR(ddPCR)验证了 CTC 的组织来源特异性基因表达谱(图 4 G)
(4) CTCs 中肿瘤标志物表达强度存在显著个体内差异,提示表型异质性(图 4I)
5. 单细胞基因组学揭示 CTC 异质性
通过流式细胞分选从富集样本中分离单个 CTC,包括 EpCAM/PSMA 阳性细胞和双阴性细胞。对单个细胞进行核质分离,分别进行低覆盖全基因组测序和 RNA 测序。利用 Ginkgo 平台分析拷贝数变异,鉴定肿瘤特异性基因组改变。
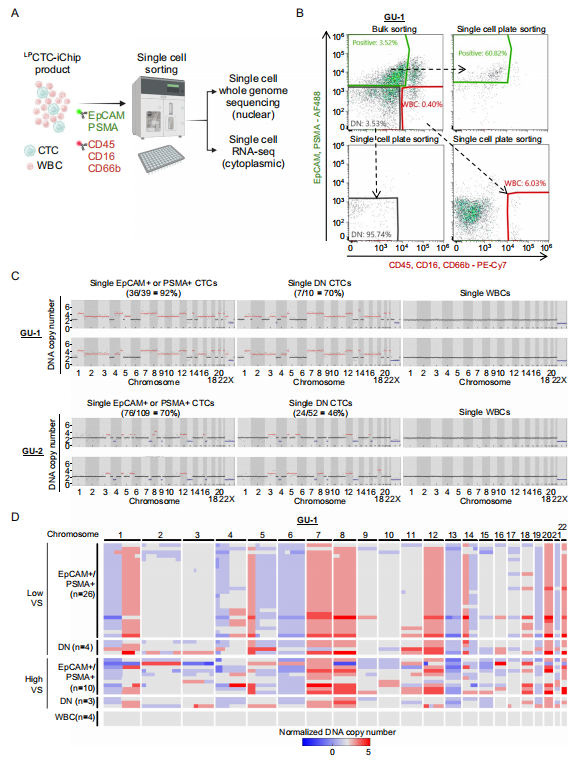
图 5. 单细胞全基因组测序和 DNA 拷贝数分析
重要实验结论:
(1) EpCAM/PSMA 阳性 CTC 中,92%(GU-1)和 70%(GU-2)显示明确 CNV(图 5C)
(2) 双阴性细胞中 46%-70% 携带 CNV,证实其为恶性来源 CTC(图 5C)
(3) CNV 图谱显示患者间存在共同的染色体改变,如 GU-1 中 1q、7、8 号染色体增益(图 5D)
(4) 单细胞分析揭示了肿瘤的基因组异质性(图 5D)
6. CTC 全外显子测序识别关键突变
将经 CNV 验证的 CTC 汇集后进行全外显子测序,平均覆盖深度 100×。通过 MuTect 与 Strelka 软件检测体细胞突变,并与临床组织活检和 ctDNA 检测结果进行对比分析。
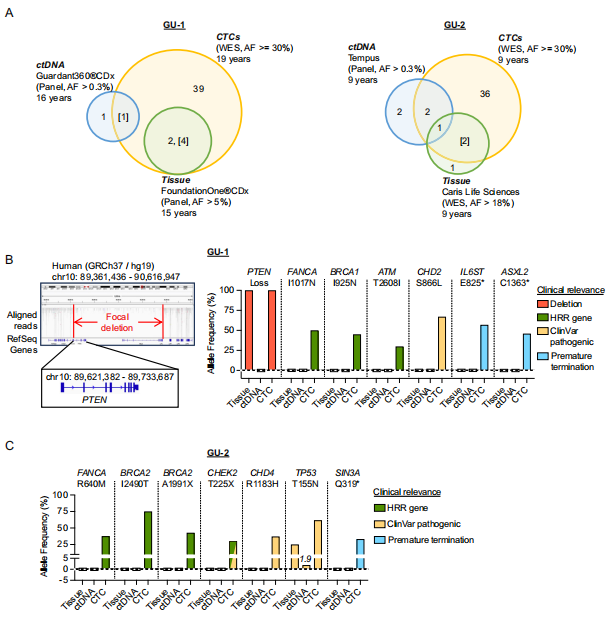
图 6. 显示 CNV 的前列腺 CTC 的全外显子组测序(WES)数据分析
重要实验结论:
(1) CTC WES 识别出组织与 ctDNA 中已报告的突变,包括 PTEN 缺失和 TP53 突变(图 6A-C)
(2) CTC 样本中突变等位基因频率显著高于 ctDNA,如 TP53 突变在 CTC 中 AF 达 61.7%(图 6C)
(3) 发现新的潜在致病突变,涉及同源重组修复和染色质调控基因(图 6B-C)
(4) CTC 分析提供了更高灵敏度的突变检测能力(图 6A)
7. 单细胞转录组揭示 CTC 功能异质性
对 CNV 确认的 CTC 进行单细胞 RNA 测序,通过无监督聚类和基因集富集分析识别转录组亚群。进一步分析双阴性 CTC 的分子特征和功能特性。
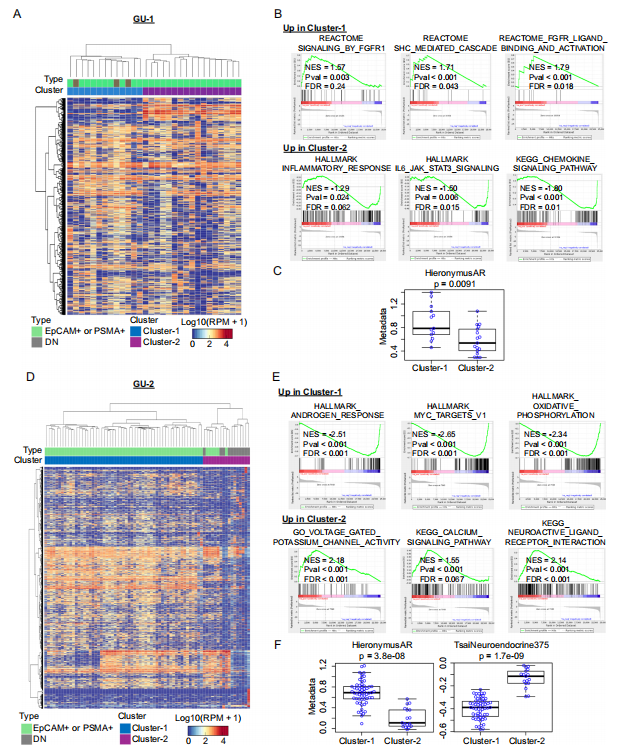
图 7. 显示 CNV 的前列腺 CTC 的单细胞 RNA 测序数据分析
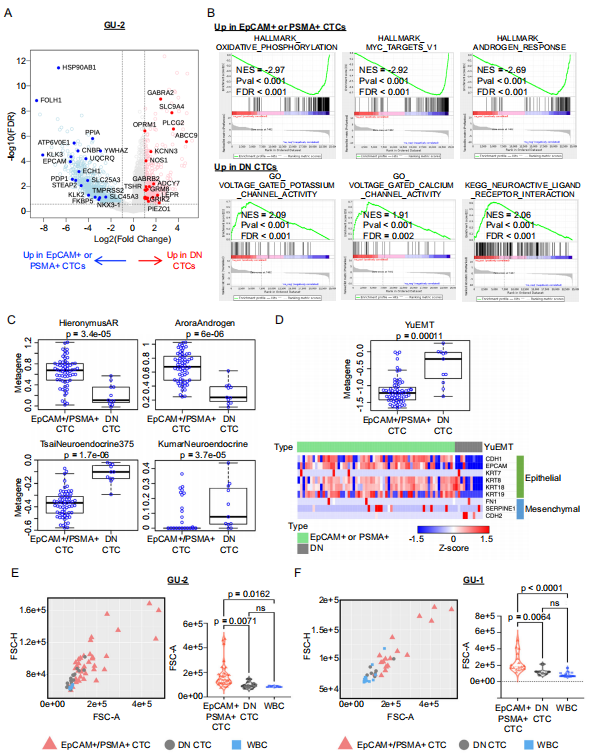
图 8. 识别具有神经内分泌标志物的小型 " 双阴性 "(DN)前列腺 CTC
重要实验结论:
(1) GU-1 中 CTC 分为 FGFR 信号激活簇和炎症反应簇(图 7A-C)
(2) GU-2 中 CTC 分为 AR/MYC 驱动簇和神经内分泌分化簇(图 7D-F)
(3) 双阴性 CTC 体积显著较小,高表达 EMT 和神经内分泌标志物(图 8A-F)
(4) 转录组分析揭示了传统活检未能检测到的肿瘤亚群(图 8C-F)
四、总结与展望
本研究通过开发高通量微流控 CTC-iChip 平台,成功实现了从白细胞分离术产品中大规模富集 CTCs,突破了传统液体活检的细胞数量瓶颈。在这一突破性技术中,链霉亲和素磁珠作为核心技术要素,在白细胞高效去除中发挥了不可替代的关键作用。
该研究中,链霉亲和素磁珠通过与生物素化抗体的高亲和力结合,实现了对白细胞的特异性标记和去除,最终达到 99.96% 的白细胞去除率。特别值得关注的是,研究中对双阴性 CTC 亚群的成功识别,充分证明了基于链霉亲和素-生物素系统的负向富集策略的独特价值——这种表位无关的富集方式能够捕获传统方法必然遗漏的重要 CTC 亚群。
未来,随着 CTC 富集等技术从研究走向临床,对链霉亲和素磁珠等核心原料的需求将持续增长。舒桐科技期待与各界伙伴深化合作,共同推动细胞水平液体活检与分子诊断技术的发展,为癌症精准诊疗提供更完善的解决方案。
作为深耕于分子诊断领域的企业,舒桐科技凭借其在磁珠材料领域的深厚积累,已开发出高性能链霉亲和素磁珠产品。这些产品在结合效率、稳定性和批次一致性等方面表现优异,特别适用于 CTC 分选、免疫细胞分离、NGS 建库等高要求的生命科学应用场景。
与此同时,舒桐科技在液体活检领域也进行了全面布局,提供包括 cfDNA 低频突变和 DNA 甲基化检测、基于 NGS 的微小残留病变 (MRD) 检测在内的专业服务,形成了从核心原料到终端检测服务的完整产业链支撑。
双十一放「价」
舒桐科技磁珠系列产品大促限时开启!
值此双十一科研采购季,舒桐科技为回馈广大科研工作者的支持,特别推出磁珠系列产品专项大促活动,为您提供最具性价比的研究解决方案:
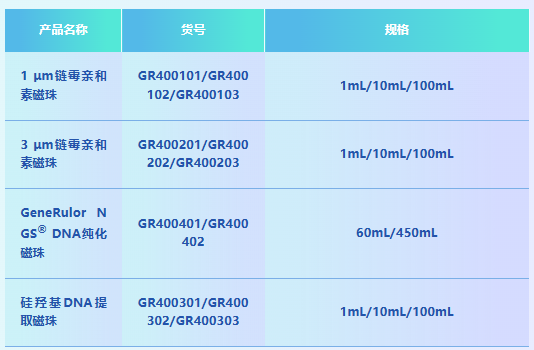
舒桐链霉亲和素磁珠产品应用(点击了解更多产品详情):
NGS(二代测序)
特异性捕获序列
纯化蛋白质/肽
高灵敏度免疫检测
病原体检测
产品优势:
高亲和力结合:GR 1μm 磁珠具有极高的生物素结合亲和力,确保了高效的捕获效率
高纯度与低非特异性结合:磁珠表面均匀包被链霉亲和素,减少了非特异性结合,提高了实验的准确性
快速分离能力:利用磁性特性,可以实现快速的目标分子分离,大幅缩短实验时间
稳定性高:产品批次间差异小,适用多种实验需求
性价比高:对标国际,国产价格
舒桐 DNA 纯化磁珠产品应用:
适用于 DNA 文库构建,特别适合于高通量测序平台样品制备
产品优势:
兼容各品牌 DNA 建库试剂盒和文献报道的建库流程,与目前广泛使用的同类产品使用方式完全相同
文库的产量、大小分布与标准产品高度一致,可无缝替代同类产品,有效降低建库成本
舒桐硅羟基 DNA 提取磁珠产品应用:
适用于多种生物样本中的核酸提取和纯化,具体包括但不限于:血液、组织、细胞、病毒以及微生物样本
产品优势:
高核酸结合力:核酸结合力强,每毫克磁珠可结合超过 20 μg 的 DNA
操作性能好:磁珠分散均匀,具有超顺磁性,磁响应时间小于 30 秒
批次稳定性:每批磁珠提取核酸后的 PCR 结果偏差均小于 5%
稳定性好:完整的氧化硅层包覆,使用性能稳定
为什么选择舒桐科技?
✅ 稳定性高,批次间稳定性强
✅ 性价比高,有效降低实验成本
✅ 提供全面的一站式原料与分析服务
✅ 专业技术支持,随时响应您的实验需求
立即联系我们,获取专属报价、产品详情和技术文档!