
高氧诱发的支气管肺发育不良(BPD)是早产儿肺损伤的主要原因。表观遗传学,特别是 DNA(羟基)甲基化,已被确定为 BPD 发病机制的关键调控因子。
为评估早期肺发育期间长期高氧暴露是否会影响 DNA(羟基)甲基化动态及关键调控因子的转录模式,近期,广东省心血管研究所孙凌、深圳市妇幼保健院陈雪雨团队及广州医科大学药学院江雪燕团队合作在《Clinical Epigenetics》上发表了题为「DNA methylation and hydroxymethylation combined with transcriptional profiling identify key regulators of hyperoxia-induced bronchopulmonary dysplasia」的研究成果。研究人员建立了高氧诱导的大鼠支气管肺发育不良模型,对高氧诱导的大鼠 BPD 模型的肺组织进行了多组学分析,鉴定出 2058 个 DEGs、62123 个 DMRs 及 33212 个 DhMRs,最后,18 个表达模式改变的候选基因被揭示为 BPD 相关通路,其中,10 个候选基因表现出显著上调,并同时伴有 DNA 低甲基化和高羟甲基化水平,反之,8 个基因显著上调并与 DNA 高甲基化和低羟甲基化水平相关。最后进一步验证了其中 Apln 和 Calca 基因的上调情况,说明高氧触发 Apln 和 Calca 基因启动子区域的 DNA 甲基化降低同时伴随羟甲基化升高,从而促进其基因表达,并参与 BPD 的发病机制。

实验设计
采用简化亚硫酸氢盐测序(RRBS)和氧化性简化亚硫酸氢盐测序(oxRRBS)技术,分别检测高氧或常氧处理新生大鼠肺样本中的 DNA 甲基化和羟甲基化水平。同时对差异表达基因进行 RNA 测序分析。通过靶向亚硫酸氢盐测序(TBS)和氧化性靶向亚硫酸氢盐测序(oxTBS)技术,对 DMRs 和 DhMRs 进行靶向验证。最后采用 qPCR、蛋白质印迹和免疫组织化学方法验证高氧暴露后肺组织中的基因表达水平。(文章检测技术由艾斯基因提供,如您需要了解更多技术信息,欢迎与我们联系 https://acegen.biomart.cn/)
主要结果
1、高氧诱导大鼠支气管肺发育不良模型的建立
对出生后第 1 天至第 10 天期间分别接受室内空气或 95% 氧气处理的新生大鼠(8 只)肺组织进行苏木精-伊红(H&E)染色评估。在出生后第 10 天,暴露于高氧环境的肺样本表现出间隔更薄但气腔更大。此外高氧组肺组织的平均内衬间隔(MLI)显著高于常氧组,证实了大鼠高氧诱导性肺损伤的 BPD 模型成功建立。
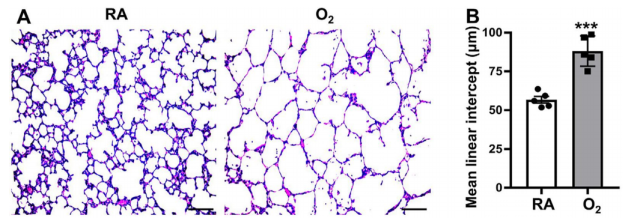
高氧诱导肺损伤的评估
2、高氧诱导大鼠 BPD 中差异表达基因的 RNA 测序及 KEGG 分析
为探究差异表达基因(DEGs)的动态变化,对高氧组和常氧组新生大鼠的肺组织进行了 RNA 测序。共有 837 个基因显著上调,1221 个基因显著下调,这些 DEGs 显著富集于多条信号通路,其中大部分通路既往研究报道与 BPD 相关,如细胞因子-细胞因子受体相互作用、补体与凝血级联等。
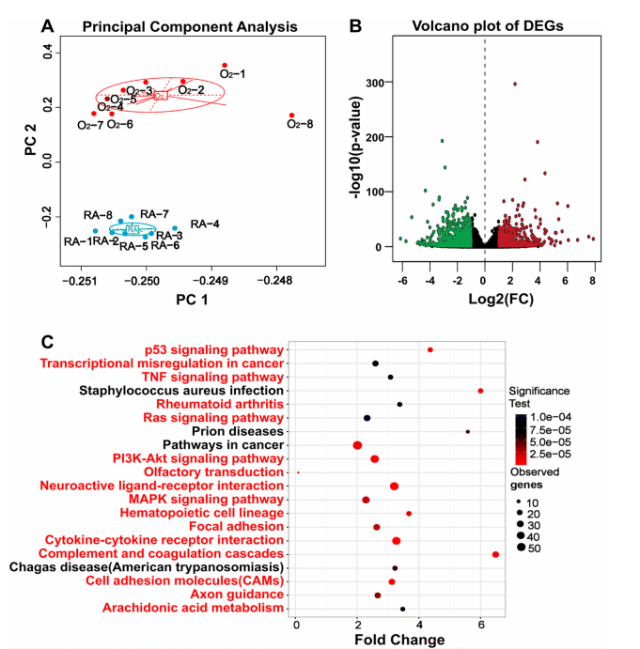
高氧诱导大鼠 BPD 差异表达基因的 RNA 测序及 KEGG 分析
3、高氧诱导大鼠 BPD 中全基因组 DNA(羟基)甲基化模式的动态改变
为检测高氧诱导大鼠 BPD 中的 DNA(羟基)甲基化动态,采用 RRBS 和 oxRRBS 技术分析了高氧和常氧暴露大鼠肺组织中基因组 5-mC 和 5-hmC 的变化。共鉴定出 62,123 个差异甲基化区域(DMRs)和 33,212 个差异羟甲基化区域(DhMRs)。在高氧组中,启动子、内含子、3' 非翻译区和基因体区域的 DNA 甲基化模式呈现轻微升高,而 DNA 羟甲基化模式则有所降低。此外,研究证实高氧组和常氧组在全基因组 DNA 甲基化模式上的变化与各基因元件中 DNA 羟甲基化模式的变化趋势相反,这种动态变化可被视为高氧诱导大鼠 BPD 的重要特征。
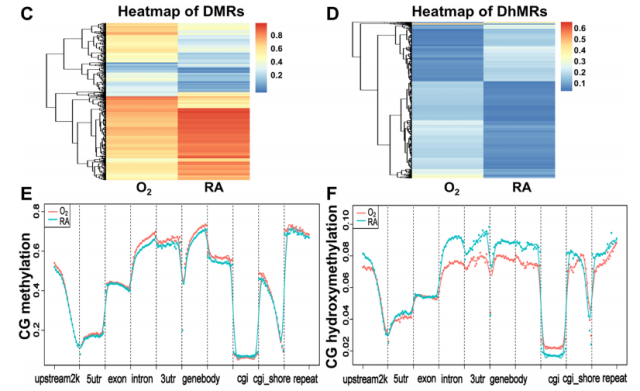
高氧诱导的大鼠 BPD 中 DNA(羟基)甲基化模式的全基因组分析
4、高氧诱导大鼠 BPD 中启动子区域转录组与 DNA(羟基)甲基化组改变的生信分析
为识别高氧诱导 BPD 的表观遗传调控因子,重点分析了 RNA-seq 鉴定出的 DEGs 启动子区域的 DNA 甲基化和羟甲基化模式。KEGG 分析显示,启动子区域 DNA 甲基化模式呈负向变化的 DEGs 显著富集于 BPD 相关通路,包括 cGMP-PKG 信号通路、肌动蛋白细胞骨架调控、补体与凝血级联反应以及心肌收缩等。反之,启动子区域 DNA 羟甲基化模式呈正向变化的 DEGs 显著富集于 BPD 相关通路,包括 PI3K-Akt、MAPK、补体与凝血级联反应以及心肌收缩等
5、转录组与 DNA(羟基)甲基化组整合分析鉴定出高氧诱导大鼠 BPD 中的关键调控基因
通过整合分析,共鉴定出 18 个候选基因,这些基因在其启动子区域表现出显著的差异表达,并伴随 DNA 甲基化和羟甲基化模式的改变。具体而言,10 个上调候选基因和 8 个下调候选基因被确定为高氧诱导大鼠 BPD 肺损伤的潜在关键介导因子,这些基因的筛选基于它们与 BPD 发病机制的功能相关性,并得到既往文献和通路分析的支持。其中,Apln 和 Calca 在高氧组中显著上调,其 mRNA 表达量相较于常氧对照组分别增加了 2.57 倍和 2.79 倍,相应地,高氧暴露后 Apln 和 Calca 的 DNA 甲基化水平降低了 0.52 倍和 0.58 倍,相反,高氧组中 Apln 和 Calca 的 DNA 羟甲基化水平较常氧组分别增加了 3.53 倍和 4.70 倍,表明高氧诱导了大鼠 BPD 中 Apln 和 Calca 的上调。
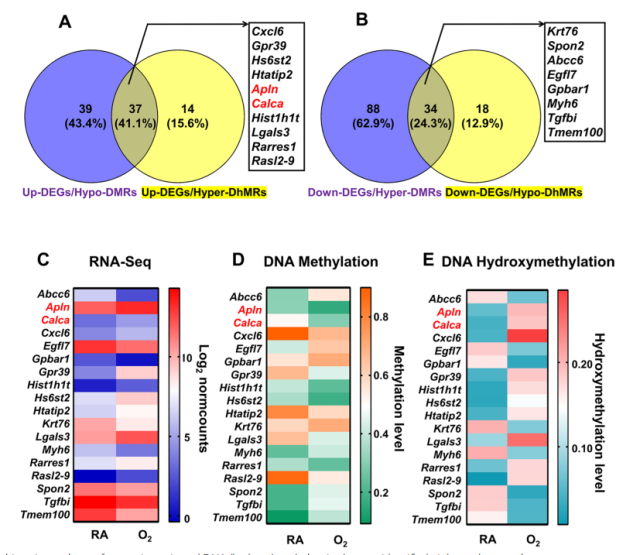
转录组学和 DNA(羟基)甲基组学变化的多组学分析确定关键调节基因
6、高氧诱导大鼠 BPD 中 Apln 和 Calca 的上调伴随启动子区域 DNA 低甲基化与高羟甲基化
为验证 18 个候选基因的 DNA 甲基化和羟甲基化模式,采用 TBS 和 oxTBS 技术定量评估了其启动子区域的 DNA 甲基化与羟甲基化水平。结果一致表明,高氧暴露后 Apln 和 Calca 的 DNA 甲基化水平分别降低了 0.74 倍和 0.92 倍,同时,DNA 羟甲基化水平分别上调了 1.47 倍和 1.19 倍。这些发现证实高氧诱导了 Apln 和 Calca 的上调,并伴随其启动子区域的 DNA 低甲基化和高羟甲基化水平。为进一步验证高氧暴露肺组织中 Apln 和 Calca 的表达,研究人员还通过 qPCR 和蛋白质印迹分析评估了 mRNA 及蛋白水平。与常氧组相比,高氧组 Apln 和 Calca 的 mRNA 表达分别增加了 1.62 倍和 2.55 倍,而蛋白水平分别提升了 1.57 倍和 2.99 倍。肺组织切片的免疫组化染色进一步证实了高氧诱导的 Apln 和 Calca 表达上调,与 RNA-seq、qPCR 及蛋白质印迹分析结果相互印证。
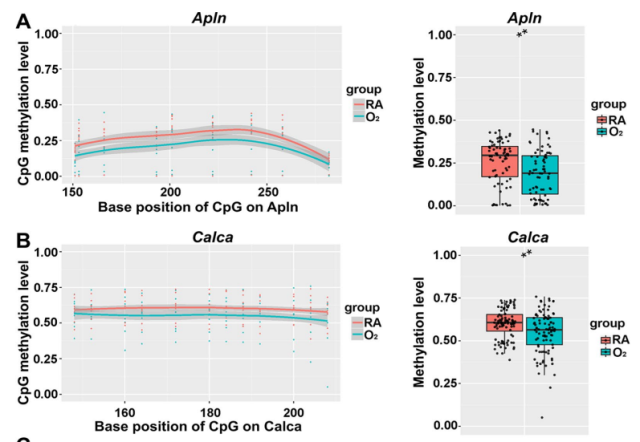
在高氧诱导的大鼠 BPD 中,DNA 甲基化增加,Apln 和 Calca 启动子区域的 DNA 羟甲基化水平降低
结论
本研究表明,高氧通过下调启动子区域 DNA 甲基化并上调 DNA 羟甲基化,促进关键调控因子(特别是 Apln 和 Calca)的基因表达。结果阐明了 DNA(羟基)甲基化在高氧诱导 BPD 中关键调控因子表达水平方面起着至关重要的作用,为 BPD 提供了新的表观遗传调控机制。尽管 Apln 和 Calca 在 BPD 发病机制中的具体功能作用尚需进一步阐明,但这些发现确立了它们作为 BPD 诊断生物标志物和治疗靶点的潜在重要性。
本项目检测技术由艾斯基因提供,如您需要了解更多技术信息,欢迎与我们联系 https://acegen.biomart.cn/
