今天为大家介绍 1 项 2025 年由韩国科学技术研究院团队开发并发表在《ACS Nano》(2025;19:6412−6425)期刊上的新型 mRNA 递送系统—基于载脂蛋白融合抗体(GrAb)实现 mRNA 脂质纳米粒靶向递送抗体功能化的新疗法,为精准医学和癌症治疗提供了更简便、高效的解决方案,带来了全新的可能性。
以下解读来源于合肥善本生物服务号,相关服务产品咨询,点此了解。
1 什么是载脂蛋白融合抗体技术?
载脂蛋白融合抗体(Grab Antibody,GrAb)技术是一种无需化学偶联即可实现 mRNA 脂质纳米粒(mRNA-lipid nanoparticles,mRNA@LNPs)靶向递送抗体功能化的创新方法。该技术通过将载脂蛋白(如 ApoA1 或 ApoE3)融合到靶向抗体的 Fc 结构域,利用载脂蛋白与脂质的强结合力,使抗体能够自发地显示在 LNPs 表面,形成类似蛋白冠的结构(图 1)。相比于传统的化学偶联方法,GrAb 技术显著简化了制备流程,避免了有毒化学试剂的使用,同时确保了抗体的正确取向和功能完整性。
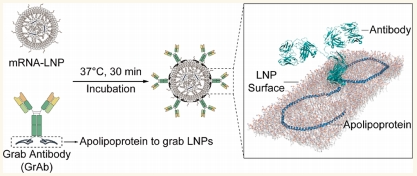
图 1 载脂蛋白融合抗体技术概要
2 载脂蛋白融合抗体技术工作原理
GrAb 技术的核心原理可以简要概括为:首先,构建包含靶向抗体和载脂蛋白融合的双载体系统;其次,利用载脂蛋白的脂质结合特性实现与 LNPs 的自发结合;最后通过简单的孵育过程完成抗体在 LNPs 表面的功能化展示(图 1)。具体步骤如下:
1、构建含有信号肽、抗体重链(VH-CH1-铰链-CH2-CH3)和载脂蛋白融合序列的表达载体;
2、构建含有信号肽、抗体轻链(VL-CL)的表达载体;
3、在 ExpiCHO 细胞中共转染表达,获得功能化的 GrAb 蛋白;
4、将制备好的 mRNA@LNPs 与 GrAb 蛋白在 37°C 孵育 30 min;
5、载脂蛋白域与 LNPs 表面自发结合,形成抗体功能化的靶向性 LNPs。
值得一提的是,整个过程无需复杂的化学修饰或纯化步骤,可在多种细胞类型中高效应用。
3 载脂蛋白融合抗体技术优势
GrAb 技术相较于现有抗体偶联技术具有显著优势,体现在:
1、GrAb 技术避免了传统化学偶联方法中有毒化学试剂(如二苯并环辛炔或马来酰亚胺)的使用,大大简化了制备流程;
2、载脂蛋白的强脂质结合力确保了抗体在生理条件下的稳定附着,避免了 PEG 脱落导致的抗体解离问题;
3、与传统偶联方法相比,GrAb 技术能够确保抗体的正确取向和功能完整性,提高靶向效率;
4、该技术具有广泛的适用性,可通过修改抗体的可变区来靶向任何受体,无需改变 LNPs 组成;
5、载脂蛋白形成的蛋白冠可有效防止血清蛋白的非特异性吸附,减少脱靶效应。
4 载脂蛋白融合抗体技术实验结果
研究团队在多种人类癌细胞系和小鼠模型中全面验证了 GrAb 技术的有效性。
图 2 展示了 GrAb 平台的构建与表征。研究团队成功构建了包含曲妥珠单抗和载脂蛋白(如 ApoA1 或 ApoE3)的融合蛋白表达系统。SDS-PAGE 分析显示纯化的 GrAb 蛋白分子量大小正确;动态光散射(DLS)分析表明,在脂质与蛋白摩尔比(LP 比)为 10000:1 时,ApoA1 介导的组装将 LNP 粒径从 132±3 nm 轻微增加至 140±3 nm,而 mRNA 包封效率仍保持稳定。纳米粒子追踪分析(NTA)显示单个 LNP 表面约结合 69 个 GrAb 分子,形成了密集的抗体展示层。
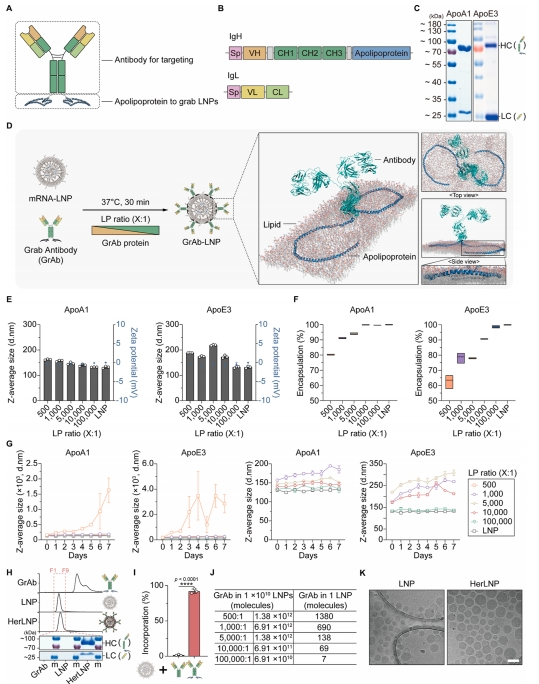
图 2 GrAb 平台的构建与表征
图 3 验证了 GrAb-LNPs 的受体介导细胞靶向能力。流式细胞术分析显示,HER2 阳性的 SK-OV-3 细胞对 HerLNPs(曲妥珠单抗功能化 LNPs)的摄取显著增加,而对照 LNPs(ConLNPs)和同型对照 LNPs(IsoLNPs)则无此现象。预先用曲妥珠单抗阻断 HER2 受体可完全消除这种差异摄取。共聚焦显微镜观察证实,Cy5 标记的萤光素酶 mRNA 在 HerLNPs 处理的细胞中呈现强烈的红色荧光信号。功能验证实验表明,HerLNPs 递送的萤光素酶 mRNA 可产生显著的生物发光信号,而 p53 mRNA 则能有效抑制 HER2 阳性细胞的增殖。实验均证明了在细胞实验中,GrAb-LNPs 受体精准靶向 HER2,具有高特异性。
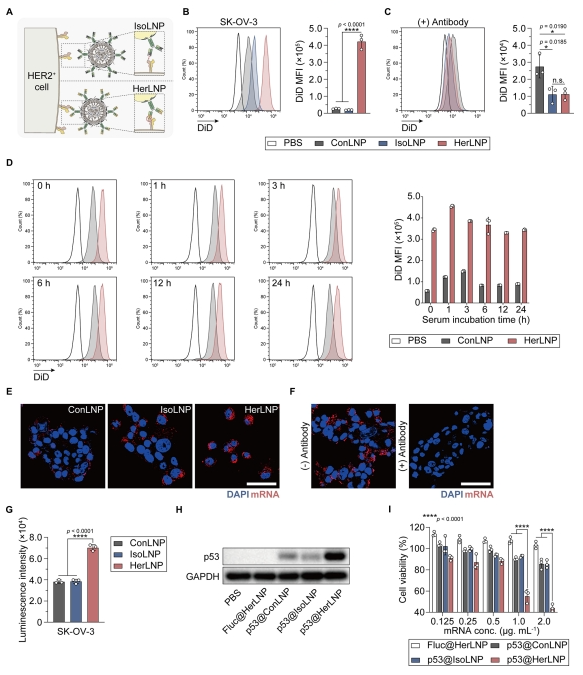
图 3 受体介导的 GrAb-LNPs 细胞结合与摄取
图 4 评估了 GrAb-LNPs 在小鼠体内的靶向递送效率。近红外荧光成像显示,静脉注射后 3 h 开始,HerLNPs 在 SK-OV-3 肿瘤中的累积量显著增加,24 h 时达到峰值,相比 IsoLNPs 提高了 1.9 倍。离体器官分析进一步证实,HerLNP 在肿瘤组织中的荧光和发光强度分别比 IsoLNPs 高 2.7 倍和 5.9 倍。重要的是 HerLNPs 在肝脏中的累积显著降低,肿瘤/肝脏比值在荧光和发光方面分别提高了 3.3 倍和 7.3 倍,表明其显著改善了靶向特异性。实验证明了在体内实验中 GrAb-LNPs 受体的精准靶向同样具有高特异性。
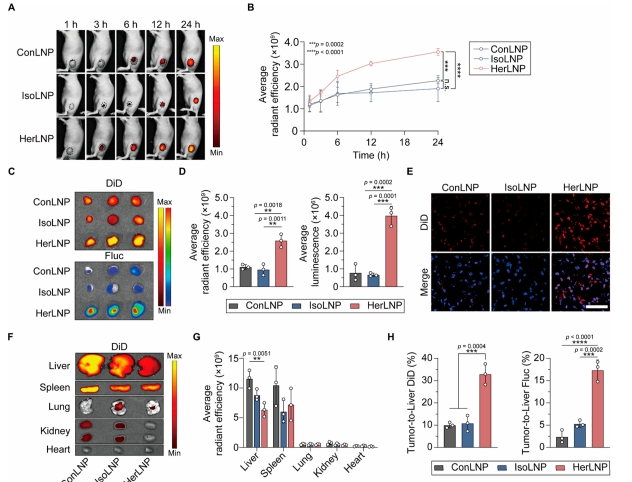
图 4 评估通过 GrAb-LNPs 靶向 HER2 表达肿瘤的体内 mRNA 递送
图 5 展示了 p53 mRNA 靶向递送的治疗效果。在 SK-OV-3 异种移植瘤模型中,p53@HerLNP 治疗组的肿瘤生长受到显著抑制,21 d 后肿瘤体积远小于 PBS 对照组。免疫印迹和免疫荧光分析证实,p53@HerLNPs 处理的肿瘤组织中 p53 蛋白表达显著上调。TUNEL 染色显示 p53@HerLNPs 治疗组出现广泛的细胞凋亡和组织结构异常,证明其展示了有效的抗肿瘤效应。
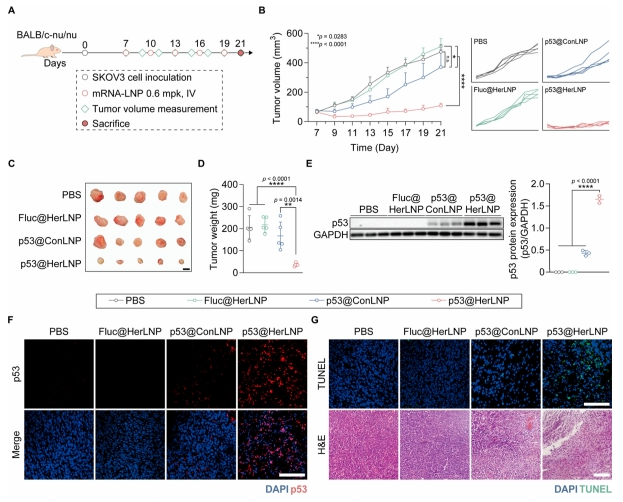
图 5 通过 HER2 靶向 LNP 递送的 p53 mRNA 治疗效果
图 6 评估了 GrAb-LNPs 的体内安全性。21 d 治疗期间,HerLNPs 治疗组小鼠体重无明显变化,而缺乏靶向抗体的 p53@ConLNPs 组出现显著体重下降。血清生化分析显示,HerLNPs 治疗组的肝功能指标(AST、ALT、ALP)均正常,而 p53@ConLNPs 组这些指标显著升高,表明其有严重的肝毒性。组织学分析证实,只有 p53@ConLNPs 治疗组出现肝脏组织坏死和病理改变,而 HerLNPs 治疗组各主要器官均无结构损伤。说明 GrAb-LNPs 在动物体内并不会导致肝毒性症状,在体内使用是安全高效的。
GrAb 技术通过将载脂蛋白(如 ApoA1 或 ApoE3)与靶向抗体的 Fc 结构域融合,实现了 mRNA@LNPs 的高效、定向抗体功能化。该技术利用载脂蛋白与脂质间极强的结合力,仅通过孵育即可使抗体自发稳定显示于 LNPs 表面,形成具有正确取向和完整功能的靶向递送系统,完全避免了传统化学偶联中有毒试剂的使用和 PEG 脱落风险。在细胞及动物模型中,GrAb 技术展现出卓越的靶向能力和治疗效力:HER2 靶向的 LNPs 在肿瘤中富集显著提高,肿瘤/肝脏分布比提升最高达 7.3 倍,并有效递送 p53 mRNA 抑制肿瘤生长。同时,该技术还具有优异的生物安全性,未引发肝毒性或组织损伤,为 mRNA 药物的精准递送提供了更简便、通用且可靠的平台。
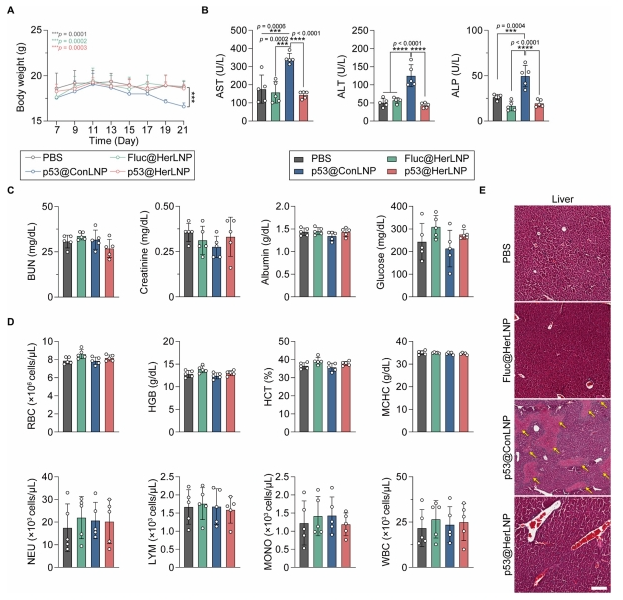
图 6 GrAb-LNPs 的体内安全性
6 未来的应用前景
GrAb 技术基于模块化设计理念,具有广阔的应用前景。研究人员可以通过修改抗体的可变区实现靶向不同的受体,适用于多种疾病的治疗。这项技术的灵活性和精确性使其有望广泛应用于个性化癌症疫苗、免疫调节因子表达、肿瘤抑制基因上调、体内 CAR-T 细胞工程以及疫苗开发等领域。特别是在精准医学时代,GrAb 技术可为患者提供个体化的 mRNA 治疗方案,显著提高治疗效果并降低副作用。随着载脂蛋白工程和抗体设计技术的不断发展,GrAb 技术平台有望成为下一代 mRNA 递送系统的重要组成部分。
7 总结
GrAb 技术代表了 mRNA 递送领域的重大技术突破。它巧妙地利用载脂蛋白的天然脂质结合特性,实现了抗体在 LNP 表面的自发功能化,避免了传统化学偶联方法的复杂性和毒性问题。该技术在 HER2 阳性癌症模型中展现出优异的靶向效率和治疗效果,同时显著降低了肝脏毒性。GrAb 技术的模块化设计使其具有广泛的适用性,为 mRNA 疗法的临床转化提供了新的可能性。随着进一步的优化和验证,这项技术有望为癌症治疗、免疫调节和精准医学带来革命性的进展。