主动脉夹层(AD)是急诊常见「杀手」之一。典型 AD 主要表现为急性起病,胸痛剧烈、持续,且难以缓解,临床容易识别。但非典型性 AD 临床症状具有极大的迷惑性,给临床诊断带来一定困难。早期识别、诊断 AD,可以为 AD 患者的抢救和治疗赢得时间。我们先来看这样一则以突发神经系统受损症状为首发表现的急性主动脉夹层(AAD)病例。
眩晕、肢体无力、无胸痛,最后竟确诊 AD
患者,男,59 岁,因「眩晕 2 天伴左侧肢体无力 1 小时」入院*。
现病史:2 天前无明显诱因出现眩晕,安静休息后可好转,未予特殊处理。1 小时前无明显诱因出现左侧肢体无力,伴肌肉抽动,家人发现后急诊送院。
既往史:高血压病史数年,具体口服药物及血压控制情况不详。吸烟史数年。
查体:生命体征平稳,左侧血压 160/100 mmHg,右侧血压 135/90 mmHg。心肺腹查体未见明显异常。足背动脉搏动正常。生理反射正常,双侧 Hoffmann 征阴性,双侧 Babinski 征阳性,克氏征阴性,布氏征阴性,无扑翼样震颤。
辅助检查:急查 D-二聚体 160 ug/mL。血常规、肌钙蛋白、BNP、心肌损伤标志物未见明显异常。
诊疗经过及病情转归:患者的发病状态、发病症状及伴随症状均不符合典型动脉粥样硬化性、单一颈动脉系统受损表现,且伴有 D-二聚体水平明显增高,故除进行一般头颅影像学检查外,还给予主动脉 CTA 检查。
MRI:未见新发脑梗死。
胸腹 CTA 示主动脉根部夹层形成,诊断为 Stanford A 型 AAD 及短暂性脑缺血发作。
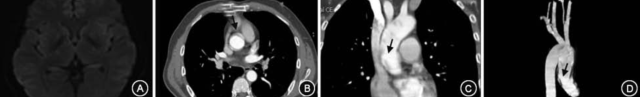
图 1. 患者影像学检查结果[1]
A 图:头 MRI,DWI 相未见新发脑梗死;B 图,胸腹 CTA,可见升主动脉夹层形成(箭头所指);C 图:胸腹 CTA 冠状位,可见升主动脉夹层形成(箭头所指);D 图:胸腹 CTA 重建图像,可见升主动脉夹层形成(箭头所指)。
完善术前相关检查,转至血管外科行人工血管植入术,术后患者预后良好,规律服药,随访中未见再发眩晕等不适。
病例讨论
从病史来看,因该患者缺少胸痛表现和明显的血流动力学改变,考虑为颈内动脉系统的短暂性脑缺血发作,此时极易掩盖潜在的主动脉夹层症状而造成漏诊。但仔细查体发现该患者双侧收缩压差 >20 mmHg,且 D-二聚体显著升高,考虑主动脉夹层可能。影像学检查对诊断主动脉夹层有决定性意义,因此为排除主动脉夹层,完善了主动脉 CTA 检查,证实了患者为 Stanford A 型 AAD,行外科治疗后预后良好。
本例患者以眩晕及肢体活动障碍为主要表现,胸痛不明显,加上缺乏高血压等 AD 常见病因,也容易掩盖患者神经系统缺损症状的病因。建议对于无明显原因的眩晕、肢体活动障碍的急性卒中患者,也应该排除无痛主动脉夹层的可能性,特别是在溶栓治疗前,或者进一步使用抗血小板或抗凝治疗前。主动脉夹层是溶栓的绝对禁忌证,一旦贸然给予溶栓治疗,后果不可预料。
有研究认为,如符合以下 5 个条件中的 2 个以上则应考虑 A 型 AD[1]:
① D-二聚体值明显升高,认为 D-二聚体值 <0.5 ug/mL 基本可排除 AAD,而 D-二聚体值 >6.9 ug/mL 则应高度怀疑 AD 的存在;
② 颈总动脉超声可发现内膜片或未见明确血流,在 AD 伴发缺血性卒中患者中有 75% 可通过早期颈动脉超声发现内膜片或「双腔征」;
③胸片纵隔变宽;
④主要表现为左侧偏瘫;
⑤双侧收缩压差 >20 mmHg。
主动脉夹层的神经系统并发症较为常见,甚至以神经系统受损症状为首要临床表现的主动脉夹层也并不少见,临床上易于误诊,造成灾难性后果。临床医生面对无痛但出现原因未明的多种症状、多个器官缺血性损伤的患者时,应结合患者的高血压、吸烟等危险因素或既往病史,考虑到无痛性主动脉夹层的可能,并及时通过 CTA 等影像学检查明确诊断和识别并发症。
主动脉夹层知识回顾
Q1:什么是主动脉夹层?临床分型和分期有哪些?
AD 是由于各种原因导致的主动脉内膜、中膜撕裂,血液流入,致使主动脉腔被分隔为真腔和假腔。典型的 AD 可以见到位于真、假腔之间的分隔或内膜片。真、假腔可以相通或不通。血液可以在真、假腔之间流动或形成血栓[2](图 2)。
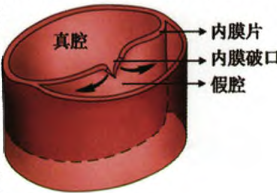
图 2. 主动脉夹层示意图[2]
分型:在传统的 AD 分型方法中,DeBakey 分型和 Stanford 分型应用最为广泛。就 Standford 分型而言,无论夹层起源于哪一部位,只要累及升主动脉者称为 A 型;夹层起源于胸降主动脉且未累及升主动脉者称为 B 型。Stanford A 型相当于 Debakey I 型和 II 型,Stanford B 型相当于 Debakey III 型[2](如图 3 所示)。
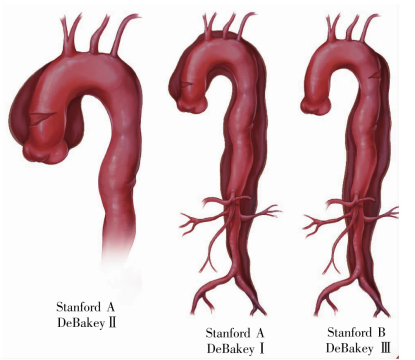
图 3. 主动脉夹层 De-Bakey 分型和 Stanford 分型示意图[2]
分期:2010 年,美国心脏病协会(AHA)指南推荐的 AD 分期方法为:发病时间 ≤2 周为急性期;2~6 周为亚急性期;>6 周为慢性期[2]]。2014 年,欧洲心脏病协会(ESC)主动脉疾病诊断和治疗指南推荐的 AD 分期方法为: 发病时间 ≤14 d 为急性期;14~90 d 为亚急性期;>90 d 为慢性期。目前公认的急性期 AD 为发病时间在 2 周以内者[2]。
Q2:主动脉夹层早期诊断的线索有哪些?
上述病例的特殊之处还在于,患者出现眩晕和肢体活动障碍时,缺乏典型 AD 的胸痛表现,极易漏诊。因此对于有神经功能受损的患者,必须进行全面的体格检查和影像学检查。
此外,在临床上同时出现下列一项或几项提示性线索时,需考虑 AD。
● 病史:是否有高血压,半年内控制程度如何。
● 诱因:往往有胸部拉伸运动。
● 常见症状:持续胸腹部疼痛,需注意疼痛的性质和部位,可有单侧下肢阵发性或持续性疼痛,无力,发凉,易误诊为脑卒中。
● 体征:双侧桡动脉搏动不一致,入院血压特别高,硝普钠泵控降压是否疼痛减轻;血压可能不高,甚至偏低;心率变快,入院时心率也可能偏慢;听诊心脏瓣膜、主动脉及其分支有无明显杂音,尤其腹主动脉杂音。
● 心电图:胸痛,但心电图正常或出现不典型心肌缺血改变,部分可有 ST-T 变化。
● 实验室检查:D-二聚体升高;血常规及尿常规变化;查看患者是否存在多系统、多器官功能障碍。
● 影像学检查:胸片或 CT 提示纵膈增宽、主动脉内膜影、左侧胸腔积液;彩超提示主动脉增宽或真假腔;造影时可先透视(肺部)纵膈宽度,注意死亡芭蕾样跳动。
● 对吗啡等止痛药物的反应情况。
Q3:主动脉夹层如何诊断?
对于急性胸痛的患者,2010 年 AHA 指南提出了疑似 AD 的高危易感因素、疼痛表现和体征(表 1)。

对于存在表 1 中高危因素、症状和体征的初诊患者,应考虑 AD 可能并安排合理的检查以明确诊断,具体的诊断流程,根据《Stanford B 型主动脉夹层诊断和治疗中国专家共识(2022版)》[3]推荐,如图 4 所示:
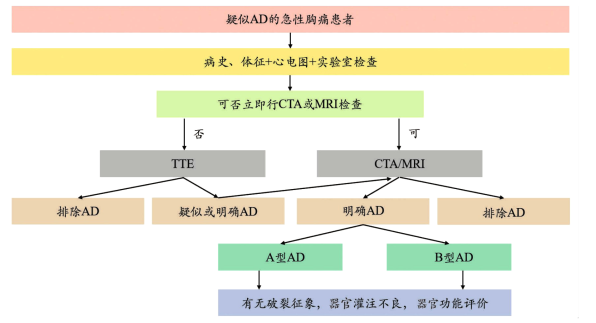
图 4. AD 的诊断流程[3]
Q4:主动脉夹层如何进行治疗和随访?
治疗原则:一旦明确诊断后,不论何种类型的 AD 均应立即给予药物治疗,其目的是镇静、镇痛、降低心率和血压、防止夹层进一步扩展或破裂。同时,应注意全面评估患者一般情况,嘱患者卧床休息,并进行心电监护。如合并其他复杂情况,必要时应将患者送入 ICU。Stanford A 型 AD(TAAD)一经确诊,原则上均应积极外科手术治疗[2]。药物治疗是 Stanford B 型 AD(TBAD)患者的基本治疗方式。在充分的药物治疗基础上,对于急性复杂型 TBAD 患者,需尽早行手术干预[3]。
随访原则:无论是手术治疗,还是腔内介入修复,AD 患者定期的随访和血压、心率控制至关重要。出院前、术后 3、6、12 个月进行随访,之后每年随访,特殊患者个体化[2]。
小结
AD 是一种危及生命的急症,可引发多种系统并发症。尽管突发严重胸背痛是主动脉夹层的典型症状,但以神经系统受损症状为主的无痛性主动脉夹层也需时刻警惕。只有早期识别、诊断 AD,才能及早进行积极的治疗,提高患者生存率、改善预后。
更多相关内容,请关注【丹麦雷度】丁香园机构号
*病例整理自文献 1
参考文献:
1. 乔亚男,冯羿博,郭静,等. 首发表现为神经系统受损症状的急性主动脉夹层患者的临床分析[J]. 中华医学杂志,2017,97(46):3661-3665.
2. 中国医师协会心血管外科分会大血管外科专业委员会. 主动脉夹层诊断与治疗规范中国专家共识[J]. 中华胸心血管外科杂志, 2017, 33(11): 641-654.
3. 中华医学会外科学分会血管外科学组. Stanford B型主动脉夹层诊断和治疗中国专家共识(2022版)[J]. 中国血管外科杂志(电子版),2022,14(2):119-130.