
背景介绍
据世界卫生组织统计,全球 HCV 的感染率约为 3%,估计约 1.8 亿人感染了 HCV,每年新发丙型肝炎病例约 3.5 万例。丙型肝炎呈全球性流行,可导致肝脏慢性炎症坏死和纤维化,部分患者可发展为肝硬化甚至肝细胞癌(HCC)。未来 20 年内与 HCV 感染相关的死亡率(肝衰竭及肝细胞癌导致的死亡)将继续增加,对患者的健康和生命危害极大,已成为严重的社会和公共卫生问题。
近年来,国际上针对丙肝直接抗病毒药物的突破性研发进展成功打破了这一僵局。相较于传统治疗方案,DAA 小分子口服药可显著提高治愈率、缩短抗病毒治疗疗程、减少副作用。全口服直接抗病毒 (DAA) 治疗使慢性丙型肝炎病毒 (HCV) 感染患者的治疗发生了革命性的变化。但令人遗憾的是,DAA 治疗的高昂费用给医疗系统带来沉重负担,并且可能使一些本来可以获益的患者望而却步。由于 DAA 治疗的耐受性和病毒学突破的罕见,目前不建议对任何已批准的 DAA 治疗方案采用应答指导治疗。因此,大多数患者目前仍接受为期 12 周的固定治疗。然而,在 DAA 治疗下,HCV RNA 稳定阴性的时间在患者之间有相当大的差异。如果能够确定对治疗反应最快的患者,就有可能制定个体化、更符合成本效益的方法,开出更短疗程的 DAA 治疗。有利于更有效的资源分配和更多患者的治疗。
在过去的几十年里,人们已经确定 HCV 持续感染期间的慢性抗原刺激与几种免疫细胞群 (如自然杀伤细胞和 CD8 T 细胞) 的持续活化和功能受损相关。在 HCV 感染的慢性期,由于病毒逃逸和病毒特异性 CD4+和 CD8+T 细胞的功能衰竭,病毒特异性 T 细胞应答发生了倾斜。因此,剩余的抗原特异性 T 细胞表现出抑制性分子如程序性死亡分子-1 和 2B4 (CD244) 的表达增加。因此,本研究对接受 DAA 治疗的 23 例患者进行了全面监测,以从外周血中确定准确预测早期 HCV RNA 阴性的免疫相关生物标志物。仅了解治疗前的 CD3+和初始 CD8+T 细胞频率可将 83% 的患者正确分类为「快速」(4 周前 HCV RNA 转阴) 或「慢速」应答。在一个前瞻性研究中,这些参数正确分类了 90% 的患者。发现慢反应患者 CD3+T 细胞、CD8+TEM 细胞和 CD5 high CD27- CD57+ CD8+慢性活化 T 细胞比例较高,这是由于病毒非特异性 CD8+T 细胞的旁观者超活化。综上所述,非特异性的系统性 CD8+T 细胞活化预示着较长的病毒清除时间。这一发现使我们能够在治疗前识别可能不需要完整 12 周 DAA 疗程的患者。反过来,这可能导致个体化处方和更有效的资源配置。
样本要求
全血标本经外周静脉穿刺 EDTA 管采集,室温下立即送至实验室。分析前样本储存在 4℃,直至 4 小时内开始处理。
流式方案
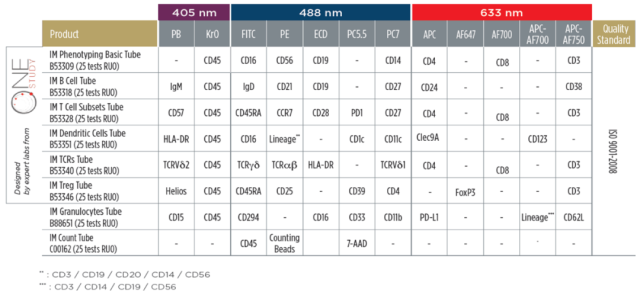
1. 使用 Duraclone 免疫监测方案染色(Beckman Coulter),包括:
Duraclone IM 表型分型 BASIC Tube, B53309;
Duraclone IM T 细胞亚群管,B53328;
Duraclone IM TCRs Tube, B53340;
Duraclone IM TregTube, B53346;
Duraclone IM B 细胞管,B53318;
Duraclone IM 树突状细胞管,B53351;
Duraclone IM 按照 The ONE Study (The ONE Study consortium, www.onestudy.org) 制定的标准化流式细胞术方案,测定了一系列全血样本中 79 个预先定义的白细胞亚群的百分比和绝对计数。基线样本在 DAA 治疗开始前立即采集,随后在治疗开始后 4 周、12 周和 24 周采样。免疫表型分型策略提供了所有主要血液白细胞亚群的高分辨率图像,包括它们的激活或成熟状态。
2.
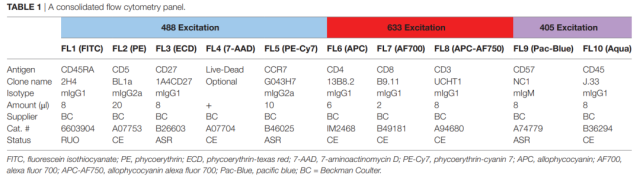
为了简化和标准化分析方法,创建了一个单一的 10 色流式细胞术组合,用于测量 CD3+ T 细胞、CD45RA+ CCR7+ CD8+初始 T 细胞、CD27- CD57+ CD8+ T 细胞和表达 CD5 的 CD8+ T 细胞的频率 (表 1)。在这个组合中,有一个通道可用来使用 7-AAD 鉴别活死细胞。对新鲜材料的分析通常不进行 7-AAD 染色,而对储存材料的分析总是需要活/死细胞的区分。使用荧光微球可以对 CD5 的表达进行绝对定量。
分析策略
(部分展示)
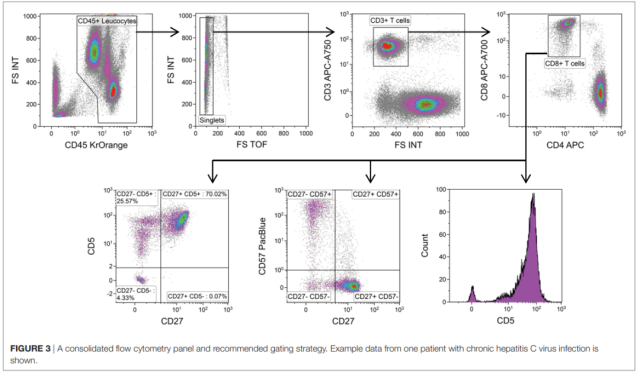
研究成果
1. 受 DAA 治疗影响的免疫标志物
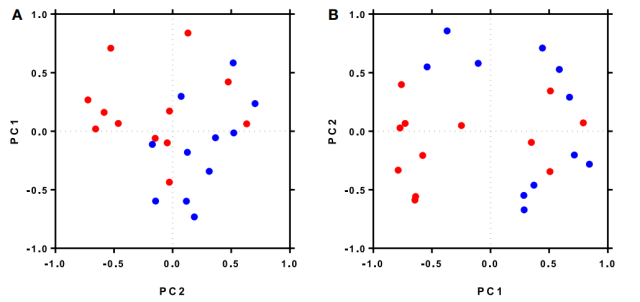
(图 A) 整个基线标准化白细胞频率数据集的前两个主成分 (PC1, PC2) 部分区分了快速 (红色) 和缓慢 (蓝色) 应答者。研究者首先统计基线数据是否包含足够的信息来区分快速应答者和缓慢应答者。通过将数据标准化并通过 PCA 降低其复杂性,试图有可能将快速和缓慢应答的患者部分分离。
(图 B) 在筛选了频率受直接抗病毒治疗显著影响的白细胞群体基线数据后,标准化白细胞频率的前两个主成分分离了快反应者 (红色) 和慢反应者 (蓝色)。DAA 治疗开始后,CD8+T 细胞、CD4+和 CD8+中央记忆 T 细胞 (TCM) 频率增加,而 CD4+和 CD8+效应记忆 T 细胞 (TEM)、CD4+ TEMRA 细胞、naïve CD4+T 细胞、非经典型 CD14+CD16+单核细胞和 CD56bright NK 细胞频率降低。
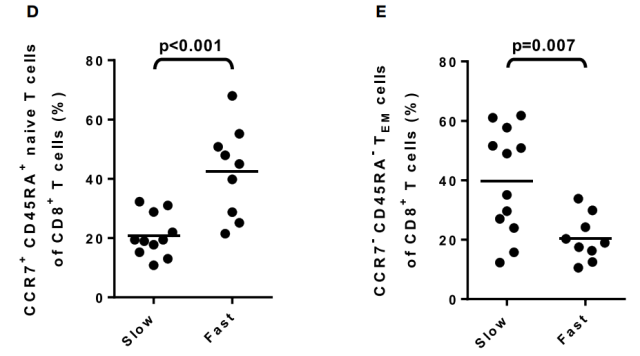
研究者进行了单变量分析,以确定受 DAA 治疗影响的哪些参数与快反应状态或慢反应状态最显著相关。
(图 C) 快反应和慢反应患者基线 CD3+T 细胞频率的比较,慢反应患者 CD3+T 细胞频率高于快反应者。
(图 D) 快速和缓慢反应者之间基线初始 CD8+T 细胞频率的比较,慢反应患者初始 CD8+T 细胞频率低于快反应者。
(图 E) 比较快反应者和慢反应者的基线 CD8+TEM 细胞频率,慢反应患者 CD8+TEM 细胞频率高于快反应者。
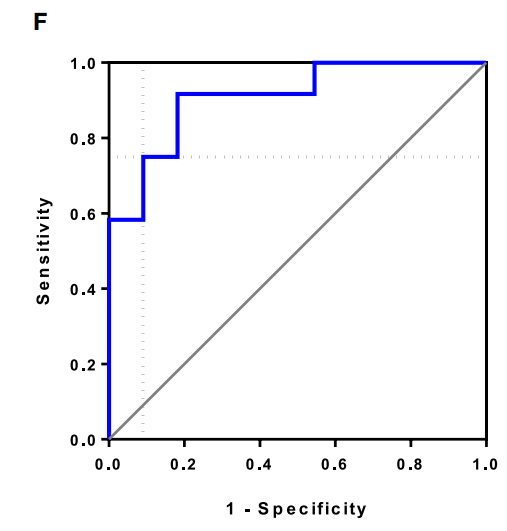
(图 F) 将基线 CD3+T 细胞频率和基线初始 CD8+T 细胞频率作为自变量纳入二元 logistic 回归模型。通过受试者工作特征曲线分析确定快速反应和缓慢反应评分的最佳临界值为 0.66,其敏感度为 75.0%,特异度为 91.0%。
2. 预测快速和缓慢反应的模型

(表 A) 比值比和 95% 置信区间。值得注意的是,比值比的 95% 置信区间 (CI) 较窄,模型拟合良好 (Nagelkerke R-squared = 0.623)。

(表 B) 根据基线 CD3+T 细胞和 CCR7+ CD45RA+ 初始 CD8+T 细胞频率将 23 例研究患者分为直接抗病毒 (DAA) 治疗的快反应组和慢反应组。使用 0.66 的临界值,治疗前 CD3+T 细胞和 CCR7+ CD45RA+ naïve CD8+T 细胞的频率正确地将 82.6% 的患者分类为快反应或慢反应。
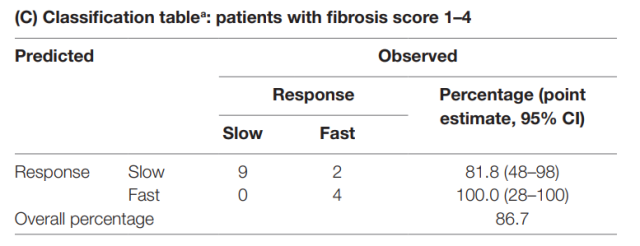
(表 C) 免疫标志物对不同程度肝纤维化的 15 例患者的分类情况,根据基线 CD3+T 细胞和 CCR7+ CD45RA+初始 CD8+T 细胞频率将 15 例研究患者分为 DAA 治疗的快反应组和慢反应组。总体正确分类率为 86.7%,而在所有肝纤维化患者均为慢反应者的无效假设下,正确分类率为 60.0%。快速反应肝纤维化患者的真阳性率为 4/4 (100%); 因此,研究者认为该检测方法将特别有助于确定哪些慢性 HCV 感染合并肝纤维化的患者将成为快速反应者。

(表 D) 10 例患者的前瞻性分类。临界值为 0.66。在这一前瞻性组中,8 例患者为慢反应,2 例为快反应: 所有慢反应患者均被纠正为慢反应。该模型正确识别了两个快速反应者中的一个。为了前瞻性、安全地缩短 DAA 治疗时间,高阳性预测值 (PPV) 的检测比高灵敏度的检测更重要。重要的是,唯一一个预计会快速反应的患者被证明是如此。
3.预测模型的机制-慢反应患者中外周血 CD8+T 细胞的全面活化
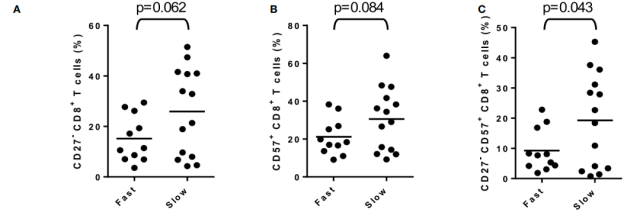
(A) 快反应和慢反应中 CD27-CD8+T 细胞的频率
(B) 快反应和慢反应中 CD57+ CD8+T 细胞的频率
(C) 快速和缓慢反应中慢性激活的 CD27- CD57+ CD8+T 细胞的频率
当 DAA 的作用明显不依赖于免疫机制时,为什么基于记忆 T 细胞亚群分布的预测模型应该正确地分类对 DAA 治疗的快反应或慢反应? 为了解决这一问题,研究者将数据合并分析,由于慢反应患者的特征是 CD3+T 细胞频率较高,而 naïve CD8+T 细胞频率较低,因此再分析重点关注 CD8+T 细胞活化和分化的标志物。最显著的发现是在慢反应个体中 CD27- CD57+ CD8+T 细胞的过度表达 (图 2A-C),这意味着这些个体中慢性活化的 CD8+T 细胞的相对积累。这些活化的 T 细胞非常频繁,不能具有病毒特异性;相反,它们的相对丰度可能是慢性 HCV 感染的间接后果。

(图 D) 用于估计 CD8+T 细胞中 CD5 表达的离散度的方法的视觉表示。
这些例子分别代表了 n = 7 和 n = 8 的样本中的一个快速反应者和一个缓慢反应者。
第一对直方图显示在对数轴上绘制的 CD5 大于 1 的荧光强度。
第二对直方图显示在线性轴上绘制的经 log10 转换的值及其各自的中位数。
第三对直方图显示 log10 转换值与中位数的绝对偏差,以及各自的中位数。
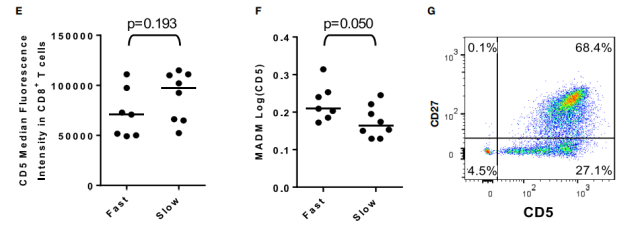
(图 E) 用中位荧光强度估计快速和缓慢反应者 CD8+T 细胞的 CD5 表达。
(图 F) 来自快速和缓慢反应的 CD8+T 细胞中的 MADM Log(CD5)。评估 CD8+T 细胞中 CD5 表达的扩散可以更好地区分快速和缓慢反应。快速应答者与缓慢应答者相比,CD8+T 细胞中 CD5 表达的分布范围显著更广 (图 2D-F)。
(图 G) CD5 表达的下调似乎仅限于 CD27- CD8T 细胞。
讨论
本研究采用无偏倚方法筛选接受 DAA 治疗的慢性 HCV 患者不同外周血白细胞群的变化,包括 T 细胞亚群、B 细胞、NK 细胞、单核细胞和树突状细胞 (DCs)。非经典型单核细胞、CD56bright NK 细胞和记忆性 T 细胞亚群频率的突出而集中的变化与 DAA 治疗后的病毒清除相关; 但对 B 细胞、经典型 NK 细胞及外周血 DC 亚群无明显影响。DAA 治疗相对较小的免疫学影响在构建预测模型时很方便,因为需要考虑的独立变量较少。研究者发现仅知道治疗前 CD3+ T 细胞和 CCR7+ CD45RA+初始 CD8+T 细胞的频率,就可以将 82.6% 的患者正确分类为快反应或慢反应。重要的是,90.0% 的真实阳性预测率意味着研究者分类方法在识别快速反应患者方面表现非常好。一种可靠地确定快速应答者的方法使他们有可能接受较短疗程的 DAA 治疗,从而降低医疗提供者的成本。
快反应或慢反应状态与 T 细胞亚群分布改变之间的显著关联提出了因果关系的问题。慢反应患者的特征是 (1)CD3+ T 细胞在 CD45+白细胞中的比例较高,(2)TEM 细胞在 CD8+T 细胞中的比例较高,(3)CD27- CD57+ CD8+T 细胞的比例较高。这些过度表达的 CD8+T 细胞亚群过于频繁,不能代表 HCV 特异性 T 细胞的扩增。无论是分泌 IFN-y 的能力,还是耗竭标志物 CD49b、CD223、CD279、CD160 和 CD244 的表达,都没有证据表明这些 T 细胞的功能受损 (数据未显示)。因此,与之前的报道一致,研究者的结果表明非特异性 CD8+T 细胞应答可通过旁观者机制全身激活。研究者推测,病毒清除时间延长与慢性活化 T 细胞频率较高之间的关联是更严重或更慢性的反映,但是最终在反应慢的个体中病毒特异性反应的有效性较低。23 例患者中有 22 例获得 SVR12,前瞻性研究中 10 例患者中有 10 例获得 SVR12;因此,本文讨论的免疫学现象不是 DAA 治疗成功的一般决定因素,而是预测至病毒清除的时间。在未来的研究中,我们计划探索在难治性患者中,寻找扩大的旁观者过度激活与完全治疗失败之间可能存在的关系。本研究的一个局限性是病例的数量不允许在模型中纳入更多的自变量。然而,在未来,研究者预测可以通过纳入更多的免疫学、临床、病毒学或组织病理学参数来进一步完善。
总之,治疗前慢性活化 CD8+T 细胞和记忆 CD8+T 细胞亚群的频率可用于可靠地预测接受 DAA 治疗的慢性 HCV 感染患者的早期病毒控制。在未来,这一发现可能缩短预测为快速反应患者的 DAA 治疗时间,从而大幅降低成本。

文章来源:贝克曼库尔特生命科学