医患沟通存问题屡见不鲜,其中的原因各式各样,但对于我们医生来说,从一些严重、典型的医患问题中总结经验,也许会是更好的自我保护途径。
如十年前的一起医患事故,当年的新闻表明,该患者确诊强直性脊柱炎(AS)后,因使用抗肿瘤坏死因子(TNF)制剂而诱发了活动性肺结核,多重原因作用下,导致悲剧发生。
在十年后的今天,这个社会新闻也同样具有教育意义。除了更好地去解决医患沟通问题外,我们还需要更加重视药物应用带来的副作用。
数据表明,中国是一个结核病高发的国家,其中大部分人是潜伏性结核感染状态 [1,2],而该事件中使用的 TNF-α 抑制剂有增加结核复燃的风险 [3],因此临床医生在使用 TNF-α 抑制剂时应更加慎重。
那么如何更好地对 AS 进行治疗呢?我们先来看一下疾病的核心机制。
中轴型脊柱关节炎(axSpA)的核心机制
AS 也被称之为放射学阳性中轴型脊柱关节炎,而 axSpA 还包括放射学阴性中轴型脊柱关节炎(nr-axSpA)。
目前认为 axSpA 的核心炎症介质有 TNF-α 和 IL-17[4,5]。其中 IL-17 可诱导多种促炎症细胞因子表达并和它们产生协同效应,包括 TNF-α 和前列腺素,还会作用于正反馈环以增强自身的合成和效用。(文末附 axSpA 生物制剂治疗总结表格)
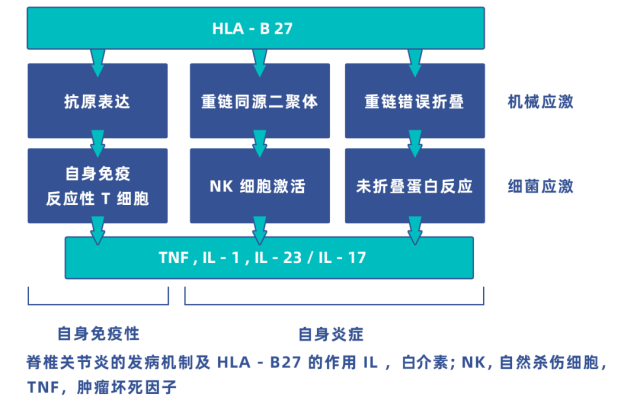
图 1:中轴型脊柱关节炎(axSpA)的发病机制示意图 [6]
已上市 IL-17 抑制剂治疗疗效已证实
针对该发病机制中的 IL-17,目前已上市的 IL-17 抑制剂有:司库奇尤单抗(Secukinumab)、依奇珠单抗(Ixekizumab)等。经初步研究发现,这两个药物并不会增高结核复燃的风险[7,8]。
一项针对 AS 的随机双盲对照研究结果证实 [9]:治疗 16 周时,司库奇尤单抗治疗组(150 mg)的 ASAS20 应答率是 61%,而安慰剂组为 28%(p < 0.001)。
ASAS20 是指评估脊柱关节炎症状的 4 个方面,起码有 3 个方面 + 10 个单元至少改善了 20%;且其他领域小于 20% + 小于 10 单元存在恶化。
ASAS40 是指评估脊柱关节炎症状的 4 个方面,起码有 3 个方面 + 20 个单元至少改善了 40%;且其他领域没有恶化。
4 个方面分别指:① BASFI 评分、② 晨僵、③ 患者整体评估、④ 疼痛视觉评分。[10]
不止是 AS,司库奇尤单抗对于 nr-axSpA 也具有疗效。一项针对 nr-axSpA 患者的随机对照双盲对照证实 [11],治疗 16 周时,初始负荷剂量司库奇尤组的 ASAS40 应答率为 41.5%,高于安慰剂组的 29.2%(P < 0.05)。
依奇珠单抗的疗效也同样得到证实。一项针对 AS 的随机双盲对照研究提示 [12]:在治疗的第 16 周时,依奇珠单抗治疗组的 ASAS40 应答率是 52%,而安慰剂组是 18%(p < 0.0001)。并且一项针对 nr-axSpA 的随机双盲对照研究也提示 [13]:治疗 16 周时,2 周一次依奇珠单抗治疗组的 ASAS40 应答率是 40%(p = 0.0016),4 周一次依奇珠单抗治疗组为 35%(p = 0.0094),而安慰剂组是 19%。
目前已上市的 IL-17 抑制剂已通过研究数据证实了安全、有效性。而 Bimekizumab 作为新一代的 IL-17 抑制剂,它是一个人源化的 IgG1 抗体,其作用靶点包括:IL-17A、IL-17F[14],理论上其对 IL-17 的抑制会更充分。
IL-17A/F 抑制剂的研究数据
Bimekizumab 的一项针对 AS 的随机双盲对照研究 [16] 提示,在第 12 周,Bimekizumab 治疗的患者的 ASAS40 应答率明显高于安慰剂组(29.5%~46.7% vs 13.3%;p < 0.05);或与安慰剂组比较,ASAS40 应答率的优势比为 2.6~5.5(95% CI 1.0~12.9)。
在第 48 周,接受 Bimekizumab 160 mg 和 320 mg 治疗的患者,分别有 58.6% 和 62.3% 的 ASAS40 应答率;在后入组的患者中观察到类似的 ASAS40 应答率。
通过该研究证实该药物能实现症状的大幅度改善(ASAS40 是一个症状改善幅度较大的标准),且起效相对迅速。

图 2:不同剂量 Bimekizumab 组与安慰剂对照的研究图 [16]
EULAR 大会报道最新进展
此次 EULAR 大会报道了两个 Bimekizumab 的随机双盲对照研究结果。该组研究分为两个部分,一部分是针对 AS 的病人(共 332 个病人)[17],另一部分是针对 nr-axSpA(共 254 个病人)[18]。
针对 AS 的随机双盲对照试验(BE MOBILE 2)[17] 提示,治疗 16 周时,治疗组的 ASAS40 应答率为 44.8%,而对照组为 22.5%(p < 0.001)。治疗 16 周后,对照组改用 Bimekizumab 治疗,在治疗的第 24 周,这些病人也显示了相似的改善。
在针对 nr-axSpA 的随机双盲对照试验(BE MOBILE 1)[18] 结果也提示:治疗组有 47.7% 的 ASAS40 应答率,而对照组只有 21.4%(p < 0.001)。主要终点跟次要终点均保持一致的改善,说明不存在内部矛盾数据,结论可信。在治疗的 16 周,对照组改用 Bimekizumab 治疗做后续观察,发现其也有显著改善。
这个研究的两个部分均确保了疾病基线特征具有可比性(年龄、性别特征、病程、HLA-B27 阳性率、前期抗肿瘤坏死因子治疗比率)。并且除 ASAS40 应答率外,其他疗效观察指标,如高敏 CRP 数值、磁共振显像等也显示相当的疗效。
这一交叉验证则进一步肯定了 Bimekizumab 的疗效。
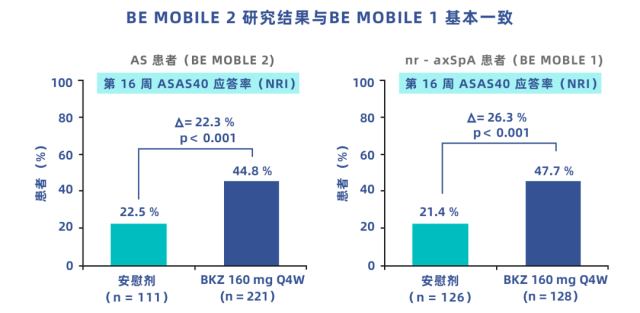
图 3:BE MOBILE 2[17] 和 BE MOBILE 1[18] 研究的 ASAS40 应答率对比图
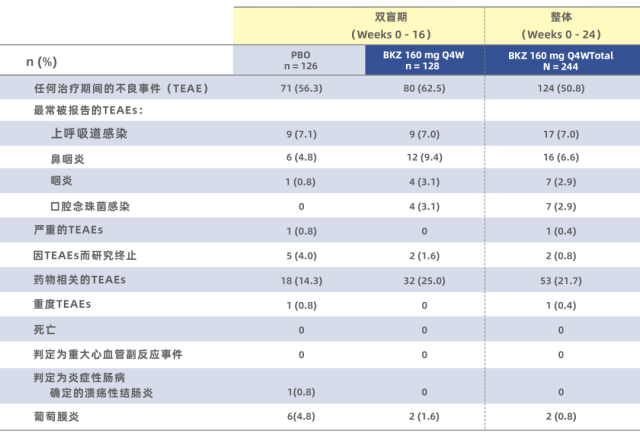
除疗效外,这两个试验 [17,18] 也针对安全性展开研究:观察到药物治疗组有偏高的鼻咽炎、口腔念珠菌感染;但没有严重副反应(包括心血管副反应事件),也没有因为药物副反应而导致治疗终止的情况(具体见下文表格)。有研究 [19] 提示 IL-17 抑制剂的常见副反应中包含口腔念珠菌感染,但病情并不严重。EULAR 大会此次报道的这两个试验 [17,18] 和此前的副反应研究结果一致,并且也和 2020 年发表的另一个 Bimekizumab 的随机双盲研究 [16] 结果基本一致。
表 1:BE MOBILE 2[17] 的安全性数据
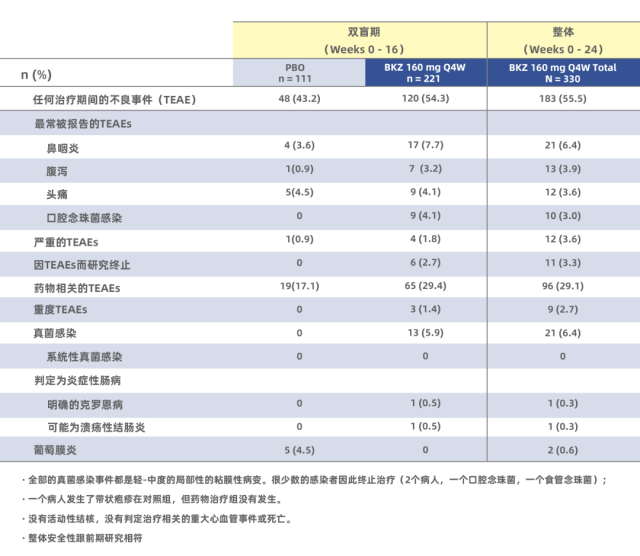
表 2:BE MOBILE 1[18] 的安全性数据
生物制剂与中轴型脊柱关节炎
生物制剂治疗的出现,为中轴型脊柱关节炎的治疗提供了新方向。不同生物制剂有不同的用药方式、用药频率,以及副反应。简单总结表格如下:
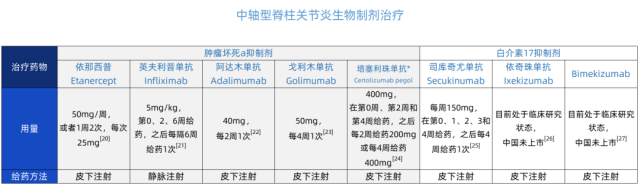
* 培塞利珠单抗 AS 和 nr-axSpA 未在国内获批,FDA 已获批
本文仅供医疗卫生等专业人士参考
内容策划:王东方
项目审核:邵澜媛
题图来源:图虫创意、丁香园临床用药指南
参考资料:
[1]. Houben RM, Dodd PJ. The Global Burden of Latent Tuberculosis Infection: A Re-estimation Using Mathematical Modelling. PLoS Med 2016; 13:e1002152.
[2]. 任坦坦, 陆普选等.2020 WHO 全球结核报告:全球与中国关键数据分析 [J]. 新发传染病电子杂志.2020(5)4:28-284
[3]. Winthrop KL, Baxter R, Liu L, et al. Mycobacterial diseases and antitumour necrosis factor therapy in USA. Ann Rheum Dis 2013; 72:37.
[4]. Veldhoen M. Interleukin 17 is a chief orchestrator of immunity. Nat Immunol 2017; 18:612.
[5]. Poddubnyy D, Sieper J. What is the best treatment target in axial spondyloarthritis: tumour necrosis factor α, interleukin 17, or both? Rheumatology (Oxford) 2018; 57:1145.
[6]. Marc C. Hochberg. Rheumatology [M].Philadelphia, PA : Elsevier, Inc., [2019] .1010
[7]. Elewski BE, Baddley JW, et al. Association of Secukinumab Treatment With Tuberculosis Reactivation in Patients With Psoriasis, Psoriatic Arthritis, or Ankylosing Spondylitis. JAMA Dermatol. 2021 Jan 1;157(1):43-51. doi: 10.1001/jamadermatol.2020.3257.
[8]. Fowler E, Ghamrawi RI, Ghiam N, Liao W, Wu JJ. Risk of tuberculosis reactivation during interleukin-17 inhibitor therapy for psoriasis: a systematic review. J Eur Acad Dermatol Venereol. 2020 Jul;34(7):1449-1456. doi: 10.1111/jdv.16254. Epub 2020 Mar 15.
[9]. Dominique Baeten, Joachim Sieper, Jürgen Braun, et al. Secukinumab, an Interleukin-17A Inhibitor, in Ankylosing Spondylitis. N Engl J Med 2015;373:2534-48.
[10]. Gary S. Firestein,Ralph C. Budd. Firestein & Kelley’s Textbook of Rheumatology [M].Philadelphia, PA : Elsevier, Inc.[2021] 1335
[11]. Deodhar A, Blanco R, Dokoupilová E, et al. Improvement of Signs and Symptoms of Nonradiographic Axial Spondyloarthritis in Patients Treated With Secukinumab: Primary Results of a Randomized, Placebo-Controlled Phase III Study. Arthritis Rheumatol 2021; 73:110.
[12]. van der Heijde D, Cheng-Chung Wei J, Dougados M, et al. Ixekizumab, an interleukin-17A antagonist in the treatment of ankylosing spondylitis or radiographic axial spondyloarthritis in patients previously untreated with biological disease-modifying anti-rheumatic drugs (COAST-V): 16 week results of a phase 3 randomised, double-blind, active-controlled and placebo-controlled trial. Lancet 2018; 392:2441.
[13]. Deodhar A, van der Heijde D, Gensler LS, et al. Ixekizumab for patients with non-radiographic axial spondyloarthritis (COAST-X): a randomised, placebo-controlled trial. Lancet 2020; 395:53.
[14]. Adams R, Maroof A, Baker T, Lawson ADG, Oliver R, Paveley R, Rapecki S, Shaw S, Vajjah P, West S, Griffiths M.Bimekizumab, a Novel Humanized IgG1 Antibody That Neutralizes Both IL-17A and IL-17F.Front Immunol. 2020 Aug 21;11:1894. doi: 10.3389/fimmu.2020.01894. eCollection 2020.PMID: 32973785
[15]. Reich K, Warren RB, Lebwohl M, Gooderham M, et al. imekizumab versus Secukinumab in Plaque Psoriasis. N Engl J Med. 2021 Jul 8;385(2):142-152. doi: 10.1056/NEJMoa2102383. Epub 2021 Apr 23.PMID: 33891380 Clinical Trial.
[16]. Désirée van der , et al.Dual neutralisation of interleukin-17A and interleukin-17F with bimekizumab in patients with active ankylosing spondylitis: results from a 48-week phase IIb, randomised, double-blind, placebo-controlled, dose-ranging study. Ann Rheum Dis 2020;0:1–10. doi:10.1136/annrheumdis-2020-216980
[17]. bimekizumab in patients with active ankylosing spondylitis : 24-week efficacy & safety from be mobile 2, a phase 3, multicentre, randomised, placebo-controlled study.2022 EULAR
[18]. bimekizumab in patients with active nonradiographic axial spondyloarthritis: 24-week efficacy & safety from be mobile 1, a phase 3, multicentre, randomised, placebo-controlled study.2022 EULAR
[19]. Carmen Rodríguez-Cerdeira , et al. Candida infections in patients with psoriasis and psoriatic arthritis treated with interleukin-17 inhibitors and their practical management. Ital J Dermatol Venerol. 2021 Oct;156(5):545-557. doi: 10.23736/S2784-8671.20.06580-3. Epub 2020 Oct 7.PMID: 33026212
[20]. https://labeling.pfizer.com/ShowLabeling.aspx?id = 14494
[21]. https://www.xian-janssen.com.cn/sites/default/files/PDF/40.zhu_she_yong_ying_fu_li_xi_dan_kang_ni_yin_zhi_ban_shuo_ming_shu_.pdf
[22]. https://newdrugs.dxy.cn/h5/drugs_description/1qNdKgTbKpzJ9fPmPrjSdg ==
[23]. ge_li_mu_dan_kang_zhu_she_ye_yu_chong_shi_zhu_she_qi_.pdf (xian-janssen.com.cn)
[24]. https://newdrugs.dxy.cn/h5/evidence/pfsI6aKpcNwkI6iECsNdGg ==
[25]. https://newdrugs.dxy.cn/h5/drugs_description/1qNdKgTbKpzJ9fPmPrjSdg ==
[26]. https://www.lilly.com.cn/index.html#/?path = new_release&aid = 226
[27]. EULAR 2022 abstract OP0019 & POS0939