卵巢癌是卵巢肿瘤的一种,是严重威胁女性健康的恶性肿瘤之一。由于卵巢癌早期缺少症状,即使有症状也不特异,筛查的作用又有限,因此早期诊断比较困难,而晚期病例又疗效不佳。虽然卵巢癌的发病率低于宫颈癌和子宫内膜癌居妇科恶性肿瘤的第三位,但死亡率却超过宫颈癌及子宫内膜癌之和,高居妇科癌症首位,是严重威胁妇女健康的疾病之一。本期小编给大家介绍几个卵巢癌的大队列样本分析的经典案例。
案例一:利用不同蛋白质组学分析策略研究 CT45—卵巢癌的化疗敏感性介质与免疫治疗的新靶标
大多数高级别浆液性卵巢癌 (HGSOC) 患者对铂类化疗产生耐药性并复发,但也有 15% 的患者在 10 年以上仍然无病。为了发现长期生存的驱动因素,由芝加哥大学医学研究小组等研究者定量分析了微量福尔马林固定石蜡包埋肿瘤中铂耐药和敏感 HGSOC 患者的蛋白质组学分析,运用了基于质谱的定量蛋白组学、磷酸化蛋白组学技术,针对卡铂耐药和卡铂敏感患者进行分析,探究高级别浆液性卵巢癌患者的长期生存的驱动因素。相关研究成果发表在国际专业学术期刊《Cell》上。
研究者将 25 例来自美国芝加哥大学未接受化疗的卵巢癌组织样本库的 HGSOC 组织样本,用基于质谱法的蛋白组学方法将组织样本分离,并使用微量 FFPE(石蜡包埋)样品鉴定和定量到 9000 多种蛋白,定量动态范围高达 6 个数量级。在分析了 9000 余种蛋白水平后,发现 CT45 是高级别浆液性卵巢癌患者独立预后因子。为了对这一发现进行验证,研究者检测了 200 余例卵巢癌患者肿瘤组织,发现其中 82 例患者肿瘤组织中无 CT45 表达,42 例高表达,随访研究发现 CT45 高表达患者无病生存期均较长,寿命相比 CT45 缺乏的患者提高了 7 倍。再次证实了 CT45 是晚期高级别浆液性卵巢癌的独立预后因子。
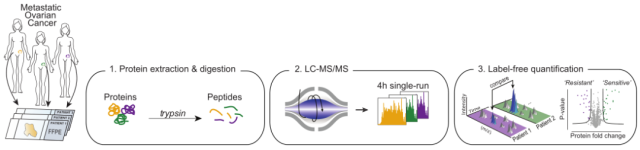
图 1 基于高分辨质谱 Orbitrap 的 HGSOC 蛋白质组学分析流程(点击查看大图)
此外,研究者对化疗反应的分子机制也进行了探讨,卡铂的标准化疗能引起卵巢癌的 DNA 损伤,而卡铂化疗在 CT45 高表达肿瘤细胞中带来的 DNA 损伤更为显著,可导致培养的细胞死亡和小鼠肿瘤缩小。为了进一步研究 CT45 介导的化疗敏感性原因,研究者利用定量互作蛋白组学分析发现 CT45 与进化保守的蛋白质磷酸酶 4(PP4)复合物的相互作用,CT45 是 PP4 信号传导的新型内源调节因子,通过抑制 PP4 参与 DNA 损伤途径。而 CT45 过表达有效提高了肿瘤细胞的化疗敏感性!未来通过激活肿瘤细胞中的 CT45 表达有望提高铂类化疗的疗效。
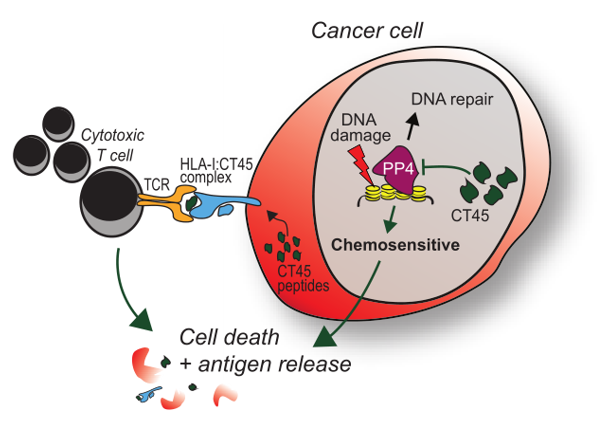
图 2 CT45 分子作用机制(点击查看大图)
该研究认为 CT45 是卵巢癌独立预后因子,与晚期卵巢癌患者无病生存期较长显著相关且可作为铂类敏感性调节剂和卵巢癌的免疫治疗靶点。这是第一个基于质谱法的蛋白组学发现的预后和功能性的生物标志物,运用了包括 shot-gun 蛋白质鉴定、LFQ 蛋白质定量、磷酸化蛋白质组学、蛋白质相互作用组学以及免疫肽组学,可见临床癌症蛋白质组学鉴定化疗和免疫疗法靶点具有非常显著的临床意义。
案例二:高级别浆液性卵巢癌蛋白质组学研究—揭示卵巢癌转移机理
2019 年 5 月,Nature 上发表了标题为 Proteomics reveals NNMT as a master metabolic regulator of cancer-associated fibroblasts 的卵巢癌研究内容(* 由芝加哥大学的 Ernst Lengyel 团队发表)。该研究通过将激光捕获显微切割 (laser-capture microdissection) 与基于 Orbitrap 蛋白质组学分析策略结合,对临床石蜡包埋组织样品中细胞进行研究,最少可做到 5000 个细胞。通过联合运用,他们发现与肿瘤转移密切相关的成纤维细胞 (cancer-associated fibroblast,CAF) 中调控蛋白 N-甲基转移酶 (N-methyltransferase(NNMT)) 参与卵巢癌的发生发展以及转移过程。
通过搜集了 11 位高级别浆液性卵巢癌(High-grade serous carcinoma,HGSC)病人 107 个组织样本,然后使用显微切割技术将肿瘤组织和基质分别提取进行蛋白质组学分析(流程见下图)。
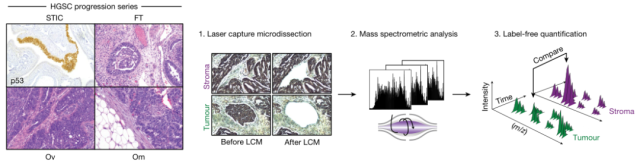
图 3 微量显微切割肿瘤组织和基质样品蛋白质组学分析流程(点击查看大图)
对于这种低浓度样本,Orbitrap 高分辨质谱可实现临床石蜡样本数据深度覆盖,共鉴定到 6944 个蛋白,其中 FABP4 蛋白变化显著,在网膜转移 (omental metastases) 肿瘤中高表达,比较网膜转移和原发型肿瘤基质,发现 NNMT 蛋白上调,NNMT 介导催化 S-腺苷甲硫氨酸(SAM)的转化。通过免疫组化实验验证了 NNMT 在网膜转移的肿瘤基质中高表达,并且当 CAF 细胞中敲低 NNMT 后,细胞形态接近正常。
后续通过动物模型验证蛋白表达趋势,作者构建 HGSC 转移小鼠模型,确认将 NNMT 敲低的 CAF 与 HGSC 细胞共同注射到小鼠体内,肿瘤细胞的增殖和肿瘤大小则显著降低,并且用 NNMT 的抑制剂处理也能降低。通过临床样本数据分析,基质中 NNMT 高表达的病人预后更差,而在肿瘤组织中 NNMT 高表达的病人却并没有显著差异。综上研究作者推断 NNMT 是调控高级别浆液性卵巢癌转移的关键角色。
案例三:高分级浆液性卵巢癌早期诊断生物标志物的研究新策略
加拿大 Thomas Kislinger 教授团队在 Cell Systems 上发表了高级别浆液性卵巢癌相关研究文章。在这篇研究中,研究者开发了一个使用临床相关患者来源的异种移植物 (PDX) 和 N-糖肽富集的工作流程,使用原位移植的 PDX 模型,可以在小鼠血清背景中轻松识别「人类独特的」蛋白质,从而克服与基于蛋白质组学的生物标记物发现相关的限制,目的是鉴别肿瘤相关的人来源蛋白。
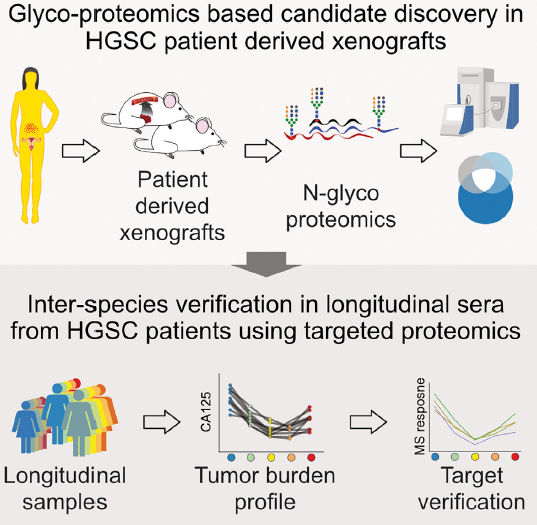
图 4 基于高分辨质谱的异种移植物 (PDX) 和 N-糖肽富集的工作流程(点击查看大图)
该研究 2 种不同的 PDX 模型,收集 PDX-肿瘤和 PDX-血清,以来自非移植的同基因小鼠血清(NEGsera)作阴性对照,运用 label-free 定量 N 糖基化蛋白质组加以分析。研究发现,与对照组 NEG 血清相比,PDX-血清样本与 PDX-肿瘤样本存在显著差异。各样品类型中共鉴定到 3922 个糖基化位点,其中绝大部分糖基化位点(约 2077 多个位点)仅在 PDX-肿瘤中发现分布。PDX-肿瘤和 PDX-血清中定量到 649 个位点,表明这些肽可用作 HGSC 生物标记物。总之,基于 PDX 的 N-糖蛋白组策略可以检测血清中的肿瘤相关蛋白。
随后通过生物信息学分析,作者获得了 PDX-血清中各种丰度的蛋白质功能注释。作者将小鼠蛋白质定位到它们的人类直向同源物中,产生总共 745 种独特的蛋白质。比较 PDX-血清和 PDX-肿瘤中定量到的 1559 个糖基化位点的强度,表明人类独特的糖基化位点在 PDX-肿瘤中具有更高的强度。为了能够对来自 HGSC 患者的血清中的肿瘤相关肽进行定量,作者使用平行反应监测质谱(PRM-MS)系统地开发了靶向蛋白质组学测定。他们通过优化色谱梯度和标准化碰撞能量(NCE)来最大化测定响应,并通过使用稳定同位素标准(SIS)肽评估测定特异性。研究者快速开发了通过基于 PDX 的 N-糖蛋白组学策略发现的 408 种肽的 PRM-MS 分析,成功率为 90%。
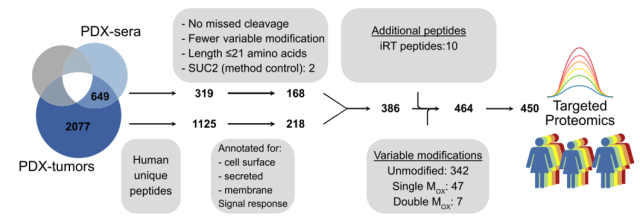
图 5 使用平行反应监测质谱(PRM-MS)系统地对潜在标记物进行筛选(点击查看大图)
该篇文章开发的原位移植的 PDX 模型新策略,能够识别潜在的新的肿瘤相关蛋白。最后,合成稳定的同位素标记肽的使能够快速开发用于 HGSC 患者血清定量的靶向蛋白质组学分析,当然这一策略仍旧需要在更大的患者队列中进行验证。
大规模的临床样本,完善的临床预后信息,超高深度的蛋白质组学数据,精细缜密的生物学验证,均需要高分辨率、高灵敏度、高质量精度、高稳定性的质谱仪器作为辅助手段。历经多年风雨,Orbitrap 质谱一直伴随着蛋白质组学研究成长,终得硕果。赛默飞拥有蛋白质组学分析的最佳工具 Orbitrap 高分辨质谱仪,同时具有最全面、最完整的组学分析技术流程,实现从蛋白质功能到结构的解析,并具备充分的功能验证手段,助力高水平研究成果产出。我们也更加期待蛋白质组学驱动精准医学成果在未来预防、诊断、治疗多方面的应用转化,共同促进精准医学飞速发展。
参考文献
1. Multi-level Proteomics Identifies CT45 as a Chemosensitivity Mediator and Immunotherapy Target in Ovarian Cancer https://www.sciencedirect.com/science/article/pii/S0092867418311668
2. Proteomics reveals NNMT as a master metabolic regulator of cancer-associated fibroblasts https://www.nature.com/articles/s41586-019-1173-8
3. N-Glycoproteomics of Patient-Derived Xenografts: A Strategy to Discover Tumor-Associated Proteins in High-Grade Serous Ovarian Cancer https://pubmed.ncbi.nlm.nih.gov/30981729/