新突破
新冠肺炎自 2019 年暴发以来,给全社会带来了灾难性的影响,不仅对全世界人民的健康造成了巨大威胁,还对全球经济产生了震荡性的影响。因此,对新冠病毒的研究也显得愈发重要。近期,来自北京大学医学部精准医疗多组学研究中心的黄超兰团队、中国科学院院士高福团队以及中国科学院天津工业生物技术研究所高峰团队,通过采用基于质谱的糖基化修饰鉴定技术,对新冠病毒颗粒上 S 蛋白的 O-糖基化修饰图谱进行了整体描绘,进而提出了「O-Follow-N」的 O 糖基化修饰规律,为新冠肺炎的致病机制探索提供了研究基础。而这项出色的研究,也于 2021 年 8 月 2 日以「O-glycosylation pattern of the SARS-CoV-2 spike protein reveals an『O-Follow-N』rule」为题发表在了 Cell Research 期刊上。

糖基化修饰(Glycosylation)是蛋白质主要的翻译后修饰类型,其广泛参与细胞黏附、识别、信号转导等重要过程,影响蛋白质的分泌、运输和稳态调控,可发生在细胞 50-70% 的蛋白质上,2021 年糖基化修饰鉴定被 Nature Methods 评为最值得关注的技术之一。

根据糖苷链类型,蛋白质糖基化修饰可以分为四类:(1)N-连接糖基化;(2)O-连接糖基化;(3)C-连接糖基化;(4)糖基磷脂酰肌醇锚定。
其中 O-糖基化修饰,是在高尔基体中产生。它在人体中有 70 余种常见糖型,无特定氨基酸结构域。目前,对 O-糖基化修饰研究存在许多困难,比如:
1. 糖基化修饰的糖链形成无固定模版;
2. 受 200 多种糖基转移酶的复杂调控;
3. 糖基化肽段剂量水平低;
4. 规模化糖链结构解析通量低;
5. 糖链构成微不均一性,定性与定量困难;
6. 功能性糖基化位点及关键糖结构指认困难。
受这些因素影响,对 O-糖基化修饰的研究也是少之又少。现阶段,对于大规模、高通量的蛋白质翻译后修饰的研究,最好的途径就是利用基于高分辨质谱的蛋白质组学技术。在这篇报道中,黄教授等团队,就是通过基于质谱的蛋白质组学技术,克服一系列困难,首次对新冠病毒上 S 蛋白的 O-糖基化进行了综合性描绘。
实验中,研究者为获得天然状态下 S 蛋白的 N-和 O-糖基化修饰完整图谱,首先从 SARS-CoV-2 病毒颗粒上获得 S 蛋白,并使用了 LysC+Trypsin, Chymotrypsin, GluC, Elastase 以及 alpha-Lytic 等多种蛋白酶将 S 蛋白酶解成肽段。而对于这种复杂糖蛋白酶解后产生的肽段,普通质谱很难进行检测。研究者则采用了具有超高分辨率的 Orbitrap Eclipse 三合一质谱仪,并利用三合一仪器多种碎裂功能中的阶梯 HCD(stepped collisional energy SCE),HCD(Higher-energy collisional dissociation)以及组合式的 HCDpdEThcD 三种碎裂方法进行质谱分析。

图 1. Orbitrap Eclipse 三合一质谱仪
Orbitrap Eclipse 三合一质谱仪是一台不仅拥有着 CID, HCD, ETD HD, EThcD HD, ETciD, UVPD, PTCR 等多种碎裂模式的质谱仪,而且还具有高达 50 万的分辨率,能够对多种形式的修饰肽段进行精准定性与定量,为研究者提供了更坚实的硬件基础。
研究中,研究者共鉴定到了 39 个糖基化修饰位点。其中包括此前已报道的 22 个 N-糖基化修饰位点,以及 17 个 O-糖基化修饰位点。值得注意的是,这 17 个 O-糖基化修饰位点是首次从 SARS-CoV-2 病毒颗粒中提取的 S 蛋白上鉴定到的。并且通过深入分析这些位点,研究者发现在这 17 个位点中,有 11 个位点位于糖基化的天冬酰胺(Asn, N)附近。为了更准确的对这一现象进行挖掘,研究者将 NxS/T 共有基序内糖基化的 N 每一侧的 3 个氨基酸定义为「N±1-3」。分析结果显示,11 个 O-糖基化修饰位点分布在「N±1-3」的位置上,位点信息确定的位点有 10 个,其中 7 个位点分布在「N+2」的位置上。研究者还通过开展定点突变实验进一步证实 N 糖基化修饰的存在是「N±1-3」的位置上出现 O-糖基化修饰的先决条件。基于以上分析,研究者提出 SARS-CoV-2 病毒 S 蛋白的糖基化修饰存在 O-糖基化修饰追随 N-糖基化修饰发生的现象,并将这一现象命名为「O-Follow-N」规律。
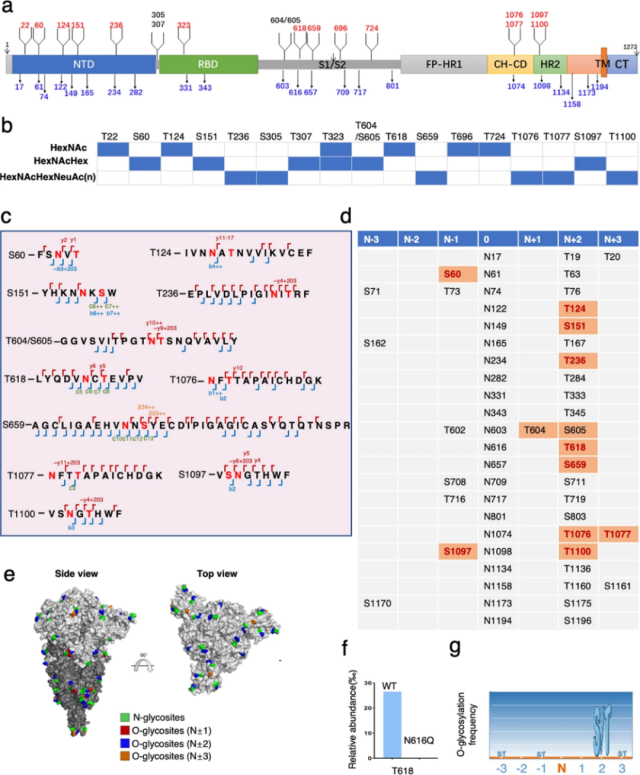
图 2. 新冠病毒 S 蛋白上符合「O-Follow-N」规律的 O 糖基化修饰(点击查看大图)
小结
研究基于前沿的质谱分析技术,通过使用超高分辨的三合一质谱仪 Orbitrap Eclipse,揭示了新冠病毒上 S 蛋白的 O 糖基化修饰谱,进而提出了 O 糖基化修饰的「O-Follow-N」规律,同时这一规律也可能适用于其它蛋白。这个规律提示 O-糖基化修饰具有潜在的调控新机制,特别是 N-和 O-糖基化修饰之间可能存在的协同作用,未来有望在极大程度上推动糖生物学领域的研究。
专家访谈
黄超兰(北京大学医学部精准医疗多组学研究中心主任)
问:根据您的经验,O-糖基化修饰鉴定的难点在哪里?
答:对于所有的蛋白翻译后修饰鉴定都普遍存在着几个相同的难点:(1)修饰丰度相对较低,难以直接鉴定,往往需要进行修饰富集,因此对样本量等要求较高;(2)修饰调节为动态变化过程,鉴定重复性会相对低一点。而对于 O-糖基化修饰,因其特殊性,又有几个其他因素影响:(1)糖基化修饰的糖链形成无固定模版,且受多种糖基转移酶的复杂调控;(2)规模化糖链结构解析通量低,定性与定量困难;(3)功能性糖基化位点及关键糖结构指认困难。
问:Orbitrap Eclipse Tribrid 三合一质谱联用仪在该研究中发挥了怎样的作用?
答:在我们的实验体系中,使用了多种蛋白酶对 S 蛋白进行处理,因此会产生长短不一,形式各异的肽段,而这就要求配套的质谱仪器能够具有多种碎裂模式,而 Orbitrap Eclipse 质谱仪就很好地满足了我们的需求。并且 Orbitrap Eclipse 具有很好的分辨率以及稳定性,这对我们的实验提供了很大帮助。
问:新冠病毒颗粒上提取的 S 蛋白 O-糖基化修饰图谱的揭示对新型冠状病毒肺炎的研究有哪些帮助?
答:我们在实验中发现了「O-Follow-N」变化规律,这对研究糖基化的变化具有很好的提示作用。并且这个规律也显示 O-糖基化修饰具有潜在的调控新机制,特别是 N-和 O-糖基化修饰之间可能存在的协同作用,未来有望在极大程度上推动糖生物学领域的研究。
专家介绍
黄超兰教授长期致力于质谱和蛋白质组学前沿新技术和方法的研究开发,应用范围包括生物学基础、医学和临床研究,是高度跨界,善于交叉学科整合,战略规划制定和人员管理的全方位技能科学家。
