医师 A:这个晚期肺癌患者查出来 EGFR 突变阳性(EGFRm),还挺幸运的,但一代/二代/三代 EGFR 靶向药都是指南 Ⅰ 级推荐的,怎么选择呀?
医师 B:发现 EGFR 突变是挺幸运的,但可惜迟早都会耐药,需要提前告知下患者
医师 A:后期耐药确实是个问题,但患者还查出来有脑转移,得好好考虑下用药方案了~
在所有靶点中,表皮生长因子受体(EGFR)作为首个被发现的靶点,其突变比例在亚裔人群中相对更高,约 45.9% 的中国非小细胞肺癌(NSCLC)患者都有 EGFR 突变[1]。但目前已有三代表皮生长因子酪氨酸激酶抑制剂(EGFR-TKI)面世,合理进行用药选择的难题也困惑着临床医师。
一代、二代、三代 EGFR 靶向药有何区别?
从早期到晚期肺癌,EGFR-TKI 如何选择?
脑转移患者使用哪种 TKI 疗效更佳?
EGFR 靶向治疗耐药后如何处理?
丁香园特邀专家北京大学人民医院副院长杨帆教授,就以上问题进行了探讨分享,以期对临床工作有所帮助。

北京大学人民医院副院长杨帆教授
不同分期 NSCLC 如何选择 EGFR-TKI 药物?
EGFR-TKI 是一类作用于细胞内络氨酸激酶区的小分子药物,阻断 EGFR 信号通路,从而达到抑制肿瘤生长的作用。
提及临床上常用的 EGFR-TKI 药物有哪些,杨教授谈到,目前已上市的共有三代:
第一代 EGFR-TKI 包括吉非替尼、厄洛替尼、埃克替尼,特点是与 EGFR 可逆性结合,它们的研究与广泛应用提高了肺癌 EGFR 基因突变患者的PFS获益。
第二代 EGFR-TKI 包括阿法替尼、达可替尼,特点是以共价键的方式与 EGFR 不可逆结合,但二代 EGFR-TKI 没有克服获得性 EGFR 20 外显子 T790M 耐药突变。
第三代 EGFR-TKI 包括奥希替尼、阿美替尼、伏美替尼,特点除了与 EGFR 不可逆结合外,还克服了一代、二代常见的 T790M 耐药突变的药物,并拥有控制脑转移的优势。
无论是一代、二代还是三代 EGFR-TKI 药物,都在美国食品药品监督管理局(FDA)及国家药品监督管理局(NMPA)拿到了各自的通行证,并在各大指南争相异彩(表 1)。
表 1. 指南对于 EGFR-TKI 在肺癌中的应用推荐(整理自:文献 2-4)
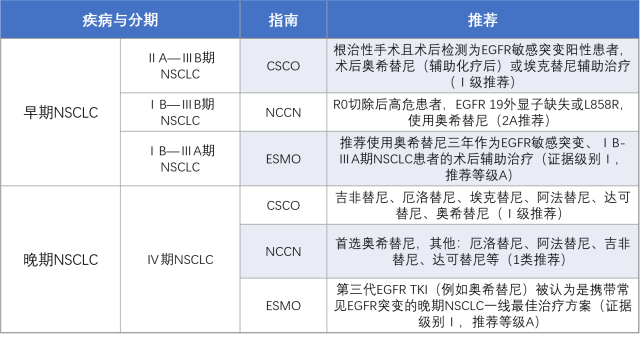
辅助靶向治疗降低早期 NSCLC 术后复发风险
虽然早期肺癌治疗手段以手术为主,但术后复发转移风险较高,ⅠB 期患者 5 年复发率约为 45%,Ⅱ 期患者 5 年复发率约为 62%,ⅢA 期患者 5 年复发率约为 76% [5],且多数是远处转移,其中尤以神经系统转移为主[6],故延缓患者复发时间在提高早期 NSCLC 患者生存率上至关重要,而常规辅助化疗并不能满足这一需求,希望的目光转向了已在晚期取得优异成绩的 EGFR-TKI。
在早期 NSCLC EGFR 靶向治疗中,奥希替尼和埃克替尼都在中国获得了批准。两者分别是基于 ADAURA 研究[7]及 EVIDENCE 研究[8],从结果上来看,均可以延长 EGFR 突变阳性早期 NSCLC 患者的无病生存期(DFS),但奥希替尼可显著降低局部和远处复发,特别是脑转移的风险,且奥希替尼的人群覆盖范围较广,为 ⅠB~ⅢA 期 NSCLC 患者,基于此,在《Ⅰ~ⅢB期非小细胞肺癌完全切除术后辅助治疗指南(2021)版》中[9],奥希替尼成为 ⅠB~ⅢB 期 EGFR 突变阳性 NSCLC 患者术后标准辅助治疗方案(1 类证据,一致推荐)。
临床医生可根据患者的风险、体能状况、个人意愿等,选择最合适的辅助靶向治疗模式。
肺癌晚期一线治疗格局多样,何去何从?
与一线化疗相比,第一代 EGFR-TKI 对于 EGFRm NSCLC 的临床效果令人鼓舞。如吉非替尼的 IPASS 研究[10]、厄洛替尼的 OPTIMAL 研究[11]等,显示第一代 TKI 类药物一线治疗 EGFRm 的 NSCLC 疗效明显优于含铂双药化疗。自此奠定了以吉非替尼为代表的 TKI 药物在晚期 NSCLC 中的一线治疗地位。
第二代药物以阿法替尼、达克替尼为代表,通过与第一代 TKI 的头对头对比,显示出其治疗优势,如 LUX-Lung7[12,13] 及 ARCHER1050[14] 亚洲人群数据,对比了阿法替尼、达克替尼与吉非替尼作为一线治疗 EGFRm 晚期 NSCLC 有效性和安全性(有效性数据详见表 2)。总的来说,对于常见突变,与第一代 TKI 相比,第二代具有靶点多、临床获益显著但不良反应多,患者耐受性差等特点。
目光转向三代药,FLAURA 研究[15,16] 头对头对比了三代奥希替尼与一代吉非替尼、厄洛替尼,结果显示,三代奥希替尼显著延长了 PFS 及 OS(表 2)。ESMO、NCCN 等指南一致推荐,三代 TKI 奥西替尼为一线治疗优选用药[3,4]。
表 2. 不同 EGFR-TKI 对于 EGFR 常见突变的研究结果(整理自文献 12-16)
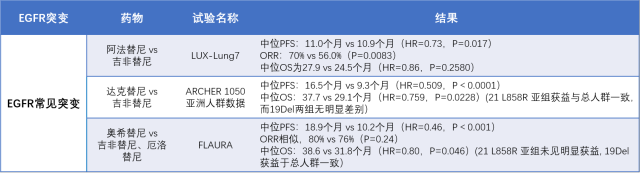
对于晚期 NSCLC,尽管一代、二代、三代 EGFR-TKI 都被指南推荐用于 EGFR 敏感突变一线治疗,但临床上,需要综合现有的医保政策、循证医学证据等,仔细进行考量。
NSCLC 脑转移患者如何选择 EGFR-TKI?
肺癌最常见的远处转移部位之一便是中枢神经系统(CNS),大约 25% 的晚期 EGFR 突变NSCLC 患者在确诊时就存在脑转移[17]。肺癌脑转移患者的预后非常差,自然平均生存时间仅 1~2 个月。
脑转移治疗具有极大的挑战性,一方面,作为 CNS 天然屏障的血脑屏障限制了药物的入脑效果。另一方面,脑转移类型不同(脑实质转移和脑膜转移),其有效的诊断方式不同,影响了治疗的干预[18]。
故药物的血脑屏障透过率对于脑转移治疗非常重要,研究显示,与其他已上市的 EGFR- TKI 相比,奥希替尼具有最佳的血脑屏障通过率[19],同时临床研究也证实了奥希替尼在脑转移的肺癌患者中的显著疗效,III 期临床研究脑转移亚组显示,奥希替尼治疗组 vs 标准一代 EGFR-TKI(吉非替尼或厄洛替尼)治疗组,中位无进展生存期(mPFS)分别为 15.2 个月 vs 9.6 个月(HR=0.47, P<0.001),展示了奥希替尼在治疗肺癌脑转移患者中的优势[16]。另外,2021 年 12 月份获批晚期 NSCLC 一线治疗的阿美替尼也对脑转移患者具有较好的疗效,已公布的临床研究结果显示,与吉非替尼相比,阿美替尼可以延长 CNS 转移亚组患者的 PFS,降低疾病进展风险 62%(HR 0.38;95% CI 0.24-0.60)[20]。
患者 TKI 耐药了,后续怎么办?
EGFR-TKI 耐药后的应对策略可以分为两个维度。一个是临床维度,根据有无症状和进展模式来处理,已写入了 NCCN 指南。
另一个是分子机制维度,根据具体的分子耐药机制来制定后续治疗策略,这是更为根本的治疗方式。首先患者进展时要尽量进行二次活检,有助于进行基因检测明确耐药机制,无法获取组织时也可以用血检来替代。之后根据耐药机制来进行后续治疗(图 1)。
一代/二代 EGFR-TKI 耐药机制主要包括 EGFR 二次突变(如 T790M 突变的出现)、旁路激活(如 MET、HER2 的激活)、下游通路的激活(如 BRAF 突变)、组织学类型的转变(如向小细胞肺癌转化)。其中 T790M 突变是 EGFR-TKI 获得耐药最常见的机制[21],约占 50%,出现 T790M 突变后直接使用奥希替尼治疗已获得了不少国内外权威指南的认可。
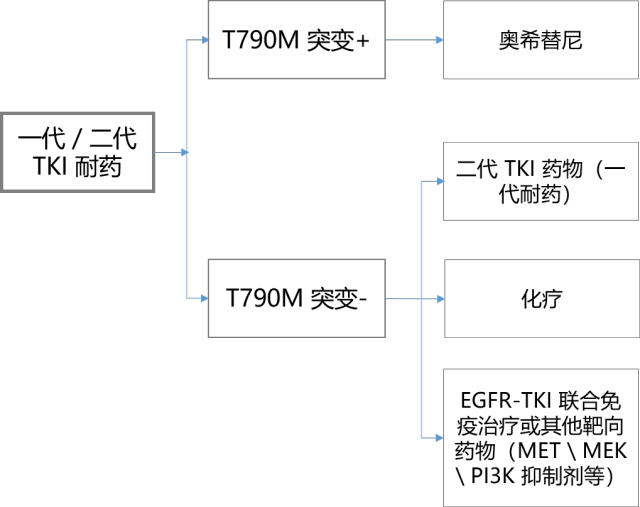
图1. 一代/二代 EGFR-TKI 耐药后的治疗策略(整理自:文献 22)
三代 EGFR-TKI 耐药机制较复杂,可能与 C797S 和 L718Q 突变、HER2、MET 基因扩增等有关[23]。所以一般会结合分子耐药机制综合考虑。
EGFR-TKI 敢为人先,肺癌靶向未来可期
EGFR-TKI 一线治疗,相比于传统化疗,无论是安全性还是有效性,都更胜一筹,极大地提高了患者的生存率。同时,从一代至三代,肺癌 EGFR 靶向治疗也在不断地迭代和推动。未来肺癌靶向治疗的方向,将会体现在过去很多不能成药的靶点的研发,也体现在新靶点发现,让更多靶点有药物可以用,同时,针对性地精准克服每一代药物造成的后续耐药。
参考文献:
1. Liu SY, et al. The Unique Characteristics of MET Exon 14 Mutation in Chinese Patients with NSCLC. J Thorac Oncol. 2016 Sep;11(9):1503-10. doi: 10.1016/j.jtho.2016.05.016. Epub 2016 May 30. PMID: 27257131.
2. 中国临床肿瘤学会(CSCO),非小细胞肺癌诊疗指南2021.
3. NCCN Guidelines, Non-small cell lung cancer, version 2. 2022-March 7.2022.
4. Passaro A, et al. ESMO expert consensus statements on the management of EGFR mutant Non-Small Cell Lung Cancer. Ann Oncol. 2022 Feb 14:S0923-7534(22)00112-0.
5. Pignon JP, et al. LACE Collaborative Group. Lung adjuvant cisplatin evaluation: a pooled analysis by the LACE Collaborative Group. J Clin Oncol. 2008 Jul 20;26(21):3552-9.
6. Chouaid C, et al. Adjuvant treatment patterns and outcomes in patients with stage IB-IIIA non-small cell lung cancer in France, Germany, and the United Kingdom based on the LuCaBIS burden of illness study. Lung Cancer. 2018 Oct;124:310-316.
7. Wu YL, et al. ADAURA Investigators. Osimertinib in Resected EGFR-Mutated Non-Small-Cell Lung Cancer. N Engl J Med. 2020 Oct 29;383(18):1711-1723.
8. He J, et al. Icotinib versus chemotherapy as adjuvant treatment for stage II-IIIA EGFR-mutant non-small-cell lung cancer (EVIDENCE): a randomised, open-label, phase 3 trial. Lancet Respir Med. 2021 Sep;9(9):1021-1029.
9. 中国抗癌协会肺癌专业委员会, 中华医学会肿瘤学分会肺癌学组, 中国胸部肿瘤研究协作组. Ⅰ~ⅢB期非小细胞肺癌完全切除术后辅助治疗指南(2021版) [J] . 中华医学杂志, 2021, 101(16) : 1132-1142.
10. Wu YL, et al. Efficacy according to blind independent central review: Post-hoc analyses from the phase III, randomized, multicenter, IPASS study of first-line gefitinib versus carboplatin/paclitaxel in Asian patients with EGFR mutation-positive advanced NSCLC. Lung Cancer. 2017 Feb;104:119-125.
11. Zhou C, et al. Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutation-positive non-small-cell lung cancer (OPTIMAL, CTONG-0802): a multicentre, open-label, randomised, phase 3 study. Lancet Oncol. 2011 Aug;12(8):735-42.
12. Park K, et al. Afatinib versus gefitinib as first-line treatment of patients with EGFR mutation-positive non-small-cell lung cancer (LUX-Lung 7): a phase 2B, open-label, randomised controlled trial. Lancet Oncol. 2016 May;17(5):577-89.
13. Paz-Ares L, et al. Afatinib versus gefitinib in patients with EGFR mutation-positive advanced non-small-cell lung cancer: overall survival data from the phase IIb LUX-Lung 7 trial. Ann Oncol. 2017 Feb 1;28(2):270-277.
14. Cheng Y, Mok TS, Zhou X, Lu S, Zhou Q, Zhou J, Du Y, Yu P, Liu X, Hu C, Lu Y, Zhang Y, Lee KH, Nakagawa K, Linke R, Wong CH, Tang Y, Zhu F, Wilner KD, Wu YL. Safety and efficacy of first-line dacomitinib in Asian patients with EGFR mutation-positive non-small cell lung cancer: Results from a randomized, open-label, phase 3 trial (ARCHER 1050). Lung Cancer. 2021 Apr;154:176-185.
15. Soria JC, et al. FLAURA Investigators. Osimertinib in Untreated EGFR-Mutated Advanced Non-Small-Cell Lung Cancer. N Engl J Med. 2018 Jan 11;378(2):113-125.
16. Soria JC, Ohe Y, Vansteenkiste J, Reungwetwattana T, Chewaskulyong B, Lee KH, Dechaphunkul A, Imamura F, Nogami N, Kurata T, Okamoto I, Zhou C, Cho BC, Cheng Y, Cho EK, Voon PJ, Planchard D, Su WC, Gray JE, Lee SM, Hodge R, Marotti M, Rukazenkov Y, Ramalingam SS; FLAURA Investigators. Osimertinib in Untreated EGFR-Mutated Advanced Non-Small-Cell Lung Cancer. N Engl J Med. 2018 Jan 11;378(2):113-125.
17. Rangachari D, et al. Brain metastases in patients with EGFR-mutated or ALK-rearranged non-small-cell lung cancers. Lung Cancer. 2015 Apr;88(1):108-11.
18. Li W, Bai R, Cui J. [Targeted Therapies for Driver Gene Mutation-positive Lung Cancer Patients with Brain Metastasis]. Zhongguo Fei Ai Za Zhi. 2019 Nov 20;22(11):719-726. Chinese.
19. Colclough N, et al. Preclinical Comparison of the Blood-brain barrier Permeability of Osimertinib with Other EGFR TKIs. Clin Cancer Res. 2021 Jan 1;27(1):189-201.
20. Shirley M, Keam SJ. Aumolertinib: A Review in Non-Small Cell Lung Cancer. Drugs. 2022 Mar 19. doi: 10.1007/s40265-022-01695-2. Epub ahead of print. PMID: 35305259.
21. Morgillo F, et al. Mechanisms of resistance to EGFR-targeted drugs: lung cancer. ESMO Open, 2016, 1(3): e000060.
22. 高洁,史明鹏,孟姝彤,宋婷婷,刘自民.EGFR突变阳性非小细胞肺癌EGFR-TKI治疗研究进展[J].精准医学杂志,2021,36(06):555-558+564.
23. Wang S, et al. Mechanisms of resistance to third-generation EGFR tyrosine kinase inhibitors. Front Med. 2016 Dec;10(4):383-388.
声明:本文由阿斯利康提供支持,仅供医疗卫生专业人士参考