中国肿瘤放射治疗联盟
【通信作者】胡漫,山东省肿瘤防治研究院(山东省肿瘤医院),山东第一医科大学(山东省医学科学院),山东 济南 250117
E-mail:【human5770@163.com】
【通信作者】袁双虎,山东省肿瘤防治研究院(山东省肿瘤医院),山东第一医科大学(山东省医学科学院),山东 济南 250117
E-mail:yuanshuanghu@sina.com
中图分类号:R739.91 文献标识码:B
【摘要】
头颈部肿瘤放射治疗相关黏膜炎是头颈部肿瘤在放射治疗过程中常见的并发症之一,引发黏膜溃疡、出血、感染等,引起患者口腔、咽喉部疼痛,进食和吞咽功能下降,严重影响患者生活质量,重者导致放疗中断,影响患者生存预后。头颈部肿瘤放射治疗相关黏膜炎还与住院风险和医药费用支出上升有关。从口腔到食管上端的任何暴露在头颈部放射线照射野内的黏膜组织都可能发生黏膜的急性损伤,如口腔黏膜炎、咽喉部黏膜炎等。为归纳总结头颈部肿瘤放射治疗相关黏膜炎临床诊疗经验,中国肿瘤放射治疗联盟组织肿瘤放疗科、口腔科等领域专家,遵循现有循证医学证据,结合放化疗和口腔科等相关科室专家意见,参考国内外指南、临床证据,认真研读,反复修订,最终形成本指南,旨在为头颈部肿瘤放射治疗相关黏膜炎的诊断、预防与治疗实践提供参考。
【关键词】黏膜炎;指南;诊断;治疗;预防
Guidelines for the prevention and treatment of acute mucositis associated with radiation therapy for head and neck tumors
The Chinese Radiation Therapy Oncology Group
[Corresponding author] Man Hu, Shandong Cancer Hospital and Institute, Shandong First Medical University and Shandong Academy of Medical Sciences, Jinan, Shandong 250117, China
E-mail: [human5770@163.com ]
[Corresponding author] Shuang-Hu Yuan, Shandong Cancer Hospital and Institute, Shandong First Medical University and Shandong Academy of Medical Sciences, Jinan, Shandong 250117, China
E-mail: yuanshuanghu@sina.com
[Abstract]Mucositis associated with radiation therapy for head and neck tumors is one of the common complications of radiation therapy. Causing mucosal ulceration, bleeding, infection, Etc., resulting in pain in the patient's mouth and throat, reducing eating and swallowing functions, which seriously affects the patient's quality of life, and in severe cases, leads to interruption of radiation therapy and affects the patient's survival prognosis. Mucositis associated with head and neck tumors radiation therapy is also associated with an increased risk of hospitalization and medical expenses. To summarize the clinical experience of mucositis associated with radiation therapy for head and neck tumors, the Chinese Radiation Therapy Oncology Group organized radiation therapy and stomatology experts to follow the existing evidence-based medical evidence and combine experts' opinions in radiotherapy and stomatology. This guideline were finally formed by carefully reading and repeatedly revising it concerning domestic and international policies and clinical evidence, aiming to provide a reference for diagnosing, preventing, and treating radiation therapy-related mucositis in head and neck tumors.
【Key words】mucositis; guidelines; diagnosis; treatment; prevention
放射治疗相关黏膜炎是头颈部肿瘤患者常见的并发症,易引发疼痛、吞咽困难,严重者甚至需要肠内或肠外营养。如不尽早干预,放任黏膜炎进展,容易导致患者对阿.片类药物依赖甚至中断肿瘤治疗。《「健康中国 2030」规划纲要》提出, 至 2030 年,实现全人群、全生命周期的慢性病健康管理,总体癌症 5 年生存率提高 15%,现阶段离目标尚有较大差距。头颈部放疗相关黏膜炎的规范防治可提升放疗患者的治疗依从性,提升患者生活质量,有利于患者生存率的提高。
为了进一步规范头颈部肿瘤放射治疗相关黏膜炎的临床诊断、预防和治疗,中国肿瘤放射治疗联盟组织放疗科、口腔科等领域专家一同制定了本指南。指南制定流程:(1)中国肿瘤放射治疗联盟指南工作组成员收集文献证据和专家主要观点(推荐意见);(2)工作组内部会议讨论并进一步完善全文,证据级别分类及推荐强度评定见附表;(3)由执笔负责人员进行汇编;(4)专家编委会对全文主要观点提出修改意见,并经指南审核专家组成员审核,一致通过;(5)执笔人根据专家意见修改,发至指南专家组成员,得到>80% 专家认可后定为初稿;(6)经过修订返回指南专家组组长审定后提交终稿以供发表。
1 头颈部肿瘤放射治疗相关黏膜炎
1.1 定义
头颈部肿瘤放射治疗相关黏膜炎(以下简称黏膜炎)是放射线引起的黏膜急性损伤。从口腔到食管任何暴露在头颈部放射线照射野内的黏膜组织都可能发生黏膜急性损伤,如口腔黏膜炎、咽部及喉部黏膜炎等,按黏膜炎严重程度可表现为红斑、水肿或糜烂至不同程度溃疡等 [1, 2]。
1.2 临床表现
黏膜炎除引起局部疼痛、口干、进食和味觉障碍外,还可能导致发热、乏力和全身炎性反应 [3, 4]。头颈部肿瘤放射治疗引起的黏膜损伤使得机体免疫防御能力下降,口腔菌群失调,感染风险上升,其中免疫功能严重低下患者败血症风险上升 [5, 6]。
1.3 病理生理
目前认为黏膜炎由肿瘤治疗过程中一系列相互关联和重叠的因素引发 [7]。典型的头颈部肿瘤放射治疗相关黏膜炎的病理生理学包括 5 个阶段。(1)起始阶段:放射线诱发细胞损伤,促进基底上皮和黏膜下层细胞内活性氧的形成,此时黏膜功能正常。(2)初始损伤阶段:细胞损伤激活转录因子如 p53 和核转录因子-кB(nuclear factor-kappa B,NF-кB),此阶段对黏膜损伤的进程可能非常重要。(3)信号放大阶段:最终激活 NF-кB 通路产生的炎症细胞因子如肿瘤坏死因子-α、白细胞介素-1b(interleukin-1b,IL-1b) 和 IL-6 释放,导致组织损伤和细胞凋亡。在此阶段,黏膜炎可能出现临床症状。(4)溃疡阶段:溃疡出现。 在这个阶段,有细菌定植和败血症风险。(5)黏膜愈合阶段:引起黏膜持续损伤信号消失后黏膜逐步愈合 [7-9]。
1.4 流行病学现状
文献报道,在接受头颈部放射治疗的患者中,黏膜炎总体发生率在 50%~97%[10-16]。发病部位不限于口腔,咽、喉部黏膜炎发病也较为常见。来自一项泰国的随机、双盲安慰剂对照研究报道,其头颈部肿瘤放射治疗相关Ⅲ度咽炎发生率约 27%~32%[15]。一项来自福建省肿瘤医院的前瞻性调查研究显示,其头颈部肿瘤放射治疗相关咽喉炎的发生率由放疗前的 1.5% 升至第 4 周的 90%,黏膜炎在放疗第 4 周发生率为 83.1%[16]。
咽喉部黏膜炎的放射剂量累积耐受性较口腔黏膜炎高。一项研究表明,放射性口腔黏膜炎对比咽部黏膜炎的中位耐受剂量为 28 Gy vs 51.4 Gy[17]。
老年人、女性和儿童黏膜炎发生风险可能增加,有关年龄、性别等相关因素与头颈部肿瘤放射治疗相关黏膜炎的流行病学数据参见表 1。
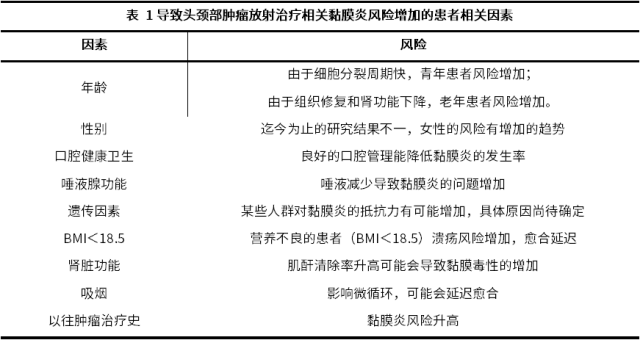
尚不完全了解有关黏膜炎的风险因素,既往发表的数据认为其与肿瘤的治疗密切相关,风险因素大致归为患者相关因素和治疗相关因素 [18]。
1.5.1 患者相关因素 年龄、性别、口腔卫生健康状态、唾液腺分泌功能、遗传因素、身体质量指数(body mass index,BMI)、肾功能和吸烟状态等都是黏膜炎风险患者相关因素 [19-27]。见表 1。
注:BMI. 身体质量指数。
1.5.2 治疗相关因素 肿瘤放疗影响黏膜炎的因素包括放疗分割方式、剂量及放疗部位、合并治疗(化疗或靶向治疗)等 [12, 28-47]。见表 2。
1.5.2 治疗相关因素 肿瘤放疗影响黏膜炎的因素包括放疗分割方式、剂量及放疗部位、合并治疗(化疗或靶向治疗)等 [12, 28-47]。见表 2。

注:PTV. 计划靶区。
2 诊断和分级
2.1 诊断
黏膜炎的诊断主要基于临床表现。头颈部放疗时,黏膜出现红斑,伴有轻至中度疼痛,但累计剂量为 10 Gy 后没有明显的溃疡性改变。上皮细胞的萎缩性改变通常发生在总剂量为 16~22 Gy 时,在这个阶段,不适感会增加,可能需要镇痛治疗。在累积剂量 ≥ 30 Gy 时,溃疡性病变经常发生在脸颊、口唇、舌腹和舌侧。角质化程度较高的部位,如舌根、齿龈和硬腭的受累在口腔黏膜炎中并不常见。溃疡性口腔黏膜炎的病变常不规则,经常伴有红斑,常常被假膜所覆盖。患者往往非常紧张,不能正常进食。溃疡性病变可能在放疗完成后持续 2~4 周。在接受同步放化疗的头颈部肿瘤患者中,严重溃疡持续到治疗结束后 5~7 周也很常见 [10, 48]。放疗后的慢性黏膜炎也有报道 [48],然而随着调强放疗(intensity-modulated radiation therapy,IMRT)技术的发展,这种情况可能会改变 [49-51]。
有必要与其他病理进行鉴别诊断,因为黏膜炎可合并细菌、病毒和真菌感染 [10]。病毒感染在临床上可能与黏膜炎不同,因为可能影响硬腭、牙龈和舌根的角质化黏膜。在有争议的病例中,需要进行脱落细胞学和微生物培养,以鉴别诊断 [48]。此外,真菌感染可能经常发生,一般由白色念珠菌或其他念珠菌属引起 [48]。
图 1 直观地标注了各黏膜炎发生的解剖学部位 [52],以便于临床区分和鉴别。口腔黏膜炎在临床易于直观观察,咽喉部等其他解剖学部位发生的黏膜炎较难直观,其发病率不低 [16] [17],诊断标准较为主观,缺乏实用的评估工具,存在预防和治疗需求,需要引起患者和医护人员的重视。
2 诊断和分级
2.1 诊断
黏膜炎的诊断主要基于临床表现。头颈部放疗时,黏膜出现红斑,伴有轻至中度疼痛,但累计剂量为 10 Gy 后没有明显的溃疡性改变。上皮细胞的萎缩性改变通常发生在总剂量为 16~22 Gy 时,在这个阶段,不适感会增加,可能需要镇痛治疗。在累积剂量 ≥ 30 Gy 时,溃疡性病变经常发生在脸颊、口唇、舌腹和舌侧。角质化程度较高的部位,如舌根、齿龈和硬腭的受累在口腔黏膜炎中并不常见。溃疡性口腔黏膜炎的病变常不规则,经常伴有红斑,常常被假膜所覆盖。患者往往非常紧张,不能正常进食。溃疡性病变可能在放疗完成后持续 2~4 周。在接受同步放化疗的头颈部肿瘤患者中,严重溃疡持续到治疗结束后 5~7 周也很常见 [10, 48]。放疗后的慢性黏膜炎也有报道 [48],然而随着调强放疗(intensity-modulated radiation therapy,IMRT)技术的发展,这种情况可能会改变 [49-51]。
有必要与其他病理进行鉴别诊断,因为黏膜炎可合并细菌、病毒和真菌感染 [10]。病毒感染在临床上可能与黏膜炎不同,因为可能影响硬腭、牙龈和舌根的角质化黏膜。在有争议的病例中,需要进行脱落细胞学和微生物培养,以鉴别诊断 [48]。此外,真菌感染可能经常发生,一般由白色念珠菌或其他念珠菌属引起 [48]。
图 1 直观地标注了各黏膜炎发生的解剖学部位 [52],以便于临床区分和鉴别。口腔黏膜炎在临床易于直观观察,咽喉部等其他解剖学部位发生的黏膜炎较难直观,其发病率不低 [16] [17],诊断标准较为主观,缺乏实用的评估工具,存在预防和治疗需求,需要引起患者和医护人员的重视。
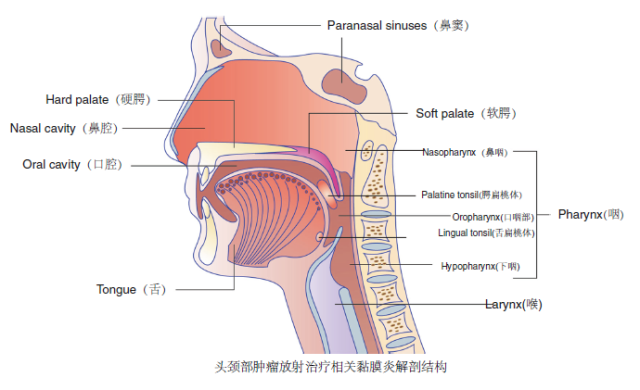
图 1 头颈部肿瘤放射治疗相关黏膜炎解剖结构
2.2 分级
黏膜炎的严重程度分级有多种评估量表可选。理想的口腔黏膜炎评估工具应该是客观、灵敏,经过验证且可靠,易于在所有临床情况下使用。最常用的量表是美国国家癌症研究所(National Cancer Institute, NCI)的通用毒性标准(CTC 5.0 版,2017 年)[53]、1995 年放射治疗肿瘤学组(Radiation Therapy Oncology Group,RTOG)的毒性标准 [54],1995 年欧洲癌症研究和治疗组织(European Organization for Research on Treatment of Cancer,EORTC)的毒性标准 [54]、世界卫生组织(World Health Organization,WHO)1979 年制定的标准 [14],以及口腔黏膜炎评估量表(Oral Mucositis Assessment Scale,OMAS)[55]。大多数在日常临床实践中使用的量表都是基于对症状、体征和功能障碍的测量。一些量表主要侧重于操作者对黏膜组织损伤(如红斑、溃疡)的观察(ORO 量表),在基于临床试验的黏膜炎评估中具有特殊价值。例如,WHO 的口腔毒性量表将黏膜损伤的迹象(红斑和溃疡)与功能损害相结合,而 RTOG 标准是仅基于对黏膜损伤强度的一般描述。量表之间并无明显优劣,评估量表可根据实际情况自行选择。见表 3。

注:WHO. 世界卫生组织;RTOG. 放射治疗肿瘤学组;CTCAE. 常见不良反应事件评价标准。
3 口腔评估
3.1 评估原则
所有旨在改善口腔黏膜炎的治疗策略都依赖于 4 个关键原则:口腔评估、个体化护理、预防措施和标准治疗 [56]。评估应在治疗前开始,确定最有可能导致患者口腔损害的风险和治疗方法。
头颈部肿瘤放射治疗期间应定期对患者进行口腔评估,对于接受头颈部根治性放疗的黏膜炎高危患者和头颈部姑息性/低剂量放疗的黏膜炎中危患者,建议接受口腔的专业评估 [2, 57]。随着调强放疗和质子放疗等在一些头颈部肿瘤患者中的应用,口腔问题的临床现状可能改变。
口腔问题应由培训合格的专业人员使用公认的分级量表进行评估(参见黏膜炎分级评估量表)[56]。专家组建议使用公认的口腔评估分级工具,以确保准确的监测和记录保存。选择的工具将取决于临床情况,但应包含客观和主观因素,评估应包括黏膜的变化、疼痛情况、患者的营养状况和疲劳程度。
3.2 口腔评估频率
对于所有黏膜炎患者在询问病史时需要了解病变位置、颜色和性质、病变持续时间、病变的变化、伴随症状、近期用药情况和吸烟史等。一般单纯放疗的头颈部急性放射性口腔黏膜炎在放射剂量>12 Gy 出现 [58]。大多数放射性口腔黏膜炎患者在放疗结束后 2~4 周症状逐步缓解。放疗相关黏膜炎的变化规律见图 2[59]。
3 口腔评估
3.1 评估原则
所有旨在改善口腔黏膜炎的治疗策略都依赖于 4 个关键原则:口腔评估、个体化护理、预防措施和标准治疗 [56]。评估应在治疗前开始,确定最有可能导致患者口腔损害的风险和治疗方法。
头颈部肿瘤放射治疗期间应定期对患者进行口腔评估,对于接受头颈部根治性放疗的黏膜炎高危患者和头颈部姑息性/低剂量放疗的黏膜炎中危患者,建议接受口腔的专业评估 [2, 57]。随着调强放疗和质子放疗等在一些头颈部肿瘤患者中的应用,口腔问题的临床现状可能改变。
口腔问题应由培训合格的专业人员使用公认的分级量表进行评估(参见黏膜炎分级评估量表)[56]。专家组建议使用公认的口腔评估分级工具,以确保准确的监测和记录保存。选择的工具将取决于临床情况,但应包含客观和主观因素,评估应包括黏膜的变化、疼痛情况、患者的营养状况和疲劳程度。
3.2 口腔评估频率
对于所有黏膜炎患者在询问病史时需要了解病变位置、颜色和性质、病变持续时间、病变的变化、伴随症状、近期用药情况和吸烟史等。一般单纯放疗的头颈部急性放射性口腔黏膜炎在放射剂量>12 Gy 出现 [58]。大多数放射性口腔黏膜炎患者在放疗结束后 2~4 周症状逐步缓解。放疗相关黏膜炎的变化规律见图 2[59]。
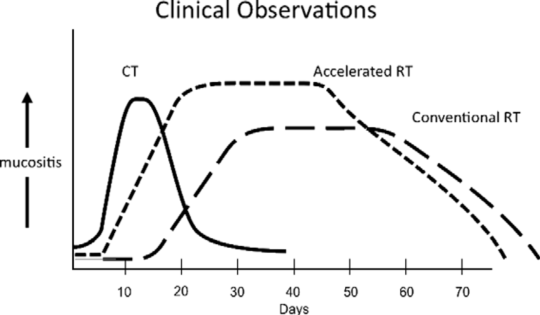
图 2 头颈部肿瘤放射治疗相关口腔黏膜炎的变化规律
建议所有有口腔黏膜炎风险的住院患者行基线评估,至少每周口腔评估 1 次 [60]。
建议所有有口腔黏膜炎风险的门诊患者行基线评估,每次复诊时评估,每周至少 1 次在家使用自我评估工具,并将结果报告主治医生。如果有条件,可进行每日评估,不规则的每周 1 次评估组与每日评估组相比,每周 1 次评估组的黏膜炎发生率被低估了约 20%~36%。即使是每周 3 次定期评估口腔黏膜炎的发生率也可能被低估 [60]。
评估应定期完成,以监测干预措施效果,并记录在医疗/护理记录中。鼓励患者积极评估自身口腔状况,并向其医疗团队报告任何变化。患者应在化疗、靶向治疗、头颈部放疗前或头颈手术后评估口腔状况 [56]。
评估应在结束治疗后持续进行,直到黏膜愈合或症状明显缓解。
评估还应了解患者教育情况。
3.3 危险因素
危险因素包括老年患者、口腔/牙齿健康不良、营养不良、合并疾病(如糖尿病)、无口腔护理、恶性口腔疾病、既往全身抗肿瘤治疗、支持性治疗如地诺单抗、酗酒/抽烟、嚼食槟榔、牙科治疗史和 HIV 感染等 [61]。
4 口腔护理
4.1 护理原则
口腔护理必须贯穿头颈部肿瘤诊断到生存的全过程 [62]。将预防、评估和管理口腔并发症纳入患者的日常护理,有助于保障患者最佳生活质量。应提供标准的预防性口腔护理。对头颈部肿瘤患者进行预处理、口腔和牙科评估是取得最佳临床效果的途径 [5]。尽管没有足够的证据支持专业口腔护理可预防口腔黏膜炎,专家小组认为,在肿瘤治疗之前,根据需要进行牙科评估和治疗有助于减少局部牙源性和全身性感染风险 [63]。
口腔护理团队一般由牙科专业人员、营养师、护士、主治医生和药剂师组成。团队专业度和良好沟通是患者口腔健康的保障。
放疗科医师与口腔相关科室应该密切合作,多学科的介入有利于形成头颈部肿瘤放射治疗相关黏膜炎的联合治疗模式,形成更专业的放疗口腔护理团队,更好地服务于肿瘤放疗相关黏膜炎患者的治疗。
4.2 牙科评估
治疗前牙科评估应为必要项目,包括全套的口腔、牙齿和牙周检查和颌骨活动范围基线和唾液腺分泌功能检查,以评估放射治疗后的变化和可能的干预措施。头颈部放射治疗的患者,应接受专业的牙科评估 [64, 65]。建立患者一般口腔健康状况信息,识别和管理现有或潜在的感染源、创伤或损伤。
4.3 食物的营养与选择
良好的营养对于机体抵抗感染、维持黏膜完整性、增强黏膜组织修复和减缓黏膜炎恶化至关重要。所有患者都应进行营养筛查,必要时可咨询营养师。应评估可能影响营养的问题,如食欲不振、味觉改变和吞咽困难 [2]。
有些食物会损害口腔黏膜。烫、粗糙、坚硬的食物会损害黏膜 [2]。辛辣、过咸和过酸食物可能会引起黏膜刺激,需要考虑有些饮食偏好患者的教育。
4.4 牙科护理
刷牙:根据口腔状况,建议每天饭后和睡前温和地刷牙、牙龈和舌头 2~4 次 [66]。建议使用软毛牙刷(手动或电动都可)以防止口腔黏膜损伤,多余的牙膏应吐出。牙刷每次使用后必须用水彻底冲洗。为了尽量清除牙菌斑,推荐使用改良 Bass 刷牙法 [56, 66, 67]。如果口腔疼痛或不能张口,可谨慎使用一次性口腔海绵。口腔海绵对控制牙菌斑或预防龋齿并不有效,不能作为刷牙的替代方案。
为了防止感染,牙刷应保持刷头向上,不要浸泡在消毒液中。建议至少每月更换牙刷以降低患者感染风险。
为了保护牙釉质,建议肿瘤患者使用高氟含量(>15%)牙膏来预防龋齿 [68]。患者应遵循口腔护理专家推荐的牙膏含氟量建议。确保患者能耐受含氟牙膏味道,例如有些患者可能无法耐受含薄荷的牙膏。有些患者可能有某些成分的禁忌。
4.5 口腔清洁
每天使用牙线、牙签或洗牙器等可能会减少牙菌斑的形成 [69-71]。然而,必须确保患者正确使用以防止不必要的黏膜损伤。接受头颈部肿瘤放射治疗的患者、有血小板减少或凝血功能障碍的患者应慎用牙线、牙签或洗牙器。
4.6 假牙
假牙应佩戴舒适,如假牙松动,会刺激口腔黏膜,破坏黏膜完整性。每餐饭后,假牙必须冲洗。每天至少彻底清洗假牙 2 次 [72]。
4.7 漱口水
使用漱口水的目的可能包括:口腔卫生,预防或治疗感染,湿润口腔或止痛。为保持口腔清洁,建议用清水漱口,生理盐水漱口水仍有可能引起黏膜刺激产生疼痛感故谨慎推荐使用,建议每次餐后漱口,每天至少漱口 4 次 [73]。建议漱口水的使用时段与刷牙不同。
应评估患者是否需要使用漱口水 [74]。不推荐氯己定漱口水用于预防放射性口腔黏膜炎 [75],但可能有其他的使用指征,如治疗牙龈炎、牙周炎、牙周脓肿等。
4.8 酒精和烟草
烟酒损害黏膜,电子烟也不例外。建议患者减少或戒掉烟酒 [76]。
4.9 口唇干燥
患者应保持充分的水化,勤喝水,保持口腔湿润。以下因素可能导致口唇干燥,如氧疗、药物(如抗抑郁药、抗组胺药、苯妥英钠、类固醇吸入剂和阿.片类药物)和老年肿瘤患者。
润滑剂如凡士林/白石蜡、润唇膏等可用于滋润嘴唇。对正在进行头颈部放射治疗的患者应使用水溶性润唇产品 [56]。
要保持黏膜湿润,可以使用漱口水,谨慎使用生理盐水,可使用唾液替代品。一些唾液替代品可能 pH 值呈酸性,易导致牙齿敏感,因此建议使用中性 pH 值或含氟的产品 [73]。
口腔护理和评估应常规进行。鼓励患者观察口腔并尽早报告变化。患者口腔状况的变化可能会影响口腔护理措施。
5 患者教育
应向所有患者提供口腔护理专业教育,并鼓励患者保持良好的口腔卫生。教育应包括潜在的口腔并发症,以使患者能够早期识别并向主治医师报告 [34-36]。
作为预防和治疗口腔疾病的一部分,所有患者都应该接受关于口腔护理的书面信息和口头指导。患者教育应在治疗前中后定期进行。教育还应包括饮食要求和建议。
患者教育是本指南指导临床和患者规范治疗的重要工作,形式可以多样化、生动,可以是微课堂、幻灯、视频、微信 [77] 推送和宣教手册等。
6 预防
在预防头颈部肿瘤放射治疗相关黏膜炎时,应与患者一同制定个体化的治疗计划,并考虑个人需求、前期口腔护理措施、疾病和患者的黏膜炎风险因素(参照【1.5.1】风险因素)。遵守预防措施和良好的口腔卫生习惯有助于最大限度地减少头颈部肿瘤放射治疗相关黏膜炎风险 [56]。预防方案的选择取决于黏膜炎风险等级. 见表 4。

7 治疗原则
黏膜炎的治疗建议由有相关专业经验的团队负责,推荐有条件的由主治医生、护士、牙医、药剂师等组成 [2]。良好的患者沟通和教育有利于治疗顺利进行。在治疗过程中应定期对患者行评估和监测(详见 3.1 评估原则)。
7.1 轻至中度黏膜炎
◇ 一旦发生黏膜炎,应建议患者口腔护理
◇ 增加口腔冲洗次数,保持口腔表面清洁湿润
◇ 检查口腔是否存在感染,做口咽拭子并适当治疗。如有需要,应进行局部或全身抗真菌治疗
◇ 在超级念珠菌等感染的情况下可使用抗真菌漱口水
◇ 应评估饮食需求,避免引起不适的食物
◇ 应监测吞咽、营养不良和体质量减轻问题,评估调整饮食,提供支持教育, 必要时需考虑鼻伺或经皮内窥镜下胃造口术等。
◇ 应评估液体摄入量,并持续监测止痛药的效果和剂量
◇ 还应评估一般健康问题(吞咽药物、血糖水平下降和血压下降、肾功能)
◇ 患者需要足量的止痛药,包括局部和全身用药
◇ 镇痛药包括扑热息痛、可待因、吗啡漱口水、苄达明漱口水、外用镇痛剂。
◇ 应该对患者进行药物使用和可能的毒副作用教育,包括黏膜炎的治疗方案和黏膜炎评估分级表的使用等。
7.2 严重黏膜炎
除了保留轻度、中度的建议外,建议:
◇ 加强对口腔的监测,推荐 1 次/d。
◇ 增加全身止痛药物的使用。
◇ 考虑皮下/静脉镇痛(阿.片)、透皮贴剂等。
◇ 继续监测和评估疼痛治疗有效性和任何潜在的毒副作用,包括患者心理变化。
8 治疗
治疗通常采用局部给药方式,必要时结合全身治疗。目前针对于放射性口腔黏膜药物的研究和文献报道较多,针对于放射性咽喉炎等的报道较少。国内可供临床使用的药物主要有生长因子和细胞因子、黏膜保护剂、镇痛剂和中药等 [2, 16]。需要指出的是,大多数临床研究的数据来自口腔黏膜炎,对咽喉部黏膜炎可能有效。有关咽喉部黏膜炎的研究有待更多的数据支持,以填补临床用药空白。
8.1 口腔黏膜炎
8.1.1 生长因子和细胞因子 生长因子和细胞因子包括人表皮生长因子、人粒细胞-巨噬细胞刺激因子(recombinant human granulocyte-macrophage colony stimulating factor,GM-CSF)、人角质细胞生长因子、人红细胞生成素和白介素-11 等。生长因子和细胞因子可配制成配方漱口水或采用雾化吸入的方式给药 [78]。
湖南省肿瘤医院等进行的前瞻性、随机对照研究显示,GM-CSF 与氯己定漱口水对比,口腔黏膜炎完全治愈患者 11 例 vs 4 例,差异有统计学意义,P = 0.017;能显著降低黏膜损伤(P<0.001),减轻疼痛(P<0.001),提高黏膜炎的治愈率,改善患者咀嚼、吞咽功能(P<0.001),促进黏膜愈合 [79]。
Saarilahti 等 [80] 的前瞻性随机双盲对照研究显示,对于头颈部肿瘤常规分割放疗患者,放疗期间随机接受硫糖铝(0.04 g/mL,4 次/d)或 GM-CSF(1.5 μg/mL,4 次/d)含漱治疗。在放疗 1 周后开始用药,直至放疗结束,总剂量为 50~60 Gy/25~30 次/5~6 周。放疗结束时,GM-CSF 组吗啡的使用量显著减少(P = 0.042)。经评估,GM-CSF 组黏膜愈合率为 24%(5/21),硫糖铝组无黏膜愈合患者;研究还发现,GM-CSF 漱口水不影响患者白细胞水平。
Wu 等 [81] 的多中心、随机、双盲、安慰剂对照Ⅱ期研究显示,接受头颈部放疗±化疗纳入的患者接受人表皮生长因子口腔喷雾或安慰剂治疗结果显示,重组人表皮生长因子可以显著降低严重口腔黏膜炎(severe oral mucositis,SOM)的发生率,差异有统计学意义(64% vs 37%),P = 0.0246。
一项随机、双盲、安慰剂对照临床研究显示,人角质细胞生长因子能够显著降低局部晚期头颈部放化疗后的 SOM,差异有统计学意义 (54% vs 69%),P = 0.041[82]。但人角质细胞生长因子类药物在国家药品监督管理局注册,可及性差。
配方漱口水在使用过程中要注意每天的使用频次等,这可能影响或决定临床效果。2017 年 Cochrane Database 发表的研究表明,GM-CSF 的总剂量、使用频率、漱口时间可能与其治疗黏膜炎疗效正相关 [83]。GM-CSF 含漱时,推荐将 400 μg 溶于 100 mL 无菌水中配置配方漱口水,含漱>4 次/d;餐后及睡前 30 min 用清水清洁口腔后含漱,25 mL/次,含漱>5 min/次,建议吞服以缓解咽喉部黏膜炎症状,含漱后 1 h 内不进食和饮水,漱口水 2~8 ℃ 温度下避光保存;出现Ⅰ度口腔黏膜炎时即黏膜出现红斑时开始用药至放疗结束或患者黏膜炎恢复正常后停药 [84]。
专家建议:推荐 GM-CSF 等用于预防和治疗头颈部放疗±化疗引起的黏膜炎。
8.1.2 非甾体类抗炎药 盐酸苄达明漱口水能抑制炎症细胞因子 TNF-α 和 IL-1β 的产生 [47, 85]。Epstein 等 [47, 86] 一项包含 173 例头颈部肿瘤放射治疗患者的随机、双盲、对照研究显示,与对照组相比,盐酸苄达明组能减少 30% 的黏膜红斑和溃疡的发生,延迟了镇痛药的使用,但盐酸苄达明可能对加速超分割放疗无效(≥ 2.20 Gy/d)。需要注意非甾体类抗炎药在患者血小板低,有出血风险时应慎用,以防血小板进一步降低导致患者出血。
专家建议:推荐盐酸苄达明漱口水用于预防接受中等剂量放疗(<50 Gy)的头颈部肿瘤患者的口腔黏膜炎。推荐使用盐酸苄达明漱口水预防接受同步放化疗的头颈部肿瘤患者的口腔黏膜炎。
8.1.3 光生物调节疗法 利用低水平能量刺激生物反应的激光和光治疗黏膜炎近年来迅速发展,被称为光生物调节 (Photobiomodulation,PBM) 疗法。一项前瞻性随机、双盲对照研究纳入老年头颈部肿瘤放疗患者,随机分为低能量激光治疗(Low‐level laser therapy,LLLT)组和对照组,结果显示 LLLT 组比安慰剂组显著减少了 SOM 的发生率和持续时间(P = 0.016),减少了患者阿.片类镇痛药物的使用等 [2, 87]。低能量激光治疗在治疗过程中可能有烧灼感,对口腔黏膜炎有效,尚缺乏咽喉黏膜炎相关数据。
专家建议:建议特定波长的低能量激光治疗用于头颈部肿瘤放疗±化疗的口腔黏膜炎的预防。对于口腔部肿瘤患者需要慎用。
8.1.4 口腔定位支架 口腔定位支架理论上可根据放射计划撑开上下颌骨,压低或推开舌体,降低正常口腔组织的受照射剂量,从而减轻口腔并发症 [88, 89]。但仍然需要更高质量、样本量、更长时间的随访数据加以验证 [88]。
专家建议:口腔定位支架在头颈部放疗中对口腔正常组织有一定的保护作用,条件允许的情况下使用口腔定位支架。
8.1.5 冷冻治疗 冷冻治疗会使局部毛细血管收缩,从而限制细胞毒性药物的局部血药浓度,减少化疗药物对黏膜的损害。但一项随机对照研究显示,在接受放疗的头颈部肿瘤患者中行冷冻治疗并不能改善患者口腔黏膜炎的症状,且治疗组的患者对黏膜炎的疼痛感觉更敏感 [90, 91],可能增加放疗患者不良反应。
专家建议:不推荐冷冻治疗用于预防和治疗头颈部肿瘤放疗患者的口腔黏膜炎。
8.1.6 镇痛剂 黏膜炎患者在受到外界刺激,如进食、吞咽口水时会产生疼痛感,要与持续的癌痛区分。这种由外界特定条件触发的疼痛不良反应使用非甾体类抗炎药物效果较差。
轻度疼痛时,推荐使用利多卡因、吗啡等漱口水,或者使用 0.5%~1% 普鲁卡因溶液、利多卡因凝胶或苯佐卡因糊剂,喷涂于溃疡处 [92]。有研究证实,2% 吗啡漱口水能有效控制黏膜炎相关疼痛,减少全身性吗啡用量 [14]。重度疼痛时,推荐全身使用吗啡、奥施康定、芬太尼等强阿.片类药物 [47, 92]。当需要使用全身镇痛剂时,应考虑最佳的给药途径及剂量,如皮下、肌肉注射、静脉注射或透皮贴剂等 [2]。
专家建议:推荐局部使用 0.2% 的吗啡漱口水等治疗接受同步放化疗的头颈肿瘤患者的口腔黏膜炎相关的疼痛。
8.1.7 黏膜保护剂 目前临床使用的黏膜保护剂,主要有口腔凝胶、自由基清除剂、必需氨基酸及过饱和钙磷酸盐等 [2]。2014 年,Hadjieva 等 [93] 报道一项多中心、随机双盲、安慰剂对照的临床研究,表明采用口腔凝胶(CAM2028)可显著降低头颈肿瘤放疗引起的黏膜炎的疼痛。研究表明,硫糖铝制剂对预防和治疗头颈部肿瘤放疗患者口腔黏膜炎无效 [94-97]。
专家建议:不推荐硫糖铝(局部和全身用药)来预防和治疗接受放疗的头颈肿瘤患者的口腔黏膜炎相关疼痛。建议口腔凝胶(CAM2028)治疗头颈部肿瘤放射治疗相关口腔黏膜炎相关疼痛。
8.1.8 中药制剂 中药制剂在预防黏膜炎、促进溃疡面愈合等方面积累了一定经验,如康复新液、双花百合片、云南白药等在头颈部肿瘤的放射治疗的研究表明,中药制剂可能在一定程度上降低黏膜炎的严重程度并缓解疼痛 [98-101]。康莱特是从中药薏苡仁中提取的有效成分,对放疗、化疗有增效、减毒作用。近期的一项Ⅱ期临床研究显示,其在头颈部肿瘤放疗同步±顺铂单药期间无Ⅴ度黏膜炎发生,Ⅲ度黏膜炎发生率总体为 10.09%[102]。期待更多的理论和临床证据指导临床用药。
专家建议:建议合理使用中药制剂治疗接受放疗的头颈肿瘤患者的黏膜炎。
8.1.9 天然药物及其他 国外局部或含服蜂蜜应用于接受放疗或同步放化疗的头颈部肿瘤患者的研究数据表明,蜂蜜可能预防和缓解放疗所致 2~4 级黏膜炎,蜂蜜还可能在一定程度上缓解严重疼痛,但其作用机制尚不明确 [103, 104]。国内的临床应用经验尚少,蜂蜜质量可能直接影响临床效果,如文献报道纯净天然蜂蜜有效,但麦卢卡蜂蜜可能无效 [103]。
专家建议:建议接受放疗或同步放化疗治疗的头颈肿瘤患者口服蜂蜜来预防口腔和咽喉部黏膜炎的发生。
8.2 咽喉部黏膜炎
咽喉部黏膜炎的治疗效果与口腔黏膜炎相比不佳 [105, 106]。由于局部用药较难深入咽喉部,临床用药需要关注局部用药方式和方法,如采用雾化吸入或吞服的方式以便药物深达咽喉部。例如一项放射治疗头颈部肿瘤患者的初步研究表明,含服蜂蜜能够降低口腔黏膜炎和咽部黏膜炎严重程度 [104]。这可能与蜂蜜具有较高黏膜粘附能力,与咽喉部黏膜接触较长时间有关,为临床治疗头颈部放射相关咽喉炎的给药方式和方法提供了借鉴。
全身给药可能对咽喉部黏膜炎能起到一定作用。一项旨在评估皮下注射 GM-CSF 治疗头颈放疗引起的口腔和咽部黏膜炎的随机对照临床研究显示,在随机接受皮下注射 4 µg/(kg·d)GM-CSF 的患者中,有 45% 的患者黏膜炎明显减少了>1 个等级(WHO 分级),而接受常规治疗的患者只有 9%[107]。肿瘤控制率没有差异,皮下注射 GM-CSF 可以减少接受放疗患者黏膜炎的严重程度,皮下注射的耐受性良好 [108]。
9 黏膜炎并发症的处理
黏膜炎并发症的具体治疗参照各有关指南和共识,以下仅作参考。
9.1 疼痛的管理
使用非甾体类解热镇痛抗炎药,包括扑热息痛(片剂应溶于水,在吞咽前用作漱口水)。扑热息痛可能会掩盖患者体温。有出血和肾损害的患者不推荐使用非甾体类解热镇痛抗炎药 [109]。
考虑苄达明冲洗口腔,勿吞服。因药物的刺激,在接受头颈部放射治疗的患者和任何患有 SOM 的患者中可能耐受性较差。可能需要使用更强的镇痛剂,如果患者黏膜炎疼痛持续,考虑进一步使用阿.片类镇痛药,如透皮贴剂等,但应严格限制处方。
9.2 出血
如果有相关的口腔出血,考虑使用氨甲环酸注射或片剂。每 4~6 h 用漱口水治疗局部出血。密切监视抗凝治疗或血小板减少的患者。
9.3 口干
鼓励患者多喝水,保持机体充分水化。可使用润唇膏保持嘴唇湿润,慢性放疗相关口干症可考虑毛果芸香碱。
9.4 张口困难
是手术或头颈部大剂量放疗期间和放疗后常见的毒副作用。患者应该行有益的锻炼,考虑口腔定位支架,在头颈部放疗中对口腔正常组织有一定的保护作用。
9.5 感染的预防和治疗
头颈部肿瘤患者在已知有明确感染风险因素时需要预防感染。对接受大剂量类固醇(相当于 15 mg/d 强的松龙或更高剂量强的松龙,至少 1 周)的患者应给予抗真菌预防。具体可参见癌症相关感染的预防和治疗相关指南 [110]。
10 治疗后护理和随访
在常规单纯化疗后,大多数黏膜炎很快愈合,不需要额外的随访。在头颈部放疗±化疗环境下,口腔黏膜炎损伤需要几周甚至数月才能愈合 [47]。患者在此期间需要持续的护理支持。建议对患者进行随访管理,阿.片类镇痛药物的阶梯停药非常重要。
放疗的迟发性不良反应,尤其是龋齿、放射性骨坏死、张口困难、纤维化、淋巴水肿、慢性口干和慢性疼痛需要谨慎处理。所有患者都应进行独立评估,并给予适当的护理和治疗。
接受双膦酸盐治疗的患者面临与药物相关的颌骨坏死风险,这将需要肿瘤科和牙科团队与患者合作,以最大限度地降低风险和进一步损害,并仔细调整和监控治疗计划,特别是放疗的患者,应计划和监督后续护理措施,以解决长期和迟发并发症。
11 新冠肺炎疫情大流行时的防治建议
头颈放疗患者在新冠等流行性疫情大流行时应加强自我防护,减少聚集,切断疫情传播风险,加强自我口腔评估,主动学习口腔护理知识,发现黏膜炎问题及时与主治医师沟通反馈 [111]。
结语
头颈部肿瘤放射治疗相关黏膜炎的预防和治疗需要多学科专家的参与,制定本指南的目的是总结现阶段的临床经验,归纳其可行的诊断、预防和治疗方案,针对放射性咽喉等部位黏膜炎的治疗需求不容忽视,治疗的目的主要是减轻患者症状,减少Ⅲ~Ⅳ度黏膜炎的发生。现有针对头颈部肿瘤放射治疗相关黏膜炎的临床研究缺乏大规模随机对照临床研究,一些预防和策略需要注重患者的个体化治疗需求。本指南中提出的原则旨在作为支持和参考,不应取代与特定患者和临床情况相关的临床决策。因编委水平有限,不当之处敬请批评指正。
审阅专家:
高献书 北京大学第一医院 高义军 中南大学湘雅二医院
胡超苏 复旦大学附属肿瘤医院 李宝生 山东省肿瘤医院
袁双虎 山东省肿瘤医院
执笔专家:
陈传本 福建省肿瘤医院 陈晓钟 中国科学院大学附属肿瘤医院
何 侠 江苏省肿瘤医院 胡 漫 山东省肿瘤医院
王孝深 复旦大学附属眼耳鼻喉科医院 杨坤禹 华中科技大学同济医学院附属协和医院
朱小东 广西医科大学附属武鸣医院
成员专家:
冯 梅 四川省肿瘤医院 高力英 甘肃省肿瘤医院
韩亚骞 湖南省肿瘤医院 金 风 贵州医科大学附属医院
李 光 中国医科大学附属第一医院 李 杰 山西省肿瘤医院
刘安文 南昌大学第二附属医院 刘秋芳 陕西省肿瘤医院
麦海强 中山大学肿瘤防治中心 乔 俏 中国医科大学附属第一医院
任 娟 西安交通大学第一附属医院 王 军 河北医科大学第四医院
王 颖 重庆大学附属肿瘤医院 王佩国 天津医科大学肿瘤医院
王若峥 新疆医科大学附属肿瘤医院 吴 慧 河南省肿瘤医院
肖绍文 北京大学肿瘤医院 张大昕 哈尔滨医科大学附属第一医院
参考文献
[1] ROSENTHAL D I, TROTTI A. Strategies for managing radiation-induced mucositis in head and neck cancer [J]. Semin Radiat Oncol, 2009, 19(1): 29-34.
[2] 中国临床肿瘤学会抗肿瘤药物安全管理专家委员会, 中国临床肿瘤学会肿瘤支持与康复治疗专家委员会, 秦叔逵, et al. 抗肿瘤治疗引起急性口腔黏膜炎的诊断和防治专家共识 [J]. 临床肿瘤学杂志, 2021, 26(5): 11.
[3] RUSSI E G, RABER-DURLACHER J E, SONIS S T. Local and systemic pathogenesis and consequences of regimen-induced inflammatory responses in patients with head and neck cancer receiving chemoradiation [J]. Mediators Inflamm, 2014, 2014: 518261.
[4] 井旺, 朱慧, 胡漫, et al. 急性放射性黏膜炎治疗现状 [J]. 中华放射医学与防护杂志, 2015, 35(003): 233-6.
[5] SROUSSI H Y, EPSTEIN J B, BENSADOUN R J, et al. Common oral complications of head and neck cancer radiation therapy: mucositis, infections, saliva change, fibrosis, sensory dysfunctions, dental caries, periodontal disease, and osteoradionecrosis [J]. Cancer Med, 2017, 6(12): 2918-31.
[6] 舒泽凯, 王佰魁, 王磊, et al. 头颈部放疗期间口腔细菌菌群变化及其与放射性口腔黏膜炎相关性研究 [J]. 中华放射肿瘤学杂志, 2021, 30(7): 6.
[7] AL-DASOOQI N, SONIS S T, BOWEN J M, et al. Emerging evidence on the pathobiology of mucositis [J]. Support Care Cancer, 2013, 21(7): 2075-83.
[8] SONIS S T. The pathobiology of mucositis [J]. Nat Rev Cancer, 2004, 4(4): 277-84.
[9] BROWN T J, GUPTA A. Management of Cancer Therapy-Associated Oral Mucositis [J]. JCO Oncol Pract, 2020, 16(3): 103-9.
[10] KöSTLER W J, HEJNA M, WENZEL C, et al. Oral mucositis complicating chemotherapy and/or radiotherapy: options for prevention and treatment [J]. CA Cancer J Clin, 2001, 51(5): 290-315.
[11] ROSE-PED A M, BELLM L A, EPSTEIN J B, et al. Complications of radiation therapy for head and neck cancers. The patient's perspective [J]. Cancer Nurs, 2002, 25(6): 461-7; quiz 8-9.
[12] TROTTI A, BELLM L A, EPSTEIN J B, et al. Mucositis incidence, severity and associated outcomes in patients with head and neck cancer receiving radiotherapy with or without chemotherapy: a systematic literature review [J]. Radiother Oncol, 2003, 66(3): 253-62.
[13] SONIS S T, ELTING L S, KEEFE D, et al. Perspectives on cancer therapy-induced mucosal injury: pathogenesis, measurement, epidemiology, and consequences for patients [J]. Cancer, 2004, 100(9 Suppl): 1995-2025.
[14] PETERSON D E, BOERS-DOETS C B, BENSADOUN R J, et al. Management of oral and gastrointestinal mucosal injury: ESMO Clinical Practice Guidelines for diagnosis, treatment, and follow-up [J]. Ann Oncol, 2015, 26 Suppl 5: v139-51.
[15] SANGTHAWAN D, PHUNGRASSAMI T, SINKITJARURNCHAI W. A randomized double-blind, placebo-controlled trial of zinc sulfate supplementation for alleviation of radiation-induced oral mucositis and pharyngitis in head and neck cancer patients [J]. J Med Assoc Thai, 2013, 96(1): 69-76.
[16] 袁平, 洪荣涛, 郑奎城, et al. 头颈部肿瘤患者营养指标与放疗急性毒性反应相关分析 [J]. 卫生研究, 2011, 40(6): 4.
[17] BHIDE S A, GULLIFORD S, SCHICK U, et al. Dose-response analysis of acute oral mucositis and pharyngeal dysphagia in patients receiving induction chemotherapy followed by concomitant chemo-IMRT for head and neck cancer [J]. Radiother Oncol, 2012, 103(1): 88-91.
[18] SHANKAR A, ROY S, BHANDARI M, et al. Current Trends in Management of Oral Mucositis in Cancer Treatment [J]. Asian Pac J Cancer Prev, 2017, 18(8): 2019-26.
[19] EILERS J, MILLION R. Clinical update: prevention and management of oral mucositis in patients with cancer [J]. Semin Oncol Nurs, 2011, 27(4): e1-16.
[20] MCGUIRE D B. Mucosal tissue injury in cancer therapy. More than muscositis and mouthwash [J]. Cancer Pract, 2002, 10(4): 179-91.
[21] BARASCH A, PETERSON D E. Risk factors for ulcerative oral mucositis in cancer patients: unanswered questions [J]. Oral Oncol, 2003, 39(2): 91-100.
[22] AVRITSCHER E B, COOKSLEY C D, ELTING L S. Scope and epidemiology of cancer therapy-induced oral and gastrointestinal mucositis [J]. Semin Oncol Nurs, 2004, 20(1): 3-10.
[23] BERGER A M, EILERS J. Factors influencing oral cavity status during high-dose antineoplastic therapy: a secondary data analysis [J]. Oncol Nurs Forum, 1998, 25(9): 1623-6.
[24] POROCK D, NIKOLETTI S, CAMERON F. The relationship between factors that impair wound healing and the severity of acute radiation skin and mucosal toxicities in head and neck cancer [J]. Cancer Nurs, 2004, 27(1): 71-8.
[25] KLEINBERG L, GROSSMAN S A, PIANTADOSI S, et al. Phase I trial to determine the safety, pharmacodynamics, and pharmacokinetics of RSR13, a novel radioenhancer, in newly diagnosed glioblastoma multiforme [J]. J Clin Oncol, 1999, 17(8): 2593-603.
[26] VOKURKA S, BYSTRICKá E, KOZA V, et al. Higher incidence of chemotherapy induced oral mucositis in females: a supplement of multivariate analysis to a randomized multicentre study [J]. Support Care Cancer, 2006, 14(9): 974-6.
[27] SAITO N, IMAI Y, MUTO T, et al. Low body mass index as a risk factor of moderate to severe oral mucositis in oral cancer patients with radiotherapy [J]. Support Care Cancer, 2012, 20(12): 3373-7.
[28] HSIUNG C Y, TING H M, HUANG H Y, et al. Parotid-sparing intensity-modulated radiotherapy (IMRT) for nasopharyngeal carcinoma: preserved parotid function after IMRT on quantitative salivary scintigraphy, and comparison with historical data after conventional radiotherapy [J]. Int J Radiat Oncol Biol Phys, 2006, 66(2): 454-61.
[29] ROMESSER P B, CAHLON O, SCHER E D, et al. Proton Beam Reirradiation for Recurrent Head and Neck Cancer: Multi-institutional Report on Feasibility and Early Outcomes [J]. Int J Radiat Oncol Biol Phys, 2016, 95(1): 386-95.
[30] ROMESSER P B, CAHLON O, SCHER E, et al. Proton beam radiation therapy results in significantly reduced toxicity compared with intensity-modulated radiation therapy for head and neck tumors that require ipsilateral radiation [J]. Radiother Oncol, 2016, 118(2): 286-92.
[31] BOURHIS J, LAPEYRE M, TORTOCHAUX J, et al. Phase III randomized trial of very accelerated radiation therapy compared with conventional radiation therapy in squamous cell head and neck cancer: a GORTEC trial [J]. J Clin Oncol, 2006, 24(18): 2873-8.
[32] FU K K, PAJAK T F, TROTTI A, et al. A Radiation Therapy Oncology Group (RTOG) phase III randomized study to compare hyperfractionation and two variants of accelerated fractionation to standard fractionation radiotherapy for head and neck squamous cell carcinomas: first report of RTOG 9003 [J]. Int J Radiat Oncol Biol Phys, 2000, 48(1): 7-16.
[33] XU T, LIU Y, DOU S, et al. Weekly cetuximab concurrent with IMRT aggravated radiation-induced oral mucositis in locally advanced nasopharyngeal carcinoma: Results of a randomized phase II study [J]. Oral Oncol, 2015, 51(9): 875-9.
[34] MALLICK S, BENSON R, RATH G K. Radiation induced oral mucositis: a review of current literature on prevention and management [J]. European archives of oto-rhino-laryngology : official journal of the European Federation of Oto-Rhino-Laryngological Societies (EUFOS) : affiliated with the German Society for Oto-Rhino-Laryngology - Head and Neck Surgery, 2016, 273(9): 2285-93.
[35] GUPTA T, KANNAN S, GHOSH-LASKAR S, et al. Systematic Review and Meta-analysis of Conventionally Fractionated Concurrent Chemoradiotherapy versus Altered Fractionation Radiotherapy Alone in the Definitive Management of Locoregionally Advanced Head and Neck Squamous Cell Carcinoma [J]. Clin Oncol (R Coll Radiol), 2016, 28(1): 50-61.
[36] NARAYAN S, LEHMANN J, COLEMAN M A, et al. Prospective evaluation to establish a dose response for clinical oral mucositis in patients undergoing head-and-neck conformal radiotherapy [J]. Int J Radiat Oncol Biol Phys, 2008, 72(3): 756-62.
[37] WANG Z H, ZHANG S Z, ZHANG Z Y, et al. Protecting the oral mucosa in patients with oral tongue squamous cell carcinoma treated postoperatively with intensity-modulated radiotherapy: a randomized study [J]. Laryngoscope, 2012, 122(2): 291-8.
[38] KHUNTIA D, HARRIS J, BENTZEN S M, et al. Increased Oral Mucositis after IMRT versus Non-IMRT when Combined with Cetuximab and Cisplatin or Docetaxel for Head and Neck Cancer: Preliminary Results of RTOG 0234 [J]. International journal of radiation oncology, biology, physics, 2008, 72(1-supp-S): S33-S.
[39] CALAIS G, ALFONSI M, BARDET E, et al. Randomized trial of radiation therapy versus concomitant chemotherapy and radiation therapy for advanced-stage oropharynx carcinoma [J]. J Natl Cancer Inst, 1999, 91(24): 2081-6.
[40] FORASTIERE A A, GOEPFERT H, MAOR M, et al. Concurrent chemotherapy and radiotherapy for organ preservation in advanced laryngeal cancer [J]. N Engl J Med, 2003, 349(22): 2091-8.
[41] COOPER J S, PAJAK T F, FORASTIERE A A, et al. Postoperative concurrent radiotherapy and chemotherapy for high-risk squamous-cell carcinoma of the head and neck [J]. N Engl J Med, 2004, 350(19): 1937-44.
[42] BERNIER J, DOMENGE C, OZSAHIN M, et al. Postoperative irradiation with or without concomitant chemotherapy for locally advanced head and neck cancer [J]. N Engl J Med, 2004, 350(19): 1945-52.
[43] XU C, ZHANG L H, CHEN Y P, et al. Chemoradiotherapy Versus Radiotherapy Alone in Stage II Nasopharyngeal Carcinoma: A Systemic Review and Meta-analysis of 2138 Patients [J]. J Cancer, 2017, 8(2): 287-97.
[44] BLANCHARD P, LEE A, MARGUET S, et al. Chemotherapy and radiotherapy in nasopharyngeal carcinoma: an update of the MAC-NPC meta-analysis [J]. Lancet Oncol, 2015, 16(6): 645-55.
[45] CHEN L, HU C S, CHEN X Z, et al. Concurrent chemoradiotherapy plus adjuvant chemotherapy versus concurrent chemoradiotherapy alone in patients with locoregionally advanced nasopharyngeal carcinoma: a phase 3 multicentre randomised controlled trial [J]. Lancet Oncol, 2012, 13(2): 163-71.
[46] LI Y, CHEN Q Y, TANG L Q, et al. Concurrent chemoradiotherapy with or without cetuximab for stage II to IVb nasopharyngeal carcinoma: a case-control study [J]. BMC Cancer, 2017, 17(1): 567.
[47] 中华医学会放射肿瘤治疗学分会. 放射性口腔黏膜炎防治策略专家共识 (2019) [J]. 中华放射肿瘤学杂志, 2019, 28(9): 641-7.
[48] STOKMAN M A, SPIJKERVET F K, BURLAGE F R, et al. Oral mucositis and selective elimination of oral flora in head and neck cancer patients receiving radiotherapy: a double-blind randomised clinical trial [J]. Br J Cancer, 2003, 88(7): 1012-6.
[49] SANGUINETI G, ENDRES E J, GUNN B G, et al. Is there a "mucosa-sparing" benefit of IMRT for head-and-neck cancer? [J]. Int J Radiat Oncol Biol Phys, 2006, 66(3): 931-8.
[50] ROSENTHAL D I, CHAMBERS M S, FULLER C D, et al. Beam path toxicities to non-target structures during intensity-modulated radiation therapy for head and neck cancer [J]. Int J Radiat Oncol Biol Phys, 2008, 72(3): 747-55.
[51] KRUSER T J, RICE S R, CLEARY K P, et al. Acute hematologic and mucosal toxicities in head and neck cancer patients undergoing chemoradiotherapy: a comparison of 3D-CRT, IMRT, and helical tomotherapy [J]. Technology in cancer research & treatment, 2013, 12(5): 383-9.
[52] SABATINI M E, CHIOCCA S. Human papillomavirus as a driver of head and neck cancers [J]. Br J Cancer, 2020, 122(3): 306-14.
[53] SERVICES U D O H A H. Common Terminology Criteria for Adverse Events (CTCAE) Version 5.0 [J]. https://ctepcancergov/protocoldevelopment/electronic_applications/docs/ctcae_v5_quick_reference_5x7pdf, 2017.
[54] COX J D, STETZ J, PAJAK T F. Toxicity criteria of the Radiation Therapy Oncology Group (RTOG) and the European Organization for Research and Treatment of Cancer (EORTC) [J]. Int J Radiat Oncol Biol Phys, 1995, 31(5): 1341-6.
[55] SONIS S T, EILERS J P, EPSTEIN J B, et al. Validation of a new scoring system for the assessment of clinical trial research of oral mucositis induced by radiation or chemotherapy. Mucositis Study Group [J]. Cancer, 1999, 85(10): 2103-13.
[56] QUINN B, POTTING C M, STONE R, et al. Guidelines for the assessment of oral mucositis in adult chemotherapy, radiotherapy and haematopoietic stem cell transplant patients [J]. Eur J Cancer, 2008, 44(1): 61-72.
[57] ELAD S, RABER-DURLACHER J E, BRENNAN M T, et al. Basic oral care for hematology-oncology patients and hematopoietic stem cell transplantation recipients: a position paper from the joint task force of the Multinational Association of Supportive Care in Cancer/International Society of Oral Oncology (MASCC/ISOO) and the European Society for Blood and Marrow Transplantation (EBMT) [J]. Support Care Cancer, 2015, 23(1): 223-36.
[58] HUBENAK J R, ZHANG Q, BRANCH C D, et al. Mechanisms of injury to normal tissue after radiotherapy: a review [J]. Plastic and reconstructive surgery, 2014, 133(1): 49e-56e.
[59] RABER-DURLACHER J E, ELAD S, BARASCH A. Oral mucositis [J]. Oral Oncol, 2010, 46(6): 452-6.
[60] WYGODA A, MACIEJEWSKI B, SKLADOWSKI K, et al. Pattern analysis of acute mucosal reactions in patients with head and neck cancer treated with conventional and accelerated irradiation [J]. Int J Radiat Oncol Biol Phys, 2009, 73(2): 384-90.
[61] 秦晓萌, 贾灵芝, 王蒙蒙, et al. 中国人群癌症放化疗并发口腔黏膜炎危险因素Meta分析 [J]. 中华肿瘤防治杂志, 2018, 25(14): 7.
[62] 罗霞. 优质护理在改善头颈部肿瘤放疗患者口腔黏膜炎中的效果分析 [J]. 中华肿瘤防治杂志, 2018, (S1): 2.
[63] HONG C H L, GUEIROS L A, FULTON J S, et al. Systematic review of basic oral care for the management of oral mucositis in cancer patients and clinical practice guidelines [J]. Support Care Cancer, 2019, 27(10): 3949-67.
[64] JAGASIA M H, GREINIX H T, ARORA M, et al. National Institutes of Health Consensus Development Project on Criteria for Clinical Trials in Chronic Graft-versus-Host Disease: I. The 2014 Diagnosis and Staging Working Group report [J]. Biol Blood Marrow Transplant, 2015, 21(3): 389-401 e1.
[65] DAVIES G M, DAVIES R M. Delivering better oral health--an evidence-based toolkit for prevention: a review [J]. Dent Update, 2008, 35(7): 460-2, 4.
[66] PETERSON J, ADLARD K, WALTI B I, et al. Clinical Nurse Specialist Collaboration to Recognize, Prevent, and Treat Pediatric Pressure Ulcers [J]. Clin Nurse Spec, 2015, 29(5): 276-82.
[67] 张京华, 沙月琴, 曹采方. 不同刷牙方法清除菌斑效果的对比 [J]. 北京大学学报:医学版, 2005, 37(5): 3.
[68] NEWBRUN E. Topical fluorides in caries prevention and management: a North American perspective [J]. Journal of dental education, 2001, 65(10): 1078-83.
[69] SAMBUNJAK D, NICKERSON J W, POKLEPOVIC T, et al. Flossing for the management of periodontal diseases and dental caries in adults [J]. Cochrane Database Syst Rev, 2011, 7(12): Cd008829.
[70] POKLEPOVIC T, WORTHINGTON H V, JOHNSON T M, et al. Interdental brushing for the prevention and control of periodontal diseases and dental caries in adults [J]. Cochrane Database Syst Rev, 2013, 18(12): Cd009857.
[71] LI E, TROVATO J A. New developments in management of oral mucositis in patients with head and neck cancer or receiving targeted anticancer therapies [J]. American journal of health-system pharmacy : AJHP : official journal of the American Society of Health-System Pharmacists, 2012, 69(12): 1031-7.
[72] DUYCK J, VANDAMME K, MULLER P, et al. Overnight storage of removable dentures in alkaline peroxide-based tablets affects biofilm mass and composition [J]. Journal of dentistry, 2013, 41(12): 1281-9.
[73] ELAD S, CHENG K K F, LALLA R V, et al. MASCC/ISOO clinical practice guidelines for the management of mucositis secondary to cancer therapy [J]. Cancer, 2020, 126(19): 4423-31.
[74] ELAD S, JENSEN S B, RABER-DURLACHER J E, et al. Clinical approach in the management of oral chronic graft-versus-host disease (cGVHD) in a series of specialized medical centers [J]. Support Care Cancer, 2015, 23(6): 1615-22.
[75] MCGUIRE D B, FULTON J S, PARK J, et al. Systematic review of basic oral care for the management of oral mucositis in cancer patients [J]. Support Care Cancer, 2013, 21(11): 3165-77.
[76] CHEN A M, CHEN L M, VAUGHAN A, et al. Tobacco smoking during radiation therapy for head-and-neck cancer is associated with unfavorable outcome [J]. Int J Radiat Oncol Biol Phys, 2011, 79(2): 414-9.
[77] 李卫阳, 朱丽婵, 谢淑萍, et al. 微信公众平台宣教对鼻咽癌放疗不良反应改善效果观察 [J]. 中国乡村医药, 2018, 25(9): 2.
[78] 胡婉梅, 牟庆云, 田继书, et al. rhGM-CSF雾化吸入及漱口治疗急性白血病病人化疗所致口腔炎的疗效观察 [J]. 护理研究:中旬版, 2016, 30(3): 3.
[79] 韩亚骞, 张姗姗, 吴湘玮, et al. 含rhGM-CSF漱口液治疗放射性口腔黏膜炎的前瞻性随机对照研究 [J]. 肿瘤, 2014, 34(1): 6.
[80] SAARILAHTI K, KAJANTI M, JOENSUU T, et al. Comparison of granulocyte-macrophage colony-stimulating factor and sucralfate mouthwashes in the prevention of radiation-induced mucositis: a double-blind prospective randomized phase III study [J]. Int J Radiat Oncol Biol Phys, 2002, 54(2): 479-85.
[81] WU H G, SONG S Y, KIM Y S, et al. Therapeutic effect of recombinant human epidermal growth factor (RhEGF) on mucositis in patients undergoing radiotherapy, with or without chemotherapy, for head and neck cancer: a double-blind placebo-controlled prospective phase 2 multi-institutional clinical trial [J]. Cancer, 2009, 115(16): 3699-708.
[82] LE Q T, KIM H E, SCHNEIDER C J, et al. Palifermin reduces severe mucositis in definitive chemoradiotherapy of locally advanced head and neck cancer: a randomized, placebo-controlled study [J]. J Clin Oncol, 2011, 29(20): 2808-14.
[83] RILEY P, GLENNY A M, WORTHINGTON H V, et al. Interventions for preventing oral mucositis in patients with cancer receiving treatment: cytokines and growth factors [J]. Cochrane Database Syst Rev, 2017, 11(11): Cd011990.
[84] 吴尘轩. 肿瘤化疗联合粒细胞-巨噬细胞刺激因子的辅助治疗 [J]. 癌症进展, 2012, 10(2): 4.
[85] SIRONI M, MILANESE C, VECCHI A, et al. Benzydamine inhibits the release of tumor necrosis factor-alpha and monocyte chemotactic protein-1 by Candida albicans-stimulated human peripheral blood cells [J]. Int J Clin Lab Res, 1997, 27(2): 118-22.
[86] EPSTEIN J B, SILVERMAN S, JR., PAGGIARINO D A, et al. Benzydamine HCl for prophylaxis of radiation-induced oral mucositis: results from a multicenter, randomized, double-blind, placebo-controlled clinical trial [J]. Cancer, 2001, 92(4): 875-85.
[87] GAUTAM A P, FERNANDES D J, VIDYASAGAR M S, et al. Low level laser therapy against radiation induced oral mucositis in elderly head and neck cancer patients-a randomized placebo controlled trial [J]. Journal of photochemistry and photobiology B, Biology, 2015, 144: 51-6.
[88] 蒋钰雅, 李阳, 闫婧, et al. 口腔定位支架预防头颈部放疗患者口腔并发症作用的Meta分析 [J]. 中国实用口腔科杂志, 2021, 14(5): 5.
[89] 秦文娟, 罗伟, 林仕荣, et al. 个体化口腔支架在鼻咽癌患者放疗中对口腔正常组织的保护作用 [J]. 癌症, 2007, 26(3): 5.
[90] PARK S H, LEE H S. Meta-analysis of oral cryotherapy in preventing oral mucositis associated with cancer therapy [J]. Int J Nurs Pract, 2019, 25(5): e12759.
[91] KAKOEI S, GHASSEMI A, NAKHAEE N J I J O R R. Effect of cryotherapy on oral mucositis in patients with head and neck cancers receiving radiotherapy [J]. International Journal of Radiation Research, 2013, 11(2): 117-20.
[92] 胡洁, 林丽珠, 骆肖群, et al. EGFR-TKI不良反应管理专家共识 [J]. 中国肺癌杂志, 2019, 2(2): 25.
[93] HADJIEVA T, CAVALLIN-STåHL E, LINDEN M, et al. Treatment of oral mucositis pain following radiation therapy for head-and-neck cancer using a bioadhesive barrier-forming lipid solution [J]. Support Care Cancer, 2014, 22(6): 1557-62.
[94] KOH W J, STELZER K J, PETERSON L M, et al. Effect of pentoxifylline on radiation-induced lung and skin toxicity in rats [J]. Int J Radiat Oncol Biol Phys, 1995, 31(1): 71-7.
[95] EPSTEIN J B, WONG F L. The efficacy of sucralfate suspension in the prevention of oral mucositis due to radiation therapy [J]. Int J Radiat Oncol Biol Phys, 1994, 28(3): 693-8.
[96] EVENSEN J F, BJORDAL K, JACOBSEN A B, et al. Effects of Na-sucrose octasulfate on skin and mucosa reactions during radiotherapy of head and neck cancers--a randomized prospective study [J]. Acta Oncol, 2001, 40(6): 751-5.
[97] CARTER D L, HEBERT M E, SMINK K, et al. Double blind randomized trial of sucralfate vs placebo during radical radiotherapy for head and neck cancers [J]. Head Neck, 1999, 21(8): 760-6.
[98] 白洪芳, 江庆华, 曾万琴, et al. 康复新液预防与治疗鼻咽癌放疗所致口腔黏膜炎的效果观察 [J]. 肿瘤预防与治疗, 2017, 30(1): 6.
[99] 郑璐, 张福正. 双花百合片防治头颈部肿瘤患者放疗后口腔溃疡的临床疗效观察 [J]. 中国肿瘤临床与康复, 2015, (2): 3.
[100] 韩鹏炳, 李瑾, 冀雪娟, et al. 加味冰硼散联合云南白药对放射性口腔黏膜炎患者的疗效 [J]. 中国医学物理学杂志, 2019, 36(4): 4.
[101] 黄架旗, 张娣, 胡漫, et al. 血必净注射液防治鼻咽癌急性放射性口腔黏膜炎临床观察 [J]. 中华肿瘤防治杂志, 2019, 26(21): 5.
[102] LIU ZP S Q, CHU CL. Efficacy of Kanglaite against radiotherapy-induced mucositis in head and neck cancer, a phase II trial [J]. Cancer Radiotherapie, 2022, Pre-Print Online.
[103] YANG C, GONG G, JIN E, et al. Topical application of honey in the management of chemo/radiotherapy-induced oral mucositis: A systematic review and network meta-analysis [J]. International journal of nursing studies, 2019, 89: 80-7.
[104] BISWAL B M, ZAKARIA A, AHMAD N M. Topical application of honey in the management of radiation mucositis: a preliminary study [J]. Support Care Cancer, 2003, 11(4): 242-8.
[105] MOSALAEI A, NASROLAHI H, SHAFIZAD A, et al. Effect of oral zinc sulphate in prevention of radiation induced oropharyngeal mucositis during and after radiotherapy in patients with head and neck cancers [J]. Middle East Journal of Cancer, 2010, 1(2): 69-76.
[106] WONG K H, KUCIEJEWSKA A, SHARABIANI M T A, et al. A randomised controlled trial of Caphosol mouthwash in management of radiation-induced mucositis in head and neck cancer [J]. Radiother Oncol, 2017, 122(2): 207-11.
[107] MASUCCI G, BROMAN P, KELLY C, et al. Therapeutic efficacy by recombinant human granulocyte/monocyte-colony stimulating factor on mucositis occurring in patients with oral and oropharynx tumors treated with curative radiotherapy: a multicenter open randomized phase III study [J]. Med Oncol, 2005, 22(3): 247-56.
[108] MCALEESE J J, BISHOP K M, A'HERN R, et al. Randomized phase II study of GM-CSF to reduce mucositis caused by accelerated radiotherapy of laryngeal cancer [J]. Br J Radiol, 2006, 79(943): 608-13.
[109] KEEFE D M, SCHUBERT M M, ELTING L S, et al. Updated clinical practice guidelines for the prevention and treatment of mucositis [J]. Cancer, 2007, 109(5): 820-31.
[110] BADEN L R, SWAMINATHAN S, ANGARONE M, et al. Prevention and Treatment of Cancer-Related Infections, Version 2.2016, NCCN Clinical Practice Guidelines in Oncology [J]. J Natl Compr Canc Netw, 2016, 14(7): 882-913.
[111] BONOMO P, ELAD S, KATAOKA T, et al. The impact of the COVID-19 outbreak on supportive care for oral mucositis: current concepts and practice [J]. Support Care Cancer, 2021, 29(5): 2255-8.