近日,领星医学携手中国人民解放军总医院第一医学中心肝胆胰外科卢实春教授团队在《中华外科杂志》上报道了一例高危复发肝癌患者根治性切除术后通过 MRD 监测指导靶向精准预防的病例。

案例介绍
男性,47 岁。病理诊断:中低分化肝细胞癌伴坏死,肿瘤大小为 12 cm×11 cm×9 cm;癌组织未侵犯肝被膜,可见脉管内癌栓。于 2018 年 6 月 19 日行开腹探查+胆囊切除+前入路右半肝切除术,取部分肿瘤组织进行临床全外显子组测序(CWES)。
检测结果(图 1)显示,FGF19、FGF3、FGF4 基因拷贝数扩增,且均为高倍扩增。结合基因检测结果,同时鉴于瑞戈非尼有更多的靶点,跨线选取瑞戈非尼作为预防复发的一线药物。
患者术后每 3 个月复查一次,项目包括肝胆胰增强 MRI、血常规、肝肾功能、肿瘤标志物等血液学指标、个体化 ctDNA 监测(康安源 TM 定制化基因监测)。随访至 2021 年 4 月 29 日,ctDNA 水平术后持续低于阈值(图 2),影像学检查未见肿瘤复发,患者一般情况良好,正常工作、生活。
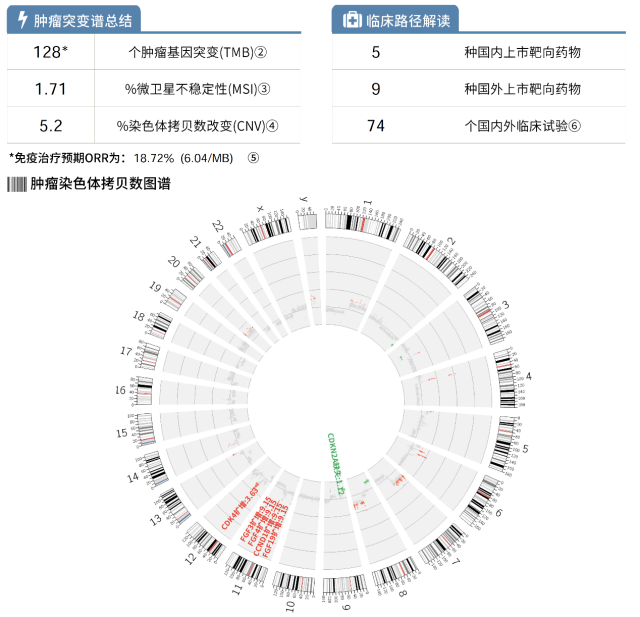
▲ 图 1 全外显子组测序结果
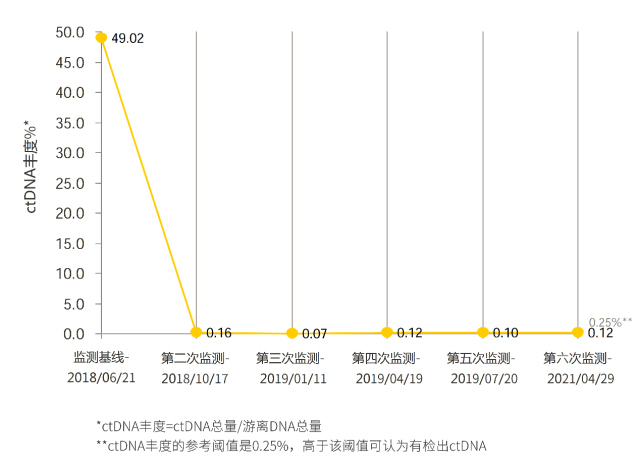
▲ 图 2 患者外周血 ctDNA 丰度变化曲线
MRD 介绍
Minimal Residual Disease(MRD)即微小残留病灶,是一个在血液肿瘤中常见的术语,可以定义为在治疗后患者体内持续存在的病灶,无法用当前的医学影像学方式检测到,因此是癌症进展的一个隐匿阶段 [1]。近年来, 从评估肿瘤负荷角度出发, 循环肿瘤 DNA(ctDNA)作为评估微小残留病灶(minimal residual disease, MRD)或分子残留病灶(molecular residual disease, MRD)的研究对象,特别是在肺癌、肠癌等实体瘤中研究证据的不断积累,基于 ctDNA 检测的 MRD 也在实体瘤中越来越受到关注。肿瘤患者接受了根治性手术治疗之后,在很大一部分患者中,微小残留病灶的少量残余肿瘤细胞会进入血液,并释放出 ctDNA,由于其可以持续存在并低于影像学或常规检测阈值,最终导致疾病复发。对患者进行术后或治疗后的 ctDNA 检测,MRD 阳性意味着抗肿瘤治疗后血液中可检测到来自肿瘤的 DNA;阴性结果表示抗肿瘤治疗后未检测到残留(剩余)病灶。在实体肿瘤治疗领域,基于 ctDNA 指导的 MRD,优于传统的临床或影像学方法可以提前发现有肿瘤复发的患者。
MRD 的基本技术,包括 Tumor-informed assays (个体化定制) 和 Tumor agnostic assays (NGS Panel 和多组学技术) 两种 [2],前者是对原发肿瘤组织进行测序以鉴定患者的特异基因组变异图谱,然后设计引物定制 panel 进行个体化的 ctDNA 检测分析,代表产品有 Natera 公司的 Signatera;后者无需原发肿瘤组织,仅依赖于一组预先选定引物/探针设计与癌症类型相关的固定 panel(通常多组学)进行 ctDNA 检测分析,代表产品有 Guardant Health 公司的 Guardant Reveal(非个体化,仅血浆)。
领星的 ctDNA-MRD 检测技术为 Tumor-informed assays (个体化定制) 即康安源 TM 定制化基因监测(On-Watch ONE),是根据患者肿瘤组织的 CWES 的测序结果,通过领星独有的且是全球第一个国际 PCT 专利技术(CSMT 专利算法),为患者量身定制该患者所特有的 ctDNA 监测 panel,更精确、高效地监测 ctDNA 突变丰度。

MRD 在肝胆肿瘤中的临床价值
ctDNA MRD 分析的最终目标是允许个体化的辅助/巩固治疗,以增加治愈的可能性或降低毒性 [3]。然而,基于 ctDNA MRD 状态的治疗升级或降级可以改善患者预后的证据有限。越来越多的已发表的病例表明,在明确治疗后,辅助化疗可以降低 MRD 患者的 ctDNA 水平 [4,5,6]。一项对 34 例 HCC 患者手术前后多次血液样本的 ctDNA 研究 [7] 结果证实 ctDNA 监测能够比传统方法更准确地评估患者的预后风险,提前预测患者疾病复发,为 MRD 在早期肝癌中的应用提供了重要证据。
目前尚无预防肝癌根治术后复发的标准方案,基于基因检测的靶向药物精准预防的方法亦未建立,靶向治疗前行基因检测的必要性尚无统一意见。
该病例随访近 3 年未见肝癌复发,甲胎蛋白正常范围,且动态监测的 ctDNA 水平持续位于阈值以下。这一病例的诊治过程进一步提示,基因检测对肝癌根治性切除术后高危复发病例的精准预防具有潜在价值。
参考文献
[1] Pantel K , C Alix-Panabières. Liquid biopsy and minimal residual disease — latest advances and implications for cure[J]. Nature Reviews Clinical Oncology, 2019. 16(7):409-424.
[2] 吴一龙, 陆舜, 程颖, 等. 非小细胞肺癌分子残留病灶专家共识 [J]. 循证医学, 2021, 21(3):7.
[3] Everett JM, Barzin Y N et al. Detecting Liquid Remnants of Solid Tumors: Circulating Tumor DNA Minimal Residual Disease. Cancer Discov.2021;11:2968–86.
[4] Abbosh C, Birkbak NJ et al. Phylogenetic ctDNA analysis depicts early-stage lung cancer evolution. Nature 2017;545:446–51.
[5] Reinert T, Henriksen TV et al. Analysis of plasma cell-free DNA by ultradeep sequencing in patients with stages I to III colorectal cancer. JAMA Oncol 2019;5:1124–31.
[6] Moding EJ, Liu Y et al. Circulating tumor DNA dynamics predict benefit from consolidation immunotherapy in locally advanced non-small-cell lung cancer. Nat Cancer 2020;1:176–83.
[7] Cai Z ,Chen G,Zeng Y et al. Comprehensive Liquid Profiling of Circulating Tumor DNA and Protein Biomarkers in Long-Term Follow-Up Patients with Hepatocellular Carcinoma[J]. Clinical Cancer Research, 2019, 25(17):5284-5294.
图片来源:领星