近日,领星与中山大学第一附属医院放射介入科郭文波教授团队合作撰写的学术论文「Estimating tumor mutational burden across multiple cancer types using whole-exome sequencing」发表于「Annals of Translational Medicine」。
该研究的目的是在中国患者中探索全外显子测序(WES)衍生的肿瘤突变负荷(TMB)在五种癌症中(神经系统肿瘤、肝癌、胆管癌、结直肠癌和胃癌)的分布情况,并分析 WES 源性 TMB 在免疫治疗中的价值。

背景介绍
免疫检查点抑制剂(ICI)治疗对晚期癌症患者具有显著的临床益处。然而,接受 ICIs 治疗的大多数患者没有表现出治疗反应。因此,迫切需要能够更好地预测 ICI 治疗临床疗效的有效生物标志物。
肿瘤突变负荷(TMB)是研究中最有希望的生物标志物之一。先前的研究表明 TMB 与新抗原负荷相关。
尽管人们一致认为全外显子测序(WES)在技术上优于 Panel,并被视为 TMB 测量的金标准,但由于该技术在癌症诊断和研究中的成本和可用性所造成的限制,即使在一些主要肿瘤中,也缺乏关于 WES 衍生 TMB 的数据。
因此,该研究的目的是在中国患者中探索 WES 衍生的 TMB 在五种癌症中(神经系统肿瘤、肝癌、胆管癌、结直肠癌和胃癌)的分布情况,并分析 WES 源性 TMB 在免疫治疗中的价值。
研究方法
共招募 309 名接受 ICI 治疗的患者,作为五种癌症的代表(神经系统肿瘤、肝癌、胆管癌、结直肠癌和胃癌),其中 269 名患者可用于生存分析。使用 WES 分析来自患者的肿瘤和匹配血液样本,并确定体细胞突变。
在该研究中,TMB 被定义为肿瘤外显子组中体细胞非同义突变的总数。根据一个共同的固定数目(10 个突变/Mb)或每种肿瘤类型的顶部三分位数,将患者分为不同的 TMB 亚组。
研究结果
TMB 在不同癌症类型中的分布
WES 衍生的 TMB 中位数在不同肿瘤之间差异很大,范围从 2.71(胆管癌)到 2.97(神经系统肿瘤)、3.69(胃癌)、4.31(肝细胞癌)和 4.64(结直肠癌)(图 1)。按年龄分组时,两组患者的 TMB 无显著差异(P = 0.81,≤ 60 对 >60)或性别(P = 0.94,男性对女性)。不同癌症类型的中位 WES 衍生 TMB 几乎与文献中的中位面板衍生 TMB 相同。
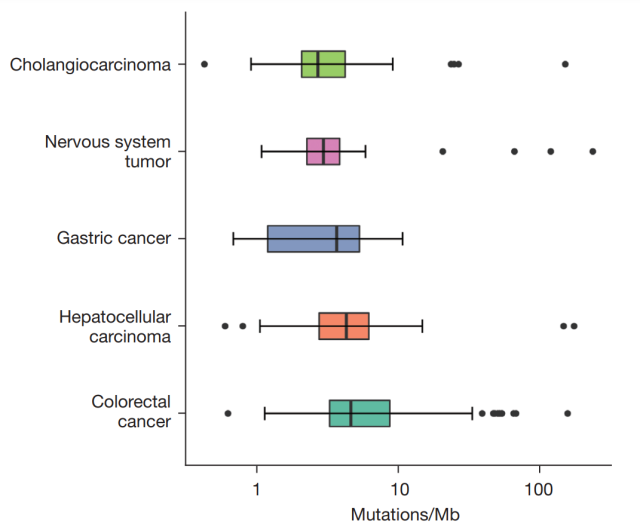
▲ 图1.TMB 在不同癌症类型中的分布
TMB 对抗 PD-L1 治疗后 OS 的影响
TMB 高组和 TMB 低组的 OS 趋势以及两组之间的分离度(生存曲线的分离度)因不同癌症类型而异。例如,在胆管癌中,与 TMB 低组相比,TMB 高组显示出生存劣势,尽管这种差异没有达到显著的癌症水平(图 2A)。在神经系统肿瘤、胃癌或肝细胞癌中,TMB 高组和 TMB 低组之间未观察到明显的生存差异(图 2B-2D)。在结直肠癌中,TMB 高组和 TMB 低组之间的分离极为显著,TMB 高组在接受 ICI 治疗后显示出生存效益(图 2E)。
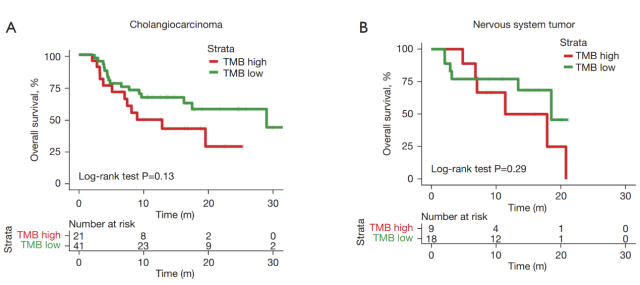
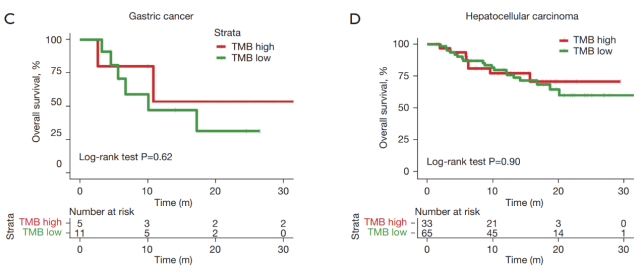
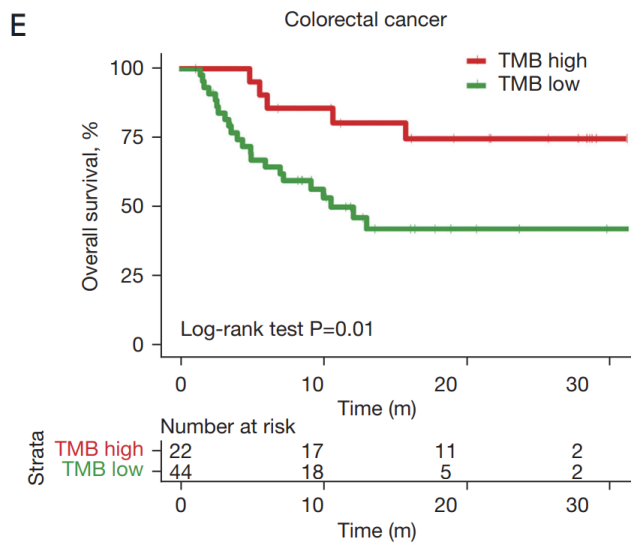
▲ 图 2
使用固定数量(TMB 高于或低于 10 突变/Mb)将患者分为 TMB 高组/低组
结直肠癌患者在 TMB 高组和 TMB 低组之间仍然表现出显著差异(图 3A)。肝细胞癌患者在两组之间也表现出显著差异,TMB 高组表现出明显的生存劣势(图 3B)。
患者数量的不平衡阻碍了 TMB 高组和低组之间有意义的统计比较,这表明使用固定阈值数量(TMB>10 突变/Mb)可能不是这些类型癌症的良好分层方法。
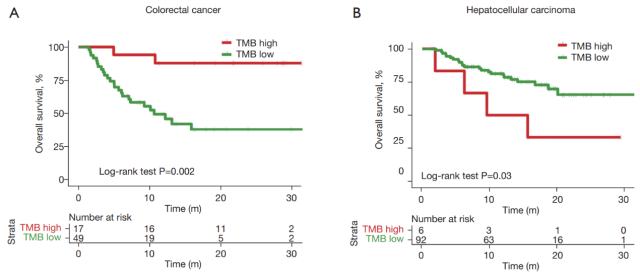
▲ 图 3
CRC 中 MSI 状态与 TMB 之间的关联
MSI 评分高是结直肠癌患者有效的免疫治疗指标。在本研究队列中结直肠癌患者中,MSI 高状态的患者比 MSI 低状态的患者有更长的 OS(图 4A)。
然而,当 MSI high 用作标记物时,只有少数患者(约 19%)显示出潜在的益处。所有 MSI 高的患者都属于 TMB 高组(使用最高三分位数阈值)(图 4B)。在本分析中,最高三分位阈值用于 TMB 分层,因为它允许纳入更多患者,并可能从该标记物中获益。
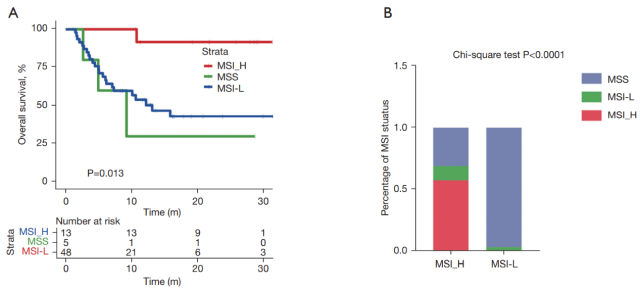
▲ 图 4
研究结论
不同癌症的 TMB 阈值标准可能不同。本文数据表明,TMB 不能预测中国患者所有癌症类型的 ICI 获益。然而,它可能是预测 ICI 治疗结直肠癌临床获益的有效生物标志物。

图片来源:领星