A traditional medicine, respiratory detox shot (RDS), inhibits the infection of SARS-CoV, SARS-CoV-2, and the influenza A virus in vitro
Brian Hetrick1, Dongyang Yu2, Adeyemi A. Olanrewaju1, Linda D. Chilin1, Sijia He1, Deemah Dabbagh1,Ghaliah Alluhaibi1, Yuan - Chun Ma3, Lewis A. Hofmann4, Ramin M. Hakami1 and Yuntao Wu1*
▋摘要
背景:目前正肆虐全球的新型冠状病毒病 (SARS-CoV-2) 已在 220 多个国家和地区大流行,截至 2021 年 4 月已导致超过 1.28 亿人感染,超过 280 万人死亡。当前,尚无可有效降低 COVID-19 致死率的治疗方法。我们研究了一种传统的中药口服制剂——祛肺毒口服液 (RDS) 的潜在抗冠状病毒活性,该口服液主要成分为东方医学传统中用于治疗肺部疾病的中草药。
结果:RDS 抑制 SARS-CoV 慢病毒、SARS-CoV-2 慢病毒、混合甲型病毒-SARS-CoV-2(Ha-CoV-2) 假型病毒以及传染性 SARS-CoV-2 和衍生的 Ha-CoV-2 变种病毒 (B.1.1.7、B.1.351、P.1、B.1.429、B.1.2、B.1.494、B.1.1.207、B.1.258 和 B.1.1.298) 对靶细胞的感染。我们进一步证明了 RDS 可以直接灭活 SARS-CoV-2 病毒颗粒的传染性。此外,我们发现 RDS 还可阻断甲型流感病毒对靶细胞的感染。
结论:RDS 可广泛抑制呼吸道病毒感染。关键词:SARS-CoV-2,COVID-19,冠状病毒,抗病毒治疗,祛肺毒口服液,传统中药,SARS-CoV,甲型流感,Ha-CoV-2,SARS-CoV-2 假型病毒
▋背景
目前正肆虐全球的新型冠状病毒病 (SARS-CoV-2) 已在 220 多个国家和地区大流行,截至 2021 年 4 月已导致超过 1.28 亿人感染,超过 280 万人死亡。当前,尚无可有效降低 COVID-19 致死率的治疗方法。新出现的 COVID-19 病毒病原体为冠状病毒 SARS-CoV-2[1],是 SARS-CoV 在严重急性呼吸综合征相关冠状病毒种类中的姊妹病毒[2,3]。SARS-CoV 和 SARS-CoV-2 最初都是在中国发现的;SARS-CoV 病毒于 2002 年 11 月在广东省首次被发现[4-6],SARS-CoV-2 则于 2019 年 12 月在武汉首次被发现[1,7,8]。在中国,这两次由冠状病毒引起的疫情中,中药均被广泛使用,用以紧急应对冠状病毒引起的疾病。对于当前的 COVID-19 大流行,中国有超过 85% 的 SARS-CoV-2 感染患者接受了传统中医药疗法(9,10)。许多使用的中药是否具有有效的抗冠状病毒特性并在临床上是否有效,这个重要问题尚未得到充分答复。
中药作为治疗冠状病毒所引发疾病的有效疗法,但由于缺乏体内或体外的系统研究,其发展与合理使用均受到了阻碍。为了确定中药的潜在抗 SARS-CoV-2 活性,我们从常用中药中筛选了多种草药提取物,并从中药口服液 RDS(美国一种商业性食品补充剂) 中发现了抗 SARS-CoV 和抗 SARS-CoV-2 病毒的活性,一种在美国的商业食品补充剂。RDS 用于增强人体呼吸系统的总体健康,其包含多种草药成分,如人参和荆芥,它们是传统上用于控制炎症和肺部疾病的中草药 (11-13)。在此,我们报道 RDS 对 SARS-CoV、SARS-CoV-2 假病毒以及具有感染性的野生型 SARS-CoV-2 病毒对靶细胞的感染具有抑制作用。我们进一步证明 RDS 可通过直接灭活病毒颗粒或阻止病毒侵入而抑制病毒的早期感染进度。此外,我们发现 RDS 还可以阻止甲流病毒对靶细胞的感染。这些结果表明,RDS 对呼吸道病毒的感染可能具有广泛的抑制作用。
▋结果
为了从传统中草药中找到潜在的抗 SARS-CoV-2 活性,我们从约四十种传统草药中筛选提取出 SARS-CoV-2S 蛋白假型慢病毒[14,15] 和人体肺部 A549(ACE2) 靶细胞,此人类 ACE2 基因会通过慢病毒转导作为载体介导,从而稳定转导来实现超表达。慢假型病毒使用绿色荧光蛋白 (GFP) 或荧光素酶 (Luc) 作为报道基因,并通过了具有广谱抗病毒进入抑制剂,以及阿比多尔 (Arbidol)[16],和人类抗毒血清对抗 SARS-CoV-2(图 1a、C) 的验证。我们能够成功检测到阿比多尔 (Arbidol) 和抗毒血清对于 SARS-CoV-2 假型病毒的抑制作用,这是我们在其他四十余种传统草药提取物测试中没有发现的,包括其中一些存在较高毒性的草药 (图 1a-C)。然而,鉴于慢性假型病毒仅能检测 SARS-CoV-2 病毒的侵入行为,我们不能排除这些草药提取物可能有在进入后阶段能够抑制 SARS-CoV-2 的可能性。我们进一步从传统药物祛肺毒口服液 (RDS) 中筛选出了可能的抗 SARS-CoV-2 活性,该产品含有九种草药成分——金银花、连翘、人参、荆芥、玄参、苦杏仁、蜂房、皂角、甘草,在中国传统上用于治疗肺部疾病 (11-13)。
金银花含有甲基咖啡酸、3,4-二邻咖啡酰基奎宁酸、甲基 3,4-二邻咖啡酰基奎宁酸、原儿茶酸、甲基绿原酸和木犀草素;花蕾中还含有金银花苷 A、B 和 10 种已知环烯醚萜苷[17];该植物还含有皂甙金银花甙 A 和 B,以及抗炎症作用的金银花苷 C[18,19]。连翘酯苷中含有木脂素、松脂醇和连翘苷[20]。人参中含有被称为人参皂苷的甾体皂苷,是人参属植物独有的植物化学物质[21,22]。细叶荆芥中主要活性成分为四种单萜,(−)-薄荷酮、(+)-普莱格酮、(−)-柠檬烯和 (+)-薄荷呋喃;这种植物还含有其他化合物,如 1-辛烯-3-醇、3-辛酮、β-月桂烯和β-石竹烯[23]。玄参含有超过 162 种化合物,包括环烯醚萜和环烯醚萜苷、苯丙苷、有机酸、萜类、糖类、黄酮类、甾醇和皂苷[24]。苦杏仁中含有酚类、氰基化合物和果胶多糖[25]。皂角刺中含有皂苷和羽扇豆酸[26,27],而甘草中含有主要活性成分甘草酸[28]。为了进一步测试 RDS 的抗 SARS-CoV-2 活性,用不同稀释浓度的 RDS 预处理 A549(ACE2) 细胞,然后让这些细胞在存在 RDS 的情况下接受 4-6 小时的感染。感染后,在不存在 RDS 的情况下培养细胞,然后在 48 和 72 小时的时候,通过流式细胞术对病毒感染的抑制作用进行量化。为了控制细胞毒性,使用碘化丙啶 (PI) 对即将死亡和已死亡的细胞进行染色,仅在活细胞群中分析 GFP+细胞。如图 2 所示,我们观察到 RDS 对 SARS-CoV-2(GFP) 假病毒具有剂量依赖性抑制作用。为了证实这些结果,我们使用内源性表达 ACE2 的 VeroE6 细胞重复了该感染实验。
(见下页图)

ACE2 内部表达,生产性 SARS-CoV 和 SARS-CoV-2 病毒可对其进行感染,ACE2 通常用于冠状病毒的研究 (7)。考虑到在缺乏 ACE2 超表达 [15,29,30] 的情况下,假型病毒对 VeroE6 的感染性较低,我们还使用了荧光素酶报道基因假型病毒,该病毒的报道基因表达由 HIV-1LTR 和 Tat 驱动,具有更高的报道基因敏感性和信噪比。
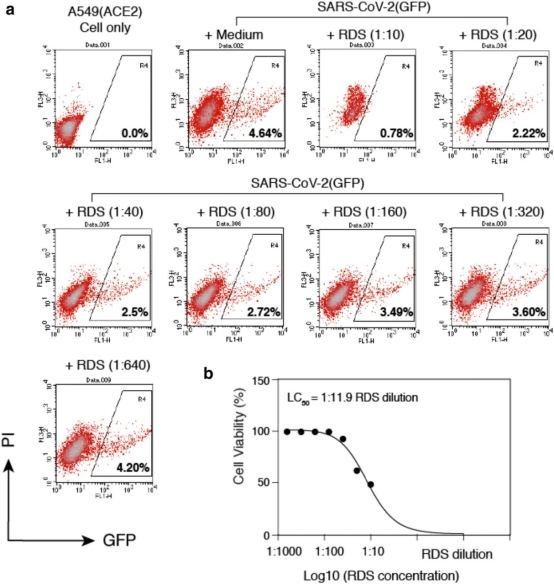
图 2:RDS 抑制 SARS-CoV-2(GFP) 假型病毒感染 A549(ACE2) 细胞。
A.A549(ACE2) 细胞用 RDS 连续稀释 30 分钟后,用 SARS-CoV-2(GFP) 假型病毒感染。将细胞洗去病毒和 RDS,并在不存在 RDS 的情况下进行培养。流式细胞仪检测病毒感染抑制情况。未感染的细胞和感染 SARS-CoV-2(GFP) 但未经 RDS 治疗的细胞作为对照。GFP+细胞百分比已显示。(PI) 碘化丙啶。
B.RDS 的细胞毒性定量。A549(ACE2) 细胞用 RDS 连续稀释 4 小时,洗去 RDS,无 RDS 培养 48 小时。碘化丙啶染色鉴定正在死亡细胞和已死亡细胞,流式细胞术分析。绘制剂量-反应细胞毒性曲线,RDS 的半致死浓度 (LC50) 比例为 1:11.9。
如图 3A 所示,我们使用 Luc 报告基因假病毒和 VeroE6 细胞进行感染实验,观察到 RDS 对该病毒感染具有剂量依赖性抑制作用,并且半数抑制浓度确定为 1:230RDS 稀释度 (图 3B)。我们还量化了 RDS 对 VeroE6 细胞活力的影响,确定了 50% 细胞死亡剂量为 1:11.8RDS 稀释度。
图 3:RDS 对 SARS-CoV-2(Luc) 假病毒和野生型 SARS-CoV-2 病毒的剂量依赖性抑制抑制作用。用 RDS 连续稀释预处理 A、BVeroE6 细胞,并用 SARS-CoV-2(Luc) 假型病毒感染。将细胞洗去病毒和 RDS,并在不存在 RDS 的情况下进行培养。在感染后 72 小时用荧光素酶检测病毒感染的抑制作用。未感染细胞和 SARS-CoV-2-luc 感染但未经过 RDS 治疗的细胞作为对照。实验重复三次。绘制剂量反应曲线和 RDS 的 I-C50 稀释比例为 1:230。CRDS 对 VeroE6 细胞的细胞毒性也通过碘化丙啶染色和流式细胞术定量。用 RDS 连续稀释 4 小时,洗去 RDS,在不含 RDS 的情况下培养 72 小时。绘制细胞毒性剂量-反应曲线,RDS 的半致死浓度 (LC50) 比例为 1:13.8 稀释。DRDS 抑制传染性 SARS-CoV-2 感染。用连续稀释的 RDS 预处理 VeroE6 细胞,并在 RDS 存在的情况下感染 SARS-CoV-2。感染 48 小时后,通过噬菌斑分析病毒释放后的病毒复制抑制情况。抑制试验一式三份进行,并在 Prism7(Graph Pad) 中使用单向方差 (One-Way ANOVA) 分析及 Dunnett 后检验 (Dunnett's Post Test),以此确定统计显着性。显著性值用星号表示如下:*p<0.02,**p<0.01。「ns」表示不显着。
为了进一步验证使用假病毒获得的结果,我们测试了 RDS 对于 SARS-CoV-2 感染的阻断传染性能力。如图 3D 所示,RDS 同时也阻断了 SARS-CoV-2 对 VeroE6 细胞的感染。RDS 在稀释 1:40 以上时可显著减少病毒斑块的形成。
综上,通过 SARS-CoV-2 假病毒与传染性病毒的结果表明,RDS 含有抑制 SARS-CoV-2 感染的活性成分,可能是通过直接灭活病毒或阻断病毒的早期感染进度。
为进一步研究可能的机制,我们将传染性 SARS-CoV-2 病毒颗粒与连续稀释的 RDS 在 37°C 下预培养 1 小时。随后,将混合物进一步依次稀释-(10–1 至 10–4),并加入 Vero 细胞进行噬菌斑分析以确定病毒感染性的降低。如图 4A 所示,我们观察到在 RDS 中短暂暴露一小时后的病毒颗粒,其 SARS-CoV-2 的感染效价也呈剂量依赖性下降。该结果证实了 RDS 可有效直接灭活 SARS-CoV-2 病毒颗粒的传染性。
我们进一步测试了 RDS 是否也能抑制 SARS-CoV-2 病毒变种的感染。为此,我们利用最近开发的混合甲病毒-SARS-CoV-2 假型病毒 (Ha-CoV-2)[31] 来制备一系列 S 蛋白变体,包括英国变体 (B.1.1.7),南非变体 (B.1.351),巴西变体 (P.1),加州变体 (B.1.429),和其他几个新兴变体 (B.1.2,B.1.494,B.1.1.207B.1.258,B.1.1.298)。Ha-CoV-2(Luc) 和相关 S 蛋白变异体在 37°C 连续稀释 RDS 培养 1 小时。随后,用该混合物感染 HEK293T(ACE2/TMPRESS2) 靶细胞。感染后 12 小时,荧光素酶测定病毒感染的抑制作用。如图 4B 所示,我们还观察到了 RDS 对 Ha-CoV-2(Luc) 和所有 S 蛋白变体的剂量依赖性抑制。
我们还测试了 RDS 阻断 SARS-CoV 感染的能力,使用带有 SARS-CoV 突刺蛋白的 GFP 报道基因慢病毒和[15] 伪剂量。我们将人 A549(ACE2) 细胞用作靶细胞,将其用系列稀释的 RDS 预处理,然后用 SARS-CoV(GFP) 报告基因假病毒感染 4-6 小时。感染后在不含 RDS 的情况下培养细胞,流式细胞术量化检测其对病毒感染的抑制作用。同样,使用碘化丙啶排除正在死亡与已死亡的细胞,仅在活细胞群中分析 GFP+细胞。如图 5A 所示,我们观察到 RDS 对 SARS-CoV(GFP) 假型病毒的抑制作用呈剂量依赖性。我们进一步证实了这些结果,并量化了 RDS 介导的抑制与 Luc 报道基因 SARS-CoV 假型病毒,SARSCoV(Luc)。我们观察到 RDS 对 SARS-CoV(Luc) 和的抑制作用呈剂量性依赖,其半抑制浓度 (IC50) 为 1:70.88 稀释度 (图 5B,C)。考虑到 SARS-CoV 和 SARS-CoV-2 都使用 ACE2 感染靶细胞,我们还测试了 RDS 的抗病毒活性是否仅针对与 ACE2 有相互作用的冠状病毒。为此,我们检测了一种不相关的负链 RNA 病毒--甲型流感病毒。它通过病毒血凝素 (HA) 和细胞α-唾液酸来感染靶细胞。为了制备甲型流感病毒,将表达甲型流感 A/WSN/33(H1N1) 基因组每个片段的 8 个载体和一个 GFP-报道基因共转染到 HEK293T 细胞中。在 RDS 存在的情况下,收集病毒颗粒并用于感染目标 MDCK 细胞。如图 6A 所示,我们观察到 RDS 对甲型流感病毒的抑制作用呈剂量依赖性。RDS 在 1:40 和 1:80 稀释时可完全阻断病毒感染,在 1:160 稀释时则可部分抑制甲型流感。RDS 对 MDCK 细胞的半致死浓度 (LC50) 经测定为 1:18.5(图 6B)。这些结果表明,RDS 的抗病毒活性并非针对特定病毒,而可能能够广泛抑制多种呼吸道病毒,如冠状病毒和甲型流感病毒。
▋讨论
在本报告中,我们证明了传统药物祛肺毒口服液 (RDS) 含有广谱抗病毒活性,可阻断 SARS-CoV、SARSCoV-2 和甲型流感病毒的感染。虽然 RDS 能够抑制多种病毒,但其抗病毒活性因病毒类型和毒株而异。例如,对 SARS-CoV 慢假病毒的 I-C50 浓度为 1:7.9 稀释度,对 SARS-CoV-2 慢假病毒的 I-C50 浓度为 1:230 稀释度。对于传染性野生型 SARS-CoV-2 病毒,I-C50 为 1:40 稀释度,对甲型流感,其 I-C50 为 1:250。RDS 对 Ha-CoV-2 及其变种有不同的抑制作用,IC50 数值从 1:70 到 1:2601 稀释度不等 (图 4B)。
(见下一页图)
图 4 RDS 对 SARS-CoV-2 和衍生的 Ha-CoV-2 变种具有剂量依赖性灭活作用。ASARS-CoV-2 颗粒加连续稀释的 RDS 在 37°C 下培养 1 小时。随后,将混合物进一步连续稀释,并加入 Vero 细胞中进行噬菌斑分析,以确定病毒感染性降低。抑制试验一式三份进行,并在 Prism7(GraphPad) 中使用单向方差 (One-WayANOVA) 分析和 Dunnett 后检验 (Dunnett'sPostTest) 以此确定统计显着性。显著性值用星号表示如下:*p<0.02,**p<0.01。「ns」表示不显着。
BHa-CoV-2(Luc) 和相关 S 蛋白变体与连续稀释的 RDS 在 37°C 培养 1 小时后,用混合物感染 HEK293T(ACE2/TMPRESS2) 靶细胞。感染后 12 小时,荧光素酶测定病毒感染的抑制作用。RDS 的 IC50 值的稀释度为 1:177(wt),1:828(B.1.1.7),1:124(B.1.351),1:88(P.1),1:134(B.1.1.207),1:2601(B.1.1.298),1:70(B.1.258),1:362(B.1.429),1:163(B.1.494),1:137(B.1.2)。
我们进一步证明了 RDS 可以抑制冠状病毒的早期感染进度。虽然具体的抗病毒机制尚未清楚,但 RDS 可以通过直接灭活病毒颗粒或通过阻止病毒侵入或阻断病毒侵入后的早期进度来阻止病毒感染。在其他几种传统中药中也发现了抗 SARS-CoV 和 SARS-CoV-2 的活性。例如,一种常见的传统中药——甘草。
甘草根中已证明含有甘草酸素,可抑制 SARS 病毒[32] 临床分离株的复制。此外,另一种可用于治疗呼吸道疾病的中药——双黄连制剂,已显示出在体外以剂量依赖性方式抑制 SARS-CoV-23CL 蛋白酶 (3CLpro) 活性。黄芩苷和黄芩素拟作为双黄连阻断 3CLpro[33] 的有效成分。
图 5 RDS 抑制 SARS-CoV 假型病毒对 A549(ACE2) 细胞的感染。用连续稀释的 RDS 预处理 A、B 细胞,用 SARS-CoV(GFP)(A) 或 SARSCoV(Luc)B 假型病毒感染。将细胞清洗,去掉病毒和 RDS,在不存在 RDS 的情况下进行培养。在感染后 48 小时和 72 小时,通过流式细胞术或荧光素酶检测来定量病毒感染的抑制作用。实验重复三次。绘制剂量响应曲线,并绘制 RDS 的 IC50 值为 1:70.9 稀释度 (C)
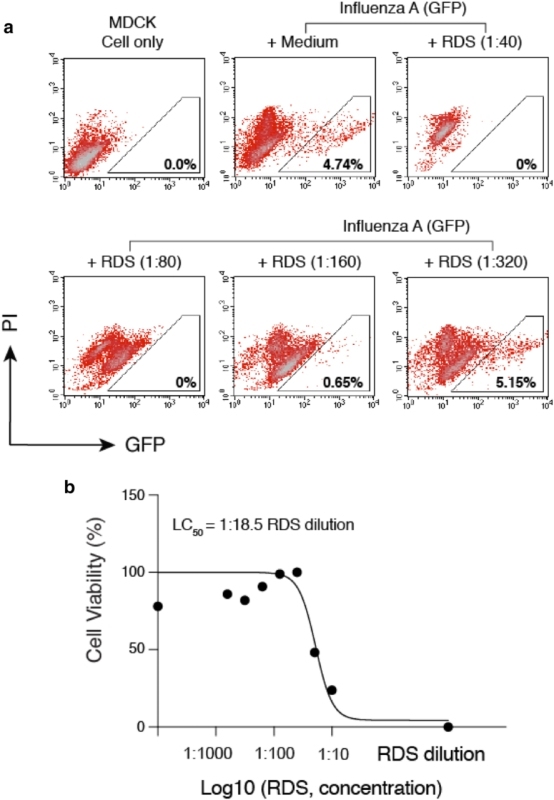
图 6 RDS 抑制甲流病毒对 MDCK 细胞的感染。(A) 用连续稀释的 RDS 预处理 MDCK 细胞 30 分钟,然后用甲流病毒 (GFP) 对其进行感染。感染后,在 RDS 存在下培养细胞。36 小时后用流式细胞仪对病毒感染的抑制作用进行定量。把未感染的细胞与被甲流病毒 (GFP) 感染但未经 RDS 处理的细胞进行对比。图中显示了 GFP+细胞的百分比。PI 表示碘化丙啶 PI。
(B) 另外还使用了 MTT 测定法定量了 RDS 对 MDCK 细胞的毒性,绘制了细胞毒性的剂量-反应曲线,经计算,RDS 的半数致死浓度为 1:18.5 稀释度 RDS 的有效抗病毒成分尚未确定。然而,RDS 不同于黄芩苷和黄芩素,RDS 可以通过直接灭活病毒粒子来阻断病毒感染 (图 4),而黄芩苷和黄芩素则在病毒生命周期的后期通过阻断病毒蛋白酶的活性来发挥作用。然而,RDS 的体外抗 SARS-CoV-2 活性仍需在今后的动物研究和人类临床试验中得到证实。目前,我们正在进行小型动物实验,以确定 RDS 在体内阻断 SARS-CoV-2 病毒感染的潜力。
▋结论
我们的研究表明,RDS 可广泛抑制呼吸道病毒的感染,如 SARS-CoV、SARS-CoV-2 和甲型流感。
▋方法
细胞和细胞培养
HEK293T (ATCC 马纳萨斯,弗吉尼亚州) MDCK (ATCC 马纳萨斯,弗吉尼亚州),VeroE6 (ATCC 马纳萨斯,弗吉尼亚州) 和 A549 (ACE2) (来自 Virongy LLC 赠与,马纳萨斯,弗吉尼亚州),和 HEK293T (ACE2/TMPRESS2) (来自 Virongy LLC 赠与,马纳萨斯,弗吉尼亚州) 目前保存于 Dulbecco's modifiedEagle's medium (DMEM) (赛默飞世尔科技 Thermo Fisher Scientific) 含有 10% 热灭活 FBS 和 1×青霉素-链霉素 (赛默飞世尔科技 Thermo Fisher Scientific)。在 HEK293T (ACE2/TMPRESS2) 细胞培养基中分别以 1μg/ml 和 200μg/ml 的浓度加入嘌呤霉素和潮霉素 B。
质粒转染和病毒制备
含 SARS-CoVS 蛋白或 SARS-CoV-2S 蛋白的慢性假型病毒颗粒由 Virongy LLC (Manassas,VA) 提供,或按照前面描述的方法[15] 制备。简言之,为了制备 GFP 报道基因慢性假病毒,HEK293T 细胞与表达 SARS-CoVS 蛋白或 SARS-CoV-2S 蛋白的载体、pCMVΔR8.2 和 pLKO.1-puro-TurboGFP 共转染。为了产出荧光素酶报道基因慢性假型病毒,将 HEK293T 细胞与表达 SARSCoVS 蛋白或 SARS-CoV-2S 蛋白的载体、pCMVΔR8.2 和 pLTR-Tat-IRES-Luc 进行共转染。转染后 48 小时收集病毒上清液,离心浓缩,−80℃ 保存。野生型 SARS-CoV-2 病毒 (Isolate USA-WA1/2020) 由 BEI Bioresources (Manassas,VA) 提供。pHW-NAGFP (ΔAT6) 报告基因质粒和 A/WSN/1933 H1N1 衍生质粒 pHW2000-PB2、pHW2000-PB1、pHW2000-PA、pHW2000-HA、pHW2000-NP、pHW2000-NA、pHW20000M 由 FengLi 博士友好提供。在流感病毒 A-GFP 报道基因粒子制备中,将 pHW2000-pb2、pHW2000-pb1、pHW2000-PA、pHW2000-ha、pHW2000-np、pHW2000-na、pHW2000-m、pHW2000-ns 和 pHW-NA-GFP 共转染 HEK293T 细胞 (ΔAT6)。48 小时后收集病毒上清液。SARS-CoV-2S、M、E、N 表达载体购自 Sinobiological。利用 Twist Bioscience 合成了 Ha-CoV-2(Luc) 载体和 S 蛋白变异载体。Ha-CoV-2(Luc) 和 S 蛋白变异粒子按照前面描述方法[31] 进行制备。
病毒感染和药物抑制试验
RDS(祛肺毒口服液)(来自 Dejia Harmony 赠与,利斯堡,弗吉尼亚州) 是由马博士实验室 (Burnaby,BC,Canada) 生产的一种商业产品。RDS 配方中所有中草药成分均符合《中国药典 2015 年版》「饮片」标准,包括有效成分含量及重金属、农药限量检测。RDS 是一种中药的共煎剂,最终产物在真空条件下蒸发。SARS-CoV-2 抗血清由 LanceA. Liotta 医生提供。将阿比朵尔盐酸盐 (Sigma) 重新悬浮在二甲基亚砜 (Sigma) 中。对于假型病毒感染,12 孔板中的 A549(ACE2) 细胞 (来自 Virongy LLC 赠与,马纳萨斯,弗吉尼亚州) 或 VeroE6 细胞用 RDS 预处理 30 分钟,在 37℃ 下感染 4-6 小时,然后在新鲜培养基中洗涤培养 48-72 小时。对于 VeroE6 细胞的感染,细胞也被 CoV-2 假型病毒感染增强剂 (CoV-2PIE) (来自 Virongy LLC 赠与,马纳萨斯,弗吉尼亚州) 预处理后,在 37°C 下再处理 30 分钟。使用 GloMaxDiscover 酶标仪 (Promega) 分析细胞裂解物的荧光素酶活性。对于野生型 SARS-CoV-2 感染,VeroE6 细胞在 37°C 下用 RDS 预处理 30 分钟,然后用 MOI 为 0.05 感染 SARS-CoV-2 (Isolate USA-WA1/2020;BEI Bioresources) 在乔治梅森大学的 BSL-3 收容设施内停留 1 小时。细胞用 PBS 洗涤 2 次,用含 RDS 的培养基培养 48 小时。从上清中提取病毒,用 12 孔板培养的 Vero 细胞单层中的噬菌斑试验测定小瓶滴度。简言之,每个样品在完整的 Dul-becco's ModifiedEagle 培养基 (VWR) 中制备,包含 1X 青霉素-链霉素 (VWR),并添加 10% 的 FBS(赛默飞世尔科技 Thermo Fisher Scientific)。然后将 200 微升的每种稀释液吸附到 VeroE6 细胞单层的三个平行孔上 1 小时。然后用 1~2 ml0.6% 琼脂糖 (Invitrogen) 和一部分完整的 Eagle Minimal Essential 培养基 (VWR) 的混合物覆盖单层,含 1X 青霉素-链霉素,并添加 10%FBS。48 小时后,将单层膜固定在 10% 甲醛溶液中 1 小时,并去除覆盖的琼脂塞。为了染色斑块,加入含有 20% 乙醇的 1% 结晶紫染料溶液 5 分钟,然后用去离子水洗涤。对于甲型流感病毒感染 MDCK 细胞,在 37°C 下用 RDS 预处理 30 分钟,然后用 A-GFP 报道基因病毒感染 6 小时。用含 RDS 的培养基洗涤细胞,培养 36 小时。GFP 表达通过流式细胞仪定量。(FACSCalibur,BD Biosciences).
对于 SARS-CoV-2 病毒颗粒的 RDS 灭活试验,将 100μl 连续稀释的 RDS 添加到 1 mlSARS-CoV-2 病毒原液 (3.65×105PFU/ml) 中,最终 RDS 稀释为 1:20,1:40 或 1:80。也包括对照条件 (1 ml 病毒+100μl 培养基)。混合物在 37°C 下培养 1 小时。随后,对混合物进行系列稀释以产生额外的 1:10、1:100、1:1,000 和 1:10,000 稀释度,并将连续稀释的样品加入 12 孔板中的 Vero 细胞中,用于进行噬菌斑测定分析。斑块测定中最终的 RDS 稀释度为 1:200 至 1:200,000;1:400 到 1:400,000;和 1:800 到 1:800,000 的 RDS 稀释液。
Ha-CoV-2(Luc) 和 S 蛋白变异粒子按照前面描述的方法[31] 制备。对于 Ha-CoV-2(Luc) 的 RDS 灭活,将 5μl 连续稀释的 RDS 添加到 45μlHa-CoV-2(Luc) 或变体中,最终 RDS 稀释度为 1:20、1:40、1:80、1:160 或 1:320。将混合物在 37°C 下培养 1 小时,然后在 RDS 存在下感染 HEK293T (ACE2/TMPRESS2) 细胞 12 小时。使用 GloMax Discover 酶标仪 (Promega) 分析细胞裂解物的荧光素酶活性。
细胞毒性分析检测
用碘化丙啶染色和流式细胞术量化对 A549 (ACE2) 细胞和 VeroE6 细胞的药物细胞毒性进行检测,如所述 (34)。使用细胞增殖试剂盒 I(MTT) (Sigma) 和制造商建议的方案对 MDCK 细胞的药物毒性进行量化。简言之,将 MDCK 细胞 (ATCC) 以每孔 1×-105 个细胞的速度接种到 12 孔板中。细胞培养隔夜后,通过 RDS 处理 1 天,然后在 MTT 标记试剂 (Sigma) 的培养基中培养。将细胞与标记试剂共同培养 4 小时,再后续加入 MTT 增溶液。培养皿孵育过夜,用 GloMax Discover 酶标仪 (Promega) 测定吸光度。
缩写
SARS-CoV:严重急性呼吸系统综合症相关冠状病毒;SARSCoV-2:Severe 严重急性呼吸系统综合症相关冠状病毒-2;TCM:传统中药;RDS:呼吸道排毒口服液;Ha-CoV-2:混合甲型新冠病毒假病毒。
致谢
感谢 FengLi 提供流感病毒表达载体,感谢 LanceLiotta 提供抗毒血清;感谢 TedCi,HeSun,ZhigangGao,WanyingWu 的讨论与建议;感谢 KevinCarter、MarkMamdar、RichKeurajian、KarenFreidouni 提供 RDS 和草药提取物。
作者贡献
此次实验由 Y.W.,R.H. 和 L.A.H. 设计,由 Y.W. 撰稿,由 L.A.H. 编辑。B.H.,D.Y.,A.A.O.,L.D.C.,S.H.,D.D、GA 及 YM 执行了该实验。所有作者已阅读并批准最终稿件。
资金
本研究的经费来自于乔治梅森大学内部拨款 223741(DeJiaHarmony/Anti-SARS-CoV-2),该款项由德佳和畅 (DeJiaHarmony) 提供。
数据和材料的可用性
本研究中产生或分析的所有数据均包含在本文中。试剂可从 Y.W 处获取。
声明
伦理批准及参与同意
不适用
同意出版
不适用
竞争利益
乔治梅森大学国家生物防御和传染病中心的 RMH 和 YW 已获得了德佳和畅 (DejiaHarmony) 的研究资助,LAH 为德佳和畅担任顾问并获得了酬金。没有其他关系或活动可能会影响到提交的工作。
作者详细信息
1美国弗吉尼亚州乔治梅森大学系统生物学学院国家生物防御和传染病中心,马纳萨斯 20110。
2VirongyLLC,弗吉尼亚州马纳萨斯。3加拿大伯纳比,BCV5J0E5 马博士实验室 (Dr.Ma's LaboratoriesInc.)。4 美国弗吉尼亚州利斯堡世界卫生科学组织,20176。
收稿日期:2021 年 4 月 7 日
接受日期:2021 年 5 月 10 日
线上出版时间:2021 年 5 月 29 日
参考文献
1. Zhu N, Zhang D, Wang W, Li X, Yang B, Song J, et al. A Novel Coronavirus from Patients with Pneumonia in China, 2019. N Engl J Med. 2020;382(8):727–33.
2. Wu Y, Ho W, Huang Y, Jin D, Li S, Liu S, et al. SARS-CoV-2 is an appropriate name for the new coronavirus. Lancet. 2020;395(10228):949–50.
3. Gorbalenya AE, Baker SC, Baric RS, de Groot RJ, Drosten C, Gulyaeva AA, et al. Coronaviridae Study Group of the International Committee on Taxonomy of Viruses. Nat Microbiol. 2020;5:536–44.
4. Drosten C, Günther S, Preiser W, van der Werf S, Brodt H-R, Becker S, et al. Identification of a novel coronavirus in patients with severe acute respiratory syndrome. N Engl J Med. 2003;348(20):1967–76.
5. Ksiazek TG, Erdman D, Goldsmith CS, Zaki SR, Peret T, Emery S, et al. A novel coronavirus associated with severe acute respiratory syndrome. N Engl J Med. 2003;348(20):1953–66.
6. Peiris JSM, Lai ST, Poon LLM, Guan Y, Yam LYC, Lim W, et al. Coronavirus as a possible cause of severe acute respiratory syndrome. Lancet. 2003;361(9366):1319–25.
7. Zhou P, Yang X-L, Wang X-G, Hu B, Zhang L, Zhang W, et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature. 2020;579(7798):270–3.
8. Wu F, Zhao S, Yu B, Chen Y-M, Wang W, Song Z-G, et al. A new coronavirus associated with human respiratory disease in China. Nature. 2020;579(7798):265–9.
9. Yang Y, Islam MS, Wang J, Li Y, Chen X. Traditional Chinese medicine in the treatment of patients infected with 2019-new coronavirus (SARS-CoV-2): a review and perspective. Int J Biol Sci. 2020;16(10):1708–17.
10. Ling CQ. Traditional Chinese medicine is a resource for drug discovery against 2019 novel coronavirus (SARS-CoV-2). Journal Integr Medicine. 2020;18(2):87–8.
11. Shan M-Q, Qian Y, Yu S, Guo S-C, Zhang L, Ding A-W, et al. Anti-inflammatory effect of volatile oil from Schizonepeta tenuifolia on carrageenininduced pleurisy in rats and its application to study of appropriate harvesting time coupled with multi-attribute comprehensive index method. J Ethnopharmacol. 2016;194:580–6.
12. Jung ID, Kim HY, Park JW, Lee CM, Noh KT, Kang HK, et al. RG-II from Panax ginseng C.A. Meyer suppresses asthmatic reaction. BMB Reports. 2012;45(2):79–84.
13. Wu W, Li R, Li X, He J, Jiang S, Liu S, et al. Quercetin as an antiviral agent inhibits influenza A virus (IAV) entry. Viruses. 2015;8(1):6. https:// doi. org/
10. 3390/ v8010 006. 14. Belouzard S, Chu VC, Whittaker GR. Activation of the SARS coronavirus spike protein via sequential proteolytic cleavage at two distinct sites. Proc Natl Acad Sci USA. 2009;106(14):5871–6.
15. He S, Waheed AA, Hetrick B, Dabbagh D, Akhrymuk IV, Kehn-Hall K, et al. PSGL-1 inhibits the incorporation of SARS-CoV and SARS-CoV-2 spike glycoproteins into pseudovirus and impairs pseudovirus attachment and infectivity. Viruses. 2021;13(1):46. https:// doi. org/ 10. 3390/ v1301 0046.
16. Boriskin YS, Leneva IA, Pecheur EI, Polyak SJ. Arbidol: a broad-spectrum antiviral compound that blocks viral fusion. Curr Med Chem. 2008;15(10):997–1005.
17. Kakuda R, Imai M, Yaoita Y, Machida K, Kikuchi M. Secoiridoid glycosides from the flower buds of Lonicera japonica. Phytochemistry. 2000;55(8):879–81.
18. Son KH, Jung KY, Chang HW, Kim HP, Kang SS. Triterpenoid saponins from the aerial parts of Lonicera japonica. Phytochemistry. 1994;35(4):1005–8.
19. Kwak WJ, Han CK, Chang HW, Kim HP, Kang SS, Son KH. Loniceroside C, an antiinflammatory saponin from Lonicera japonica. Chem Pharm Bull. 2003;51(3):333–5.
20. Davin LB, Bedgar DL, Katayama T, Lewis NG. On the stereoselective synthesis of (+)-pinoresinol in Forsythia suspensa from its achiral precursor, coniferyl alcohol. Phytochemistry. 1992;31(11):3869–74.
21. Kim YS, Woo JY, Han CK, Chang IM. Safety analysis of panax ginseng in randomized clinical trials: a systematic review. Medicines. 2015;2(2):106–26.
22. Attele AS, Wu JA, Yuan CS. Ginseng pharmacology: multiple constituents and multiple actions. Biochem Pharmacol. 1999;58(11):1685–93.
23. Yu S, Chen Y, Zhang L, Shan M, Tang Y, Ding A. Quantitative comparative analysis of the bio-active and toxic constituents of leaves and spikes of Schizonepeta tenuifolia at different harvesting times. Int J Mol Sci. 2011;12(10):6635–44.
24. Ren D, Shen Z-y, Qin L-p, Zhu B. Pharmacology, phytochemistry, and traditional uses of Scrophularia ningpoensis Hemsl. J Ethnopharmacol. 2021;269:113688.
25. Sefer F, Misirli A, Gülcan R, editors. A RESEARCH ON PHENOLIC AND CYANOGENIC COMPOUNDS IN SWEET AND BITTER KERNELLED APRICOT VARIETIES. 2006: International Society for Horticultural Science (ISHS), Leuven, Belgium.
26. Chong W, Feng XY, Zhen GZ, Dan L, Yue D. Inhibition of mast cell degranulation by saponins from Gleditsia sinensis–structure-activity relationships. Nat Prod Commun. 2009;4(6):777–82.
27. Li WH, Zhang XM, Tian RR, Zheng YT, Zhao WM, Qiu MH. A new anti-HIV lupane acid from Gleditsia sinensis Lam. J Asian Nat Prod Res. 2007;9(6–8):551–5.
28. Nazari S, Rameshrad M, Hosseinzadeh H. Toxicological effects of Glycyrrhiza glabra (Licorice): a review. Phytother Res. 2017;31(11):1635–50.
29. Meltzer B, Dabbagh D, Guo J, Kashanchi F, Tyagi M, Wu Y. Tat controls transcriptional persistence of unintegrated HIV genome in primary human macrophages. Virology. 2018;518:241–52.
30. Wang Z, Tang Z, Zheng Y, Yu D, Spear M, Iyer SR, et al. Development of a nonintegrating Rev-dependent lentiviral vector carrying diphtheria toxin A chain and human TRAF6 to target HIV reservoirs. Gene Ther. 2010;17(9):1063–76.
31. Hetrick B, He S, Chilin LD, Dabbagh D, Alem F, Narayanan A, et al. Development of a novel hybrid alphavirus-SARS-CoV-2 particle for rapid in vitro screening and quantification of neutralization antibodies, viral variants, and antiviral drugs. bioRxiv 2020. https:// doi. org/ 10. 1101/ 2020. 12. 22. 423965.
32. Cinatl J, Morgenstern B, Bauer G, Chandra P, Rabenau H, Doerr HW. Glycyrrhizin, an active component of liquorice roots, and replication of SARS-associated coronavirus. Lancet. 2003;361(9374):2045–6.
33. Su H-x, Yao S, Zhao W-f, Li M-j, Liu J, Shang W-j, et al. Anti-SARS-CoV-2 activities in vitro of Shuanghuanglian preparations and bioactive ingredients. Acta Pharmacologica Sinica. 2020;41(9):1167–77.
34. Crowley LC, Scott AP, Marfell BJ, Boughaba JA, Chojnowski G, Waterhouse NJ. Measuring cell death by Propidium Iodide uptake and flow cytometry. Cold Spring Harb Protoc. 2016. https:// doi. org/ 10. 1101/ pdb. prot0 87163.