近日,领星与中山大学第一附属医院张弩教授合作撰写学术论文「Circular RNA-encoded oncogenic E-cadherin variant promotes glioblastoma tumorigenicity through activation of EGFR–STAT3 signalling」,发表于「Nature Cell Biology」,IF:20.042。

研究背景(Background)
胶质母细胞瘤(GBM)是一种常见的、恶性脑部神经肿瘤,其中约 50% 的患者携带驱动基因 EGFR 突变。
CirRNAs 通常代指闭合环状 RNAs,已有研究表明部分 circRNA 能够翻译成蛋白,参与调控神经发育等过程。然而,有关 circRNA 调控 GBM 发生的研究较为缺乏。
本研究中,作者鉴定出胶质母细胞瘤中高表达的环状 RNA(circ-E-Cadherin),其编码的蛋白能够特异性激活 EGFR-STAT3 促进 GBM 的发生。
研究结果(Results)
1,Circ-E-Cad 能够翻译成蛋白,且在 GBM 中高表达
作者分别通过 10 组配对的肿瘤组织及癌旁对照组织的转录组测序、核糖体印记测序分析,鉴定出 Circ-E-Cad 在肿瘤组织及 PDO(Patient Derived Organoid)中高表达。同时,circ-E-Cad 高表达肿瘤患者生存期更短。
进一步通过分析,作者发现 Circ-E-Cad 能够翻译成由 254 氨基酸组成的蛋白质,其末端由 14 个特异的氨基酸组成。
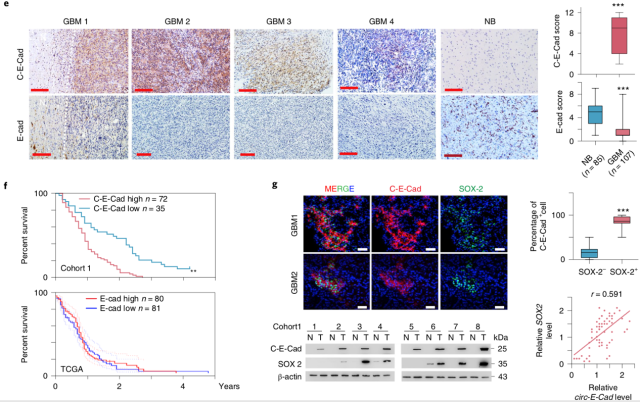
▲ Circ-E-Cad 在 GBM 中高表达且与预后相关
2,Circ-E-Cad 参与调控肿瘤的发生
作者分别在 GSCH2S 中构建 circ-E-Cad 过表达细胞系,在 GSC387 和 GSC4121 中构建 circ-E-Cad 敲减细胞系。通过细胞学实验证实 circ-E-Cad 与肿瘤细胞的干性相关,提示其参与调控了肿瘤的发生。
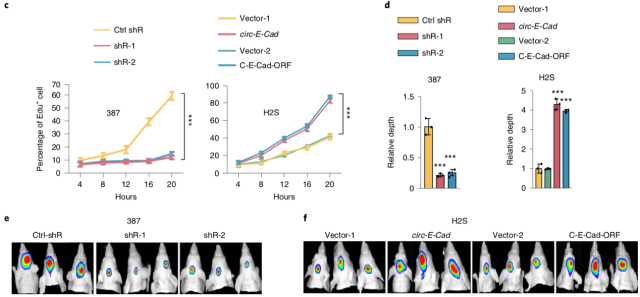
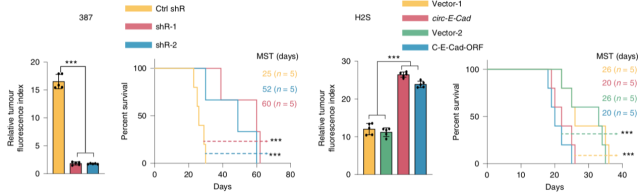
▲ Circ-E-Cad 参与调控肿瘤的发生
3,Circ-E-Cad 作为分泌蛋白,其 C 端与 EGFR 的 CR2 结构域结合
为了探究 circ-E-Cad 具体的调控机制,作者完成了 circ-E-Cad 末端蛋白的体外纯化,通过截断体等实验发现其 C 端能够特异性的结合 EGFR 的 CR2 结构域。
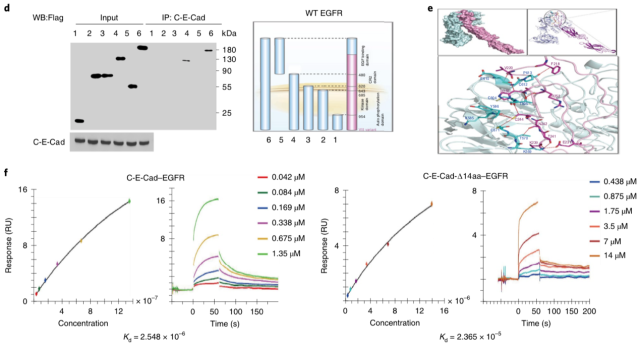
▲ Circ-E-Cad 与 EGFR 相互作用
4,Circ-E-Cad 是一种不依赖表皮生长因子的激活通路
已知 EGFR 能够受到表皮生长因子 EGF 的刺激,作者分别使用 EGF 和 circ-E-Cad 与细胞孵育,发现 EGF 并不能激活下游 STAT3 等蛋白磷酸化,而 circ-E-Cad 则能够激活 STAT3 的磷酸化,这说明 circ-E-Cad 是一种不依赖于 EGF 的信号途径。
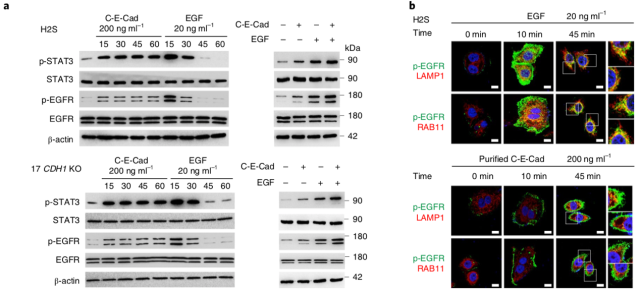
▲ Circ-E-Cad 不依赖于表皮生长因子激活
5,靶向 Circ-E-Cad 能够增强抗 EGFR 抗肿瘤活性
最后,作者分别探究了 EGFR 抑制剂、circ-E-Cad 抑制剂的抗肿瘤活性。体内实验结果证实,单独使用 circ-E-Cad 抑制剂组的抗肿瘤效果明显优于单独使用 EGFR 抑制剂组。同时,当两种抑制剂同时使用时,具有最好的抗肿瘤活性。
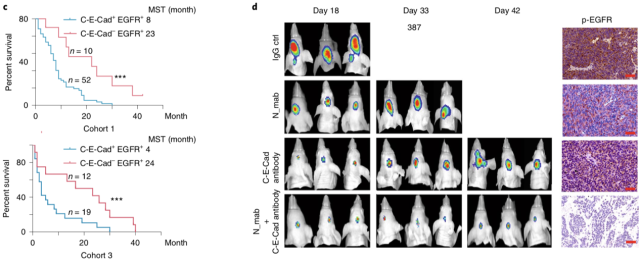
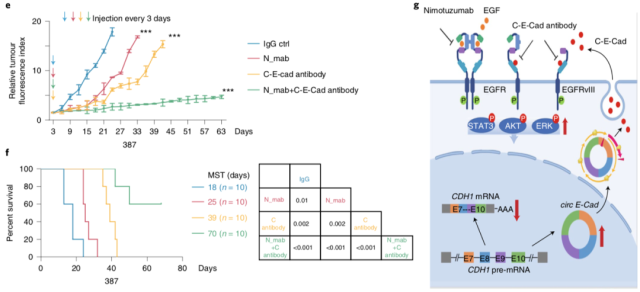
▲ Circ-E-Cad 抑制剂具有明显的抗肿瘤活性
研究结论(Conclusions)
本研究中,作者阐述了环状 RNA 编码的蛋白(circ-E-Cad)通过激活 EGFR-STAT3 信号通路调控胶质母细胞瘤的发生。此外,circ-E-Cad 抑制剂与 EGFR 靶向药物联合治疗有望成为脑胶质瘤治疗方案。
参考文献(References):
1. Reifenberger, G. et al. Advances in the molecular genetics of gliomas—implications for classification and therapy. Nat Rev Clin Oncol. 14, 434–452 (2017).
2. Aldape, K. et al. Challenges to curing primary brain tumours. Nat Rev Clin Oncol. 16, 509–520 (2019).
3. Neftel, C. et al. An integrative model of cellular states, plasticity, and genetics for glioblastoma. Cell 178, 835–849.e21 (2019).
4. Kristensen, L.S. et al. The biogenesis, biology and characterization of circular
RNAs. Nat Rev Genet. 20, 675–691 (2019).
5. Vo, J. N. et al. The landscape of circular RNA in cancer. Cell 176, 869–881. e13 (2019).
6. Comeau, S. R., Gatchell, D. W., Vajda, S. & Camacho, C. J. ClusPro: a fully automated algorithm for protein–protein docking. Nucleic Acids Res. 32, W96–W99 (2004).
7. Garrett, T. P. et al. Crystal structure of a truncated epidermal growth factor receptor extracellular domain bound to transforming growth factor alpha. Cell 110, 763–773 (2002).
8. Wells, A. et al. Ligand-induced transformation by a noninternalizing epidermal growth factor receptor. Science 247, 962–964 (1990).
9. Mellinghoff, I. K. et al. Molecular determinants of the response of glioblastomas to EGFR kinase inhibitors. N Engl J Med. 353, 2012–2024 (2005).
图片来源:领星