肺癌是我国及世界范围内发病率和死亡率最高的恶性肿瘤之一。但近年来,随着新的药物及新的疗法不断涌现并应用于临床,尤其是靶向治疗的出现,突破了肺癌治疗的瓶颈,使得 5 年生存率不断提高。EGFR 是 NSCLC 中最常见的突变类型,EGFR-TKI 演绎了肺癌精准治疗领域的一个传奇,经过 10 余年的研究探索,EGFR-TKI 药物更新迭代,EGFR 突变 NSCLC 细分为不同的亚型,不同 EGFR 突变亚型的 NSCLC 在选择 TKI 治疗时也各有侧重。第二代 TKI 药物达可替尼凭借在 ARCHER 1050 研究中为初始治疗的 EGFR 突变阳性晚期 NSCLC 的带来 OS 的改善,于 2018 年和 2019 年分别获得 FDA 和 NMPA 的批准成为 EGFR 突变 NSCLC 一线治疗的选择之一。
在 2020 版的《中国临床肿瘤学会(CSCO)非小细胞肺癌诊疗指南》也将达可替尼作为 EGFR 突变阳性晚期 NSCLC 的一线治疗(Ⅰ级推荐,IA 类证据)[1],为 EGFR 突变 NSCLC 一线治疗提供了更多治疗选择。在此背景下,本报邀请吉林省肿瘤医院程颖教授就此次指南中关于达可替尼进入晚期 EGFR 突变 NSCLC 一线治疗的相关证据进行介绍。
本文专家 
达可替尼为晚期患者带了总生存获益
2018 年 4-5 月间对 4 个国家(美国 n = 100,德国 n = 70,日本 n = 70,中国 n = 70)的 310 名医生(肺病专家及肿瘤科、胸外科和呼吸内科专家)就 EGFR 突变阳性 NSCLC 患者的治疗选择进行线上调研,结果显示:延长总生存期(OS)是处方 EGFR TKIs 的重要标准 [2]。
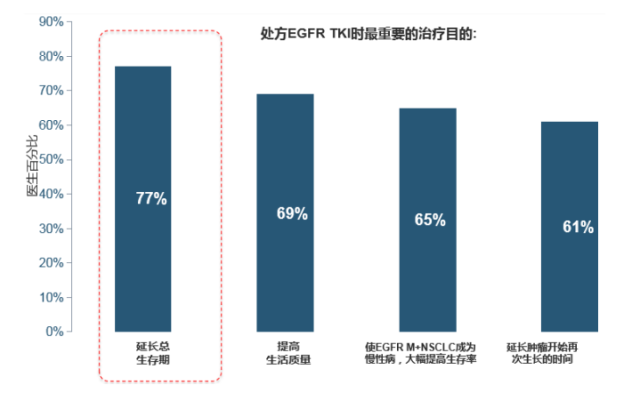
处方 EGFR TKI 时最重要的治疗目的
ARCHER 1050 研究中,在整体人群中达可替尼使 OS 延长了 7.1 个月(中位 OS:34.1 个月 vs 27.0 个月,P = 0.0155),而且在亚裔人中达克替尼有更好的 OS 获益,中位 OS 达到了 37.7 个月,而对照组为 29.1 个月,延长 8.6 个月,(HR = 0.759, P = 0.0457)。另外 19del 和 21 L858R 突变患者均可从达可替尼的治疗中取得 OS 获益,尤其是对 L858R 突变患者有更显著的 OS 改善(HR 0.665,P = 0.0203)。
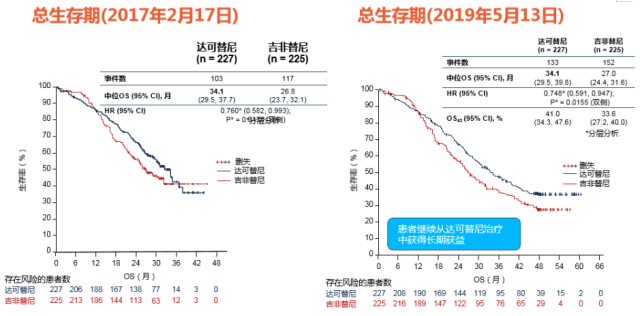
ARCHER 1050 研究显示,随着时间延长,两条生存曲线完全分开
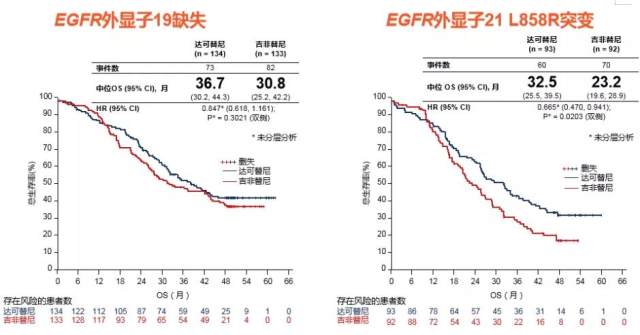
ARCHER 1050 研究显示,达可替尼对不同 EGFR 突变状态,均有 OS 获益
合理选择治疗方案,有效延长患者生存期
对于晚期 NSCLC 如何选择用药顺序,是直接用三代,还是「一代+三代」,还是「二代+三代」?研究显示,三代 EGFR TKI 奥希替尼治疗后耐药机制复杂,后续治疗方案有限。无论一线还是二线,治疗失败后,在较多的患者中观察到了多种共存的分子分型的改变 [3]。二代 EGFR TKI 获得性耐药机制与一代相似 [4],ARCHER 1017 显示:达可替尼耐药患者中 50% 以上会出现 T790M 突变 [5],提示达可替尼耐药后仍有半数患者可接受三代药物继续治疗。二代药物治疗后,相较一代 T790M 克隆同质性更高,可延迟获得性耐药发生 [6]。
另外,有研究发现 T790M 阳性患者中,一代序贯奥希替尼与二代序贯奥希替尼缓解率(RR)和疾病控制率(DCR)存在明显差别。与一代序贯三代相比,二代序贯奥希替尼 PFS 可延长 6.7 个月 [7]。
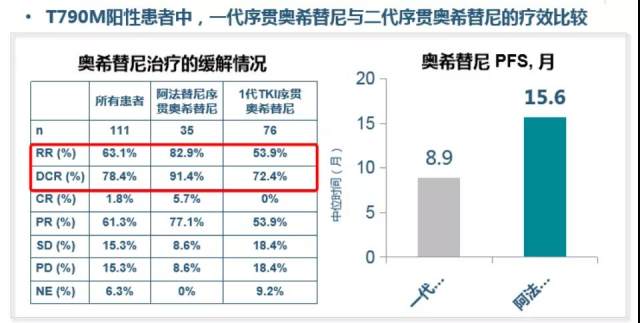
二代 EGFR TKI 治疗后 T790M 阳性患者序贯三代 EGFR TKI 的疗效
基于 ARCHER 1050 研究数据,达可替尼序贯三代 EGFR TKI 可带来确切的临床获益,是一种令人满意的治疗方案 [8]。
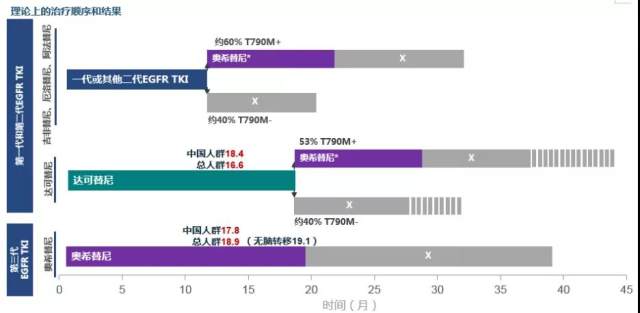
一代、二代和三代一线治疗后不同方案生存获益对比
综合治疗使肺癌变为慢性病成为可能
目前 ALK 突变的肺癌患者,使用靶向药物组合后,平均生存期已经接近 5 年,越来越符合世界卫生组织(WHO)对慢性病的定义。携带 EGFR 敏感突变的晚期肺癌患者,如果一线使用达可替尼,平均 OS 也已经接近 3 年。配合更多后续治疗,部分患者将有机会把肺癌变成慢性病。肺癌的治疗从传统治疗方式发展到现在的靶向、免疫治疗,大大改善了肺癌的预后。通过合理的规范化诊疗以及前沿技术,我们相信肺癌可以慢慢地转变为像糖尿病、高血压一样的慢性疾病,让肺癌患者长期生存。
参考文献
1. 中国临床肿瘤学会(CSCO)非小细胞肺癌诊疗指南(2020 版). 北京:人民卫生出版社.
2. Wehler T, et al. Oncologist Treatment Considerations and Selection in EGFR M+ NSCLC. Poster #P3.01-108 presented at WCLC 2018.
3. Leonetti A, et al. Br J Cancer. 2019 Oct;121(9):725-737.
4. Cabanero M, et al. Curr Oncol. 2017;24(2):111-119.
5. Jänne PA, et al. Lancet Oncol 2014;15:1433-41.
6. Kohsaka S, et al. Future Oncol. 2019 Feb;15(6):637-652.
7. Tamiya M, et al. Anticancer Res. 2019 Jul;39(7):3923-3929.
8. Sun H, Wu YL. Future Oncol. 2019 Aug;15(23):2769-2777.