自从 2015 年美,中两国陆续站在国家战略层面的高度推出了「精准医疗计划」后,「精准医疗」四个字就一直受到了社会各界的广泛关注。
在上一期的稿件中,小编给大家简单梳理了一下 Biomarker 的市场现状和发展趋势以及 FDA 对于 Biomarker 的申报流程。而在这一期的内容则主要包括针对 FDA 的申报要求我们如何来组织 biomarker 发现实验。通过 OVA1® 这个成功的案例,我们具体,详细的来分析一下蛋白质组学用于 biomarker 发现的成功经验。
符合 FDA 申报要求的 biomarker 发现研究
随着组学技术的发展以及组学技术被日益应用于 biomarker,尤其是癌症 biomarker 的发现研究中,早在本世纪初,NCI (National Cancer Institute) 就组织成立了 Early Detection Research Network (EDRN)。该组织成立的目的就在于协调 biomarker 开发实验室,验证实验室,临床试验机构和人群筛查项目,建立一个正式的 biomarker 开发框架来确保整个 biomarker 发开过程的效率和严谨[1]。和治疗性药物的开发一样[2],癌症 biomarker 的开发也存在着一个类似的正式框架(formal structure),该框架由 Margaret Sullivan Pepe 等人提出,并被 EDRN 所采纳,发表于 2001 年[3]。当然该框架更多的还是基于询证医学的思路。在该框架体系下,整个 biomarker 的发现被分成五个步骤:
Phase I: Preclinical Exploratory Studies (Promising directions identified)
整个 biomarker 发现的第一步是在实验室进行的临床前探索性研究,旨在找出可以用于下游继续评估的 1 个或多个 promising tumor marker,并对这些可能的 marker 的优先级进行排序。两种典型的发现思路,高通量的非靶向策略和基于假设的靶向发现策略在这一步中均可采用。在这一个步骤中,主要需要考虑以下一些因素: 样本数量, 入组标准, 样本收集处理条件, 分析方法, 统计方法,以及在 independent 数据集中进一步验证表达差异结果等。
Phase II: Clinical Assay Development for Clinical Disease (Clinical assay detects established disease)
和 Phase I 不同的是,Phase II 的研究需要选定最终用于临床检测的方法。因为更多的时候我们希望进行无创的筛查,那么在可能的情况下,如果 Phase I 的 biomarker candidate 是在病灶组织上筛选出的,那么在 Phase II 中就需要到移植到如血浆等可无创获得的样品上来评价这个 biomarker 是否还能在肿瘤病人和正常人群中有差异表达。因此,Phase II 的主要目的,就是采用最终应用于临床的方法来评价这些 biomarker 区分癌症病人和正常人群的真阳性率(true-positive rate, TPR),假阳性率(false-positive rate, FPR)或者 ROC 曲线。在 Phase II 中,我们需要对该检测方法的技术表现(analytical performance),例如定量准确性、重复性、线性范围、交叉携带污染等以及临床表现(clinical performance),例如预测灵敏度、特异性、ROC 等进行评估。另外还有两点在 Phase II 的研究中也需要特别注意。一是考察一些其他临床因素,例如性别,年龄,吸烟史等会否影响 biomarker 的临床表现,是否需要针对这些因素进行阈值调整等。二是考察 biomarker 和肿瘤的分期,病理以及预后之间的关系,因为一个能够发现早期癌症的 biomarker 相对于一个晚期才有表现的 biomarker 来说要有意义的多。
Phase III: Retrospective Longitudinal Repository Studies
对于早期筛查来说,一个 biomarker 如果仅在癌症能明确诊断前非常短的时间内才能区分疾病与正常,那么这个 biomarker 对于早期筛查来说就意义不大,相反若能越早区分疾病和正常,那么这个 biomarker 对于早期筛查来说意义重大。因此 Phase III 最为主要的目的即为确定在临床诊断前,biomarker 发现早期疾病的能力,并且制定筛查阳性的标准,为 Phase IV 做准备。
Phase IV: Prospective Screening Studies
Phase IV 的主要目的是在真正的人群筛查临床试验中确定该 marker 的 PPV(positive predictive value) 和 NPV (negative predictive value) 。在前面 1-3 期的研究中,我们都是采用事先收集的样本进行的回顾性研究,而在 Phase IV 则需要进行基于人群的前瞻性研究。一般来说,癌症的发病率都很低,因此进行早期筛查的前瞻性研究就需要数量相当可观的人群入组。因而为了临床试验的可操作性,在该框架下允许对同一人群进行阶段性检测来满足人群数量的要求。
Phase V: Cancer Control Studies
在 Phase V 中,最主要的任务就是评估在人群,乃至整个社会群体的水平上,采用基于该 biomarker 的筛查,是否能带来整体获益(overall benefit)。因为种种因素,例如缺乏有效干预手段,是否存在过度诊疗等问题等,即便这个 biomarker 确实能对癌症进行早期筛查,也不一定就能在人群水平上降低癌症带来的负担。
2001 年发表的这份指导框架确实非常系统,严谨,乃至严苛的描述了整个 biomarker 开发的流程,并且该框架更多的是针对了早期筛查类型 biomarker。那么下面我们就从 OVA1® 这个实例来看一下,我们如何去有效的面对或者回避一些问题,来实现 biomarker 从发现到临床的转化之路。
OVA1® 方法和背景简介
OVA1® 是目前唯一一个 FDA 批准上市的并且通过蛋白质组学手段发现的 biomarker。 其是在病人已经诊断出患有卵巢囊肿并已经由医嘱决定手术的情况下,通过对外周血中 5 个 protein biomarker panel 的检测来得到一个数值,该数值高于阈值表示病人肿瘤恶性的可能性高,此时需安排妇科肿瘤专家(Gynecologic Oncologists, GOs)来进行手术,而数值低于阈值表示肿瘤良性的可能性高,此时只需要普通的妇产科医师(OB/GYN)来进行手术即可(图 1)。
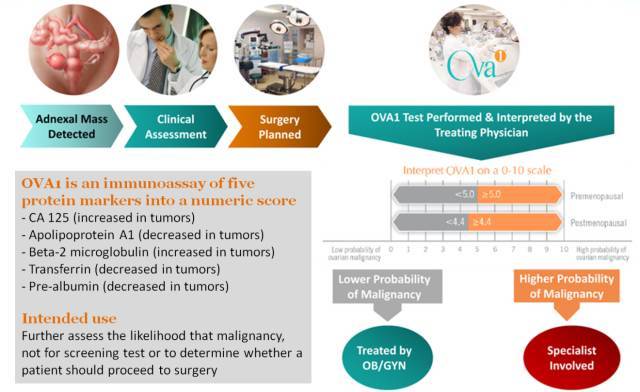
图 1. 卵巢癌生物标志物 OVA1® 方法简介
我们简单的看一下美国卵巢癌的流调数据来体会 OVA1® 检测的临床意义。在美国,女性卵巢癌终生的发病概率约为 1.3%。每年约有 1,000,000 的女性检查出卵巢囊肿,其中约 22,000 例最终被确诊为癌症。在这 22,000 例病人中,仅有 19% 的病人能在癌症转移前被诊断为恶性肿瘤,并且仅有 1/3 的癌症病人在初次手术阶段就由妇科肿瘤专家进行手术治疗(有很多询证证据表明由妇科肿瘤专家来进行卵巢癌切除手术能显著改善卵巢癌病人的预后),最终导致每年大于 15,000 例女性死亡。在 OVA1® 发现以前,卵巢肿瘤的诊断主要依靠妇科检查,CA125 和阴超等手段,而卵巢的生理位置决定了其难以通过手术以外的方式进行活检,并且在美国合格的妇科肿瘤专家数量有限,因此缺乏有效的术前诊断手段和足够的医疗资源导致了卵巢癌高居不下的死亡率(图 2)。
OVA1® 的发现阶段研究
OVA1® 的发现阶段研究开始于本世纪初,由 Johns Hopkins 的 Zhang Zhen 等人开展[4, 5]。该研究是一个包含了 500+例样本,4 个中心的多中心,Case-Control 的回顾性研究(图 3)。在 discovery phase, 作者将来自于两个中心的样本分成两个独立的 discovery set, 分别在当地采用 SELDI-MS 进行高通量的蛋白质组学差异分析,经过交叉验证筛选 candidate biomarker signature. 随后采用独立的 validation set 对筛选出的表达差异进行验证(红色框)。在临床多因素预测模型构建阶段(黄色框),作者将上述的两个 discovery set 用于建立训练集和组内测试集,随后又采用独立的 validation set 来对预测模型进行评估。由于 SELDI-MS 本身并不能给出蛋白质的鉴定信息,在通过上述两步评估(表达差异评估和预测模型评估)后,作者对筛选出的 biomarker signature 进行了蛋白质的鉴定,随后又采用免疫学检测在另一个独立测试集中(蓝色框)中对这些表达差异进行了验证。
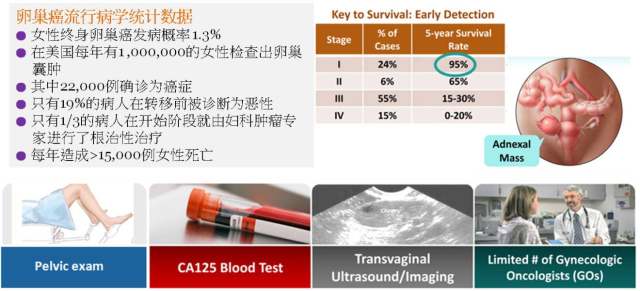
图 2. 美国卵巢癌流行病学调查数据
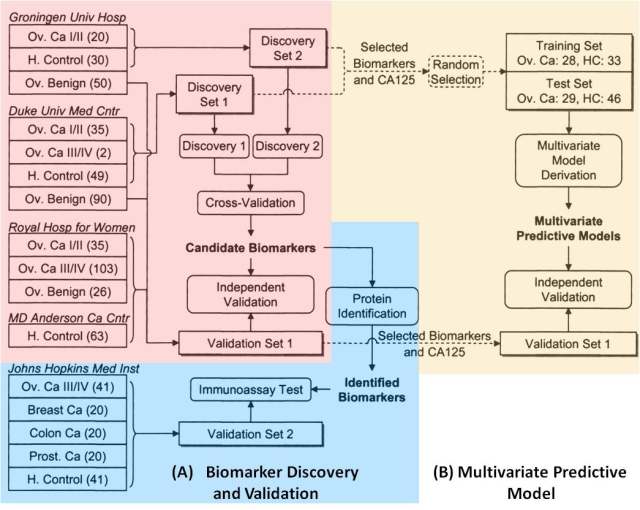
图 3. OVA1® 的发现阶段研究实验设计
OVA1® 从发现到临床的转化
其实截止到上一步为止,已有相当多的文献报道了类似的工作,那么下面我们就把关注点放在更核心的部分,即 biomarker 从发现到临床的转化。实际上 OVA1® 的发现者也已经不止一次撰文针对这些问题阐述了自己的观点和经验[6, 7]。小编把作者的一些观点进行了整理和大家一起分享。
1. 多变量预测模型(Multivariate Index Assay)
虽然在我们现在看来 Biomarker panel 已经不是什么新奇的概念,但在当时 FDA 所批准的 Biomarker panel 屈指可数,例如基于 microarray 的指导乳腺癌患者术后用药的 biomarker panel MammaPrint 等[8]。当然这里指的 Biomarker panel 并不是将这些 marker 分开测量分别考虑,而是将这些 marker 一次测量,得到的结果通过一些诸如 logistic 回归之类的预测模型来综合考虑,最终得到一个统一的阈值。实际上在 OVA1® 发现的最初阶段并未包含 CA125 这一个经典的 marker, 在后续的验证工作中作者发现将 CA125 也纳入 biomarker panel 更有利于将癌症和正常进行区分,尤其是对于早期的癌症病人(图 4)。
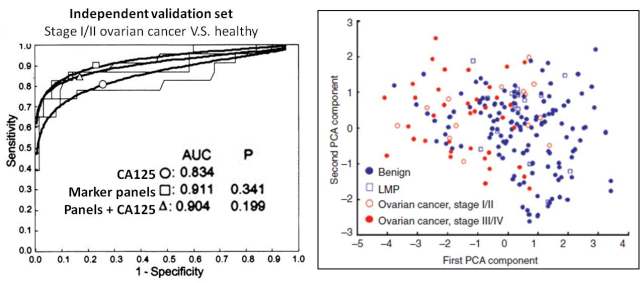
图 4. OVA1® 多因素预测模型临床表现
2. 选择合适的最终临床检测方法
目前 FDA 批准上市的商品化的 OVA1® 是通过 immunoassay 来检测这五个蛋白质的含量,从而整合成一个最终的分数。实际上,在方法开发前期,作者曾尝试采用 SELDI-MS 来作为最终临床检测的方法,但最终 SELDI 方法的重现性还是达不到日常临床检测的要求[6]。在上一期的稿件中,我们提到 FDA 在受理 biomarker 申请的时候,供应商需要提供非常详尽的技术方法的描述,包括方法的定量准确性(precision), 重现性(reproducibility),携带交叉污染(carry over),线性范围,检测特异性等等,关于 OVA1® 的分析方法的表现(analytical performance)请大家参考 FDA 数据库上的材料[12]。
3. 选择合适的临床预期应用
我们在 biomarker 开发的初期当然非常希望自己所发现的标志物可以对疾病进行精准的诊断并且用于对疾病的早期筛查,但随着开发过程的不断推进,我们必须要在临床意义的普适性和完成临床试验的可行性以及得到监管部门批准的可能性之间做出平衡和妥协(图 5)。这个问题是 OVA1® 的开发者最为强调的一点,在图 5 中,作者假想了一个早期筛查的 marker OCaScr 来和 OVA1® 进行比较[7]。由于 OVA1® 是一个治疗方案选择的 marker,只有决定进行手术治疗的病人才需要进行该项检测,那么在这个人群中检测得到的阳性率就很高,因此在设计临床试验时的人群就不需要非常大。反之,OCaScr 作为一个早期筛查 marker, 就需要在整个人群中去进行筛查,介于美国女性卵巢癌终生的发病概率约为 1.3%,那么得到阳性筛查结果的概率就会非常低,因此在设计临床试验时就需要一个非常大的样本量。此外,OVA1® 检测如若发生假阳性,其后果也并不严重,就是让妇科肿瘤专家来切了个良性肿瘤而已,比起早期筛查假阳性所带来的心理恐惧和过度医疗并不是什么大事。并且 OVA1® 能够作为治疗方案选择的 marker 也是基于由妇科肿瘤专家来进行卵巢癌切除手术能显著改善卵巢癌病人的预后这个既有事实的。
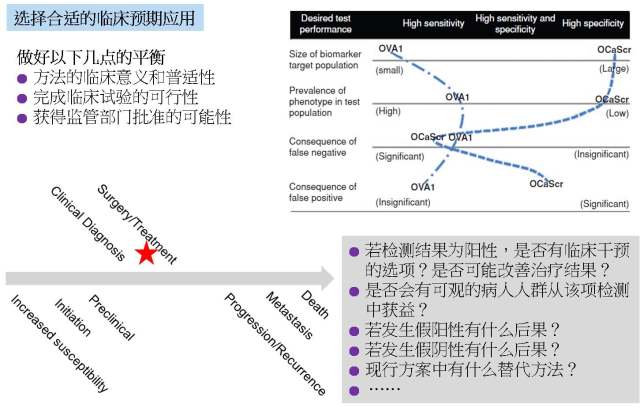
图 5. Biomarker 从发现到临床的转化: 选择合适的临床预期应用
4. 固定的阈值用于日常临床检测
在最初的实验室阶段我们可以选择非常多样的预测模型(例如主成分分析,支持向量机等)来进行疾病和正常的分类,但到了日常临床检测的阶段,我们就需要更实际的固定阈值来进行阳性和阴性判断。对于 OVA1® 这个实例来说,检测假阴性带来的不良后果远大于假阳性(假阴性的后果为让普通妇产科医师来切恶性肿瘤,假阳性的后果为让妇科肿瘤专家来切良性肿瘤),因此在阈值确定时需要优先考虑的是 NPV(negative predictive value),即要让检测判定为阴性的病人确实是良性肿瘤。在上面讲到的正式框架的 Phase II 中,我们需要考虑一些其他的临床因素是否需要独立的去设置阈值,那么对于 OVA1® 来说,是否绝经就是一个需要另外考量的因素(图 6)。
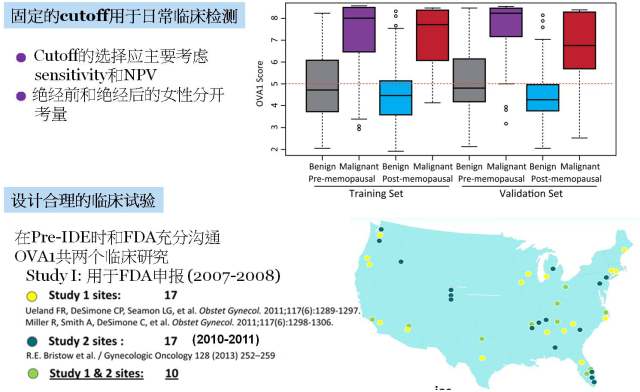
图 6. Biomarker 从发现到临床的转化: 固定阈值的确定和临床试验设计
5. 设计合理的临床试验
对于以 de novo pathway 申报的新发现的 biomarker, 大多数情况下 FDA 会要求供应商进行前瞻性的临床试验。到目前为止,OVA1® 一共进行了两个较为大型的临床试验[9-11],包含了四十多个 clinical sites, 其中第一个临床试验用于向 FDA 进行初次申报[10, 11]。
OVA1® 的临床研究
那么下面我们就简单的来看一下 OVA1® 用于向 FDA 进行初次申报的临床试验。这个临床试验是一个多中心,随机双盲的前瞻性研究,包含 27 个 clinical sites, 500+个病例(图 7)。在进行完临床信息收集并决定采取手术治疗后,共有 524 个病例入组,这 524 个病例随后在第三方实验室(Quest)进行 OVA1® 的检测,然后根据随机双盲原则分入四组:Arm 1, OVA1 alone; Arm 2, CA125 alone; Arm 3, 手术前临床判断; Arm 4, OVA1 + 临床判断。这 524 个病人根据现行 ACOG 指南决定执行手术的医师级别,并以术后病理为金标准来评估上述四组的预测方法对于卵巢癌良恶性的判断。
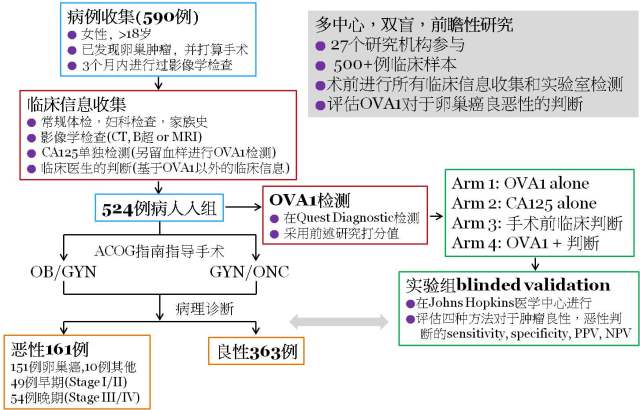
图 7. OVA1® 临床试验的实验设计
临床试验结果显示,OVA1® 的使用显著增加了卵巢癌预测的 sensitivity 和 NPV(图 8 红框), 但也较大程度的降低了 specificity 和 PPV(图 8 绿框)。由于 OVA1® 检测假阴性的不良后果远大于假阳性,因此 NPV 的提升是一个更为决定性的因素。此外,更值得注意的是,相较于 CA125, OVA1® 对于早期肿瘤(Stage I/II)预测的 sensitivity 有了非常显著的提高(94% V.S. 61%),而早期癌症的诊断将对病人的预后带来更为实质性的获益,因此这也成为了 OVA1® 能够被 FDA 批准上市的重要筹码之一。
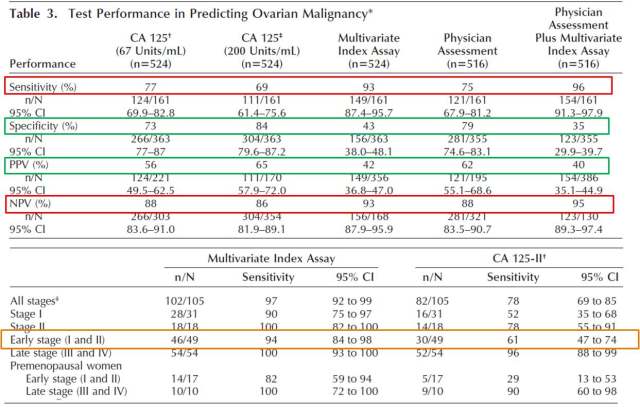
图 8. OVA1® 临床试验结果简述
下期预告
在本期中,小编通过 OVA1® 这个具体实例和大家聊了聊如何来根据 FDA 的申报要求来组织 biomarker 发现实验。那么下期中我们将会回到蛋白质组学技术层面,来看一看在 biomarker 发现的各个细分阶段所需要采用的技术手段。
特此鸣谢撰稿人——唐家澍工程师
参考文献
1. Srivastava,S. and B.S. Kramer, Early detectioncancer research network. Lab Invest, 2000. 80(8): p. 1147-8.
2. ICH Harmonised Tripartite Guideline. Statisticalprinciples for clinical trials. International Conference on Harmonisation E9Expert Working Group.Stat Med, 1999. 18(15): p. 1905-42.
3. Pepe,M.S., et al., Phases of biomarkerdevelopment for early detection of cancer. J Natl Cancer Inst, 2001. 93(14): p. 1054-61.
4. Rai,A.J., et al., Proteomic approaches totumor marker discovery. Arch Pathol Lab Med, 2002. 126(12): p. 1518-26.
5. Zhang,Z., et al., Three biomarkers identifiedfrom serum proteomic analysis for the detection of early stage ovarian cancer.Cancer Res, 2004. 64(16): p.5882-90.
6. Fung,E.T., A recipe for proteomics diagnostictest development: the OVA1 test, from biomarker discovery to FDA clearance.Clin Chem, 2010. 56(2): p. 327-9.
7. Zhang,Z. and D.W. Chan, The road from discoveryto clinical diagnostics: lessons learned from the first FDA-cleared in vitrodiagnostic multivariate index assay of proteomic biomarkers. CancerEpidemiol Biomarkers Prev, 2010. 19(12):p. 2995-9.
8. Tian,S., et al., Biological functions of thegenes in the mammaprint breast cancer profile reflect the hallmarks of cancer.Biomark Insights, 2010. 5: p.129-38.
9. Bristow,R.E., et al., Ovarian malignancy riskstratification of the adnexal mass using a multivariate index assay.Gynecol Oncol, 2013. 128(2): p.252-9.
10. Ueland,F.R., et al., Effectiveness of amultivariate index assay in the preoperative assessment of ovarian tumors.Obstet Gynecol, 2011. 117(6): p.1289-97.
11. WareMiller, R., et al., Performance of theAmerican College of Obstetricians and Gynecologists' ovarian tumor referralguidelines with a multivariate index assay. Obstet Gynecol, 2011. 117(6): p. 1298-306.
12. http://www.accessdata.fda.gov/cdrh_docs/reviews/K150588.pdf