美国当地时间 3 月 13 日,赛默飞宣布其诊断检测方案获得美国食品和药物管理局 (FDA) 发布的一项紧急使用授权 (EUA),可立即被美国 CLIA 认证实验室用于导致 COVID-19 的 SARS-CoV-2 病毒核酸检测。该检测不用于任何其他病毒或病原体。
本次授权的检测方案使用了赛默飞 Applied Biosystems TaqPath Assay 技术,包括从样本制备到仪器分析,实验室在收到患者样本 4 小时之内即可提供检测结果。
授权检测方案已经经过优化并可用于赛默飞 Applied Biosystems 7500 Fast Dx Real-time PCR 仪。该仪器也在 EUA 授权范围内,并且已经在世界各地临床实验室中广泛使用。
赛默飞世尔科技董事长、总裁兼首席执行官葛士柏先生 (Marc N. Casper) 表示: 「赛默飞提供的针对 COVID-19 的诊断检测方案获得授权,将有助于保护患者,并使医务人员能够迅速做出反应,提供治疗,防止感染的蔓延。赛默飞一直致力于帮助客户使世界更健康、更清洁、更安全。通过与 FDA 和世界各地的监管机构合作,我们将持续致力于扩大诊断检测方案的可用性,进一步防止疾病传播。」
诊断获得授权的背后,是赛默飞的技术加持——今年 1 月底,在国家应急部门公布新型冠状病毒全基因序列之后,赛默飞迅速推出并不断更新整体解决方案:从核酸提取的快速制备,到由 WHO 世界卫生组织认可的荧光定量 PCR,再到实验室管理和安全防控̷̷目前,赛默飞还不遗余力帮助客户解析病毒结构,加速疫苗开发,推出聚焦于疫苗和科研整体解决方案。
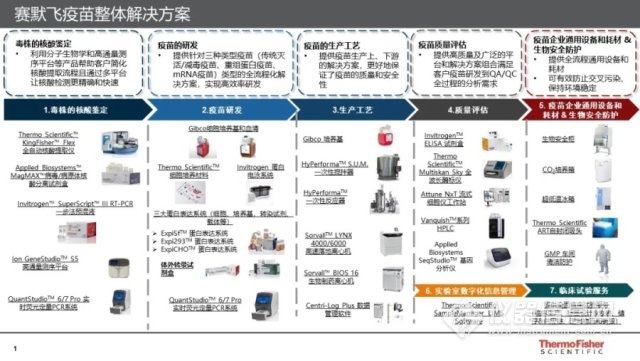
▲《赛默飞疫苗整体解决方案》
上述产品描述仅限疫苗研发生产用途
图片来源:赛默飞