蛋白标签界的实力「小鲜肉」,「万能」蛋白标签 HiBiT,凭实力万能,没流量就没天理了。

在说 HiBiT 是什么之前,我们先来看 HiBiT 能做什么:
1. 蛋白降解检测
2. 无需抗体的蛋白 Blotting 检测
3. 免疫沉淀蛋白定量
4. 受体内化
5. GPCR 研究
6. 生长因子检测
7. 细胞表面受体转运
8. 蛋白质/细胞因子分泌
9. 细胞杀伤
10. 自噬
11. 病毒研究
…
荣获过 The Scientist 杂志评选出的 2017 年度十大创新产品的 HiBiT 技术,到底是凭什么走上开挂的人 (标签) 生呢?
这要从另外一个专利技术,NanoLuc® 萤光素酶讲起。NanoLuc® 是一个经过基因工程改造的小分子酶(19.1kDa),是性能卓越的生物发光报告基因。NanoLuc® 萤光素酶在 2012 年上市当年也被被 The Scientist 杂志评选为年度十大创新产品。


NanoLuc 的最主要特点就是——小和亮!
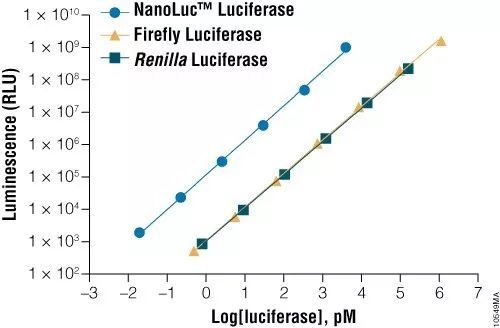
这个亮度有多亮呢?我们看下面这个图表:
我们可以看到,相同数量的 NanoLuc,发光的亮度要比萤火虫和海肾这两位前辈高出两个数量级!拥有如此之高的亮度,最大的意义就是能为我们的实验提供无与伦比的灵敏度和检出下限。同时 NanoLuc 萤光素酶还有高达八个数量级的动态范围,远远高于荧光标记(4 个数量级)和显色法(2 个数量级),可以减少我们的预实验工作量。
故事讲到这里,HiBiT 自带光环要登场了!
进而科学家发现,在第 156 和第 157 碱基的位置咔嚓一刀,可以将 NanoLuc® 切成一大一小两个亚基(分别是 11aa 的小亚基,和 156aa 的大亚基 LgBiT),没有最小,只有更小!这两个亚基分开时都不具有发光活性,但是组合起来之后,又能够恢复萤光素酶的活性!两个亚基之间具有极高的亲和力。
一个标签的自我修养——怎样成为一个优秀的标签?
一、体积小

对于一个标签来说,首先它应该是很小,完美的融入到目标蛋白中,HiBiT 就是这样一个很袖珍的标签,它只有 11 个氨基酸的长度,几乎不会影响目标蛋白的正常功能。

那么标签太大会有什么后果呢?如果标签过大,很可能会影响与之融合蛋白的正常构象,以及对正常转运和功能产生影响,这样做出来的实验结果可能就会偏离真相哦,如果您在研究中有这方面顾虑的话,可以考虑一下 HiBiT 系统哦!
与 CRISPR 双剑合璧用于 Endogenous Biology 研究
由于 HiBiT 标签很小,当 CRISPR/cas9 技术出现之后,我们可以直接将 HiBiT 标签加入到内源目标蛋白上,对内源蛋白的正常功能和调控网络的影响也最小化,所获得的结果更能反映真实机理,从图中我们可以看到内源表达的倍比响应是最高的。
Promega 同时提供已经构建好的 CRISPR Knock-in 细胞系,您可直接购买使用,无需自行构建细胞系。您也可选择使用 HiBiT 蛋白标签载体自行构建。
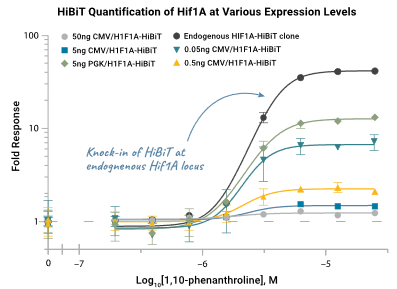
上图:研究缺氧诱导条件下 HiFiA 蛋白的积累
我们可以看到,随着携带外源表达蛋白的瞬转质粒浓度的增加,同样的药物处理带来的蛋白表达响应(Fold Response)会逐渐减小,这是由于外源蛋白在持续表达启动子(CMV 或者 PGK)的启动下,不断在细胞内积累,这种积累的蛋白往往超出了细胞本身的蛋白降解水平,这些大量存在而无法及时降解的外源蛋白会形成一个巨大的本底值,即便药物处理能够产生一些表达上的变化,也往往被这个巨大的本底消弭于无形。这种情况下减小外源质粒的浓度或者使用更温和的启动子(例如从 CMV 变成 PGK),能够在一定程度上改善这种情况。

二、功能多
小而明亮的 HiBiT 蛋白标签,配合上 3 种检测类型的检测系统,可以实现多种蛋白功能的研究,实力演绎」万能」蛋白标签。
检测系统:
• 印记检测系统:Nano-Glo® HiBiT Blotting System
• 裂解检测系统:Nano-Glo® HiBiT Lytic Detection System
• 细胞外检测系统:Nano-Glo® HiBiT Extracellular Detection System
01 无需抗体的蛋白 Blotting 检测
HiBiT 系统提供了一种方便的基于印迹膜的检测方案,对于无需精确定量的融合蛋白检测来说,比 WB 更加方便和快速。
由于 HiBiT 和 LgBiT 的结合是高度特异性且结合力非常强,带有 HiBiT 蛋白标签的蛋白无需对转印膜进行封闭,所获得的结果背景更加干净,不会出现由于封闭不充分,或者封闭试剂(尤其是脱脂奶粉)结块造成的脏背景。
无需一抗二抗的孵育和清洗,实验时间大幅缩短,往常需要几乎一天的实验流程,如今很快就能获得结果。
不用考虑抗体的非特异性结合或者结合力低造成的检出限度下降,HiBiT 与 LgBiT 的高度亲和力以及高灵敏度的萤光素酶反应能够确保检测得到极少量(飞克级)的蛋白存在。

电泳和转印之后,可以直接使用 HiBiT 印迹检测系统进行目标蛋白的亲和杂交,然后通过萤光素酶反应进行条带的发光检测。由于不需要封闭和抗体,相比 Western Blot 既省时又省力。

02 目标蛋白定量
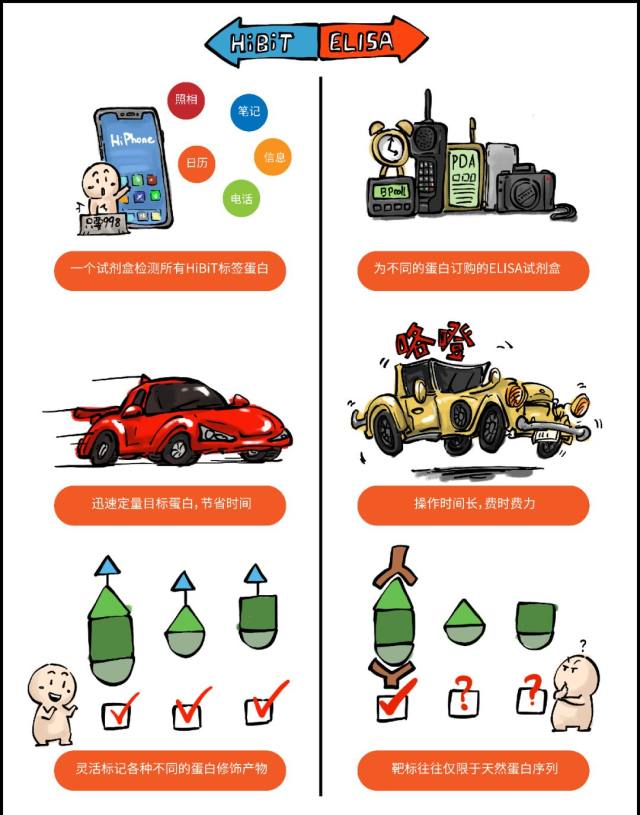
过去如果我们要对样品中某个蛋白进行精确定量,首先就会想到使用 ELISA 试剂盒,但是如果实验室有多个蛋白需要研究,那么就需要订购多个 ELISA 试剂盒。HiBiT 则不同,只要是使用了 HiBiT 技术的蛋白,就都可以使用通用的检测试剂盒进行检测。
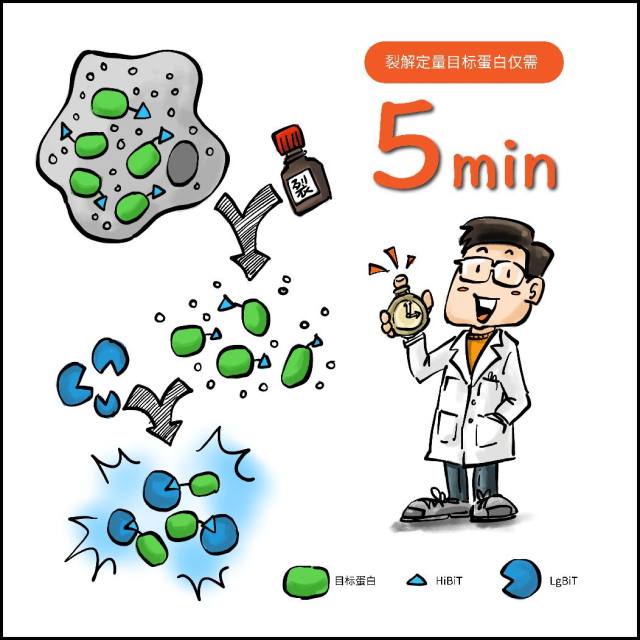
HiBiT 进行裂解后定量蛋白速度非常快(只需 5 min),而 ELISA 则需要前后数个小时的时间。
假如我们需要对目标蛋白进行一些改造和修饰,那么基于抗原抗体反应的 ELISA 实验就出现了局限性,绝大部分 ELISA 试剂盒都是针对天然构象的蛋白进行的生产,很可能找不到能够检测某些改造后蛋白的试剂盒。这种情况下,HiBiT 作为一种通用的依赖于标签的检测手段就有了用武之地。
03 蛋白质/细胞因子分泌

HiBiT 胞外检测系统专门为研究外泌蛋白或者细胞膜表面蛋白而设计。试剂本身不含有裂解组分,其中的 LgBiT 只能和细胞膜表面或者分泌到培养基中的 HiBiT 蛋白结合,可以很轻松的对分泌到胞外或者细胞膜表面的受体蛋白进行检测。

由于细胞无需裂解,因此细胞样品还可以进行其他的细胞分析(例如细胞毒性、细胞凋亡等)以及分子生物学(提取 DNA、RNA)等实验操作。以前需要为多个检测准备多组样品,如今工作量也大大简化。了解相关产品信息请点击此处。
04 受体研究
在细胞膜受体研究中,有时候需要研究膜受体内化的调控。在过去的研究中,需要使用专门的提取试剂盒甚至于超速离心的方法分别分离得到细胞膜和胞浆的蛋白,并通过 ELISA 或者 WB 等技术进行定量或半定量研究,不仅操作步骤复杂,而且提取过程中还可能伴随着蛋白的降解从而导致数据不准。而使用 HiBiT 技术之后,我们所需要做的就是用非裂解法来定量细胞膜外表面的受体蛋白,然后通过整体裂解来获得所有的受体蛋白,这样就可以轻松的获得全部和内化受体的比例信息。

图片来源:普洛麦格