多发性骨髓瘤是常见疾病,但和慢性中性粒细胞白血病同时并存的情况及其罕见,查阅文献目前全世界报道的仅几十例。但临床中也陆续发现在髓系白血病诊断及治疗过程中会出现单克隆浆细胞增多的情况,并且部分病例最终发展称为髓系肿瘤和多发性骨髓瘤并存。这类疾病少见,尚需积累更多的病例进行评估,以发现其可能的发病机制和临床特征。
患者男,68 岁,以「发现白细胞增高 11 月余,乏力 1 月」为主诉入院。
现病史:11 个月前发现白细胞增高,具体不详,未诊治。1 个月前感乏力,活动后气促,心慌,伴腹胀、纳差,伴反复全身皮疹,瘙痒,可自行消退,无发热、咳嗽,无腹痛、腹泻,无鼻衄、牙龈出血等,未予重视,后上述症状逐渐加重。既往病史无特殊。入院查体:神清,精神欠佳,贫血貌,全身皮肤粘膜无明显出血斑点,浅表淋巴结未触及肿大,胸骨无压痛。脾脏极度肿大,达脐水平线以下,质硬,无压痛。
门诊血常规:WBC: 54.99 ×109/L 中性粒细胞占 94.9 %↑,嗜碱性粒细胞占 0.1%,Hb: 65 g/L(MCV: 96.0 fL MCH: 29.6 pg)PLt: 83×109/L,Ret: 4.06 %。血沉:139 mm/H。肝功能:总蛋白 104.9 G/L、白蛋白 33.2 G/L、球蛋白 71.7 g/L。发病以来,食欲较差,近半年体重减轻约 10 kg。
初步诊断思路:病史近 1 年,病程较长,提示慢性疾病过程。有腹胀、纳差、皮疹,体重减轻,有巨脾,相关检测外周血白细胞增高,以中性粒细胞增高为主,以上证据提示骨髓增殖性疾病,首先考虑慢性粒细胞白细胞。贫血相关的症状逐渐加重,与血常规血红蛋白水平一致,肝功能检测球蛋白升高,白/球蛋白比值减低,需要注意有没有浆细胞的问题,虽然患者没有腰痛等症状,但仍不能排除浆细胞疾病的可能。另外体重减轻明显,皮疹伴瘙痒,还要排除可能的淋巴增殖性疾病。所以,初步诊断为:1、骨髓增殖性疾病-CML? 2、浆细胞增殖性疾病:多发性骨髓瘤? 3、淋巴细胞增殖性疾病:淋巴瘤?
入院后完善相关检测,结果如下:肿瘤标志物:大致正常。影像学检查:胸部及骨盆平片:未见明显异常。生化:LDH: 157.7 U/L,IgG: 40.98↑ g/L,lgA: 0.61↓ g/L,IgM: 0.83 g/L.
骨髓细胞形态学:骨髓取材一般,涂片/染色良好。脂肪滴 (-)、骨髓小粒 (-)。骨髓有核细胞增生减低,粒系比例占 92.5%,以成熟粒细胞多见,粒细胞内颗粒增多。幼红细胞罕见,成熟红细胞呈缗钱状排列。淋巴细胞/单核细胞形态未见明显异常。全片仅见巨核细胞 3 个,血小板呈散在分布。NAP 染色:阳性率 98%,积分 312 分。血片:成熟红细胞呈缗钱状排列,未见有核红细胞。血小板呈散在分布。见图 1
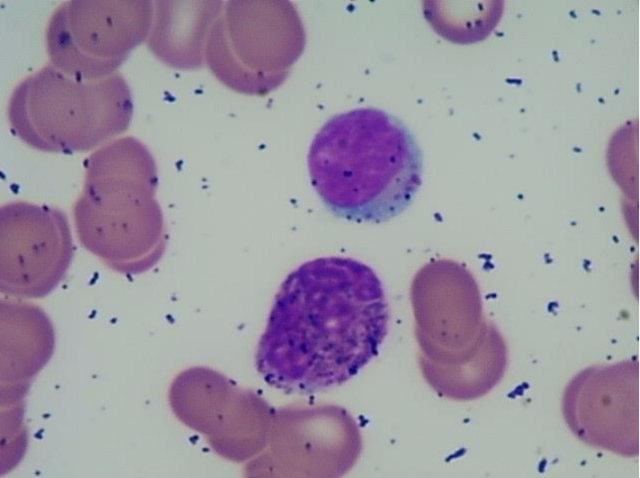
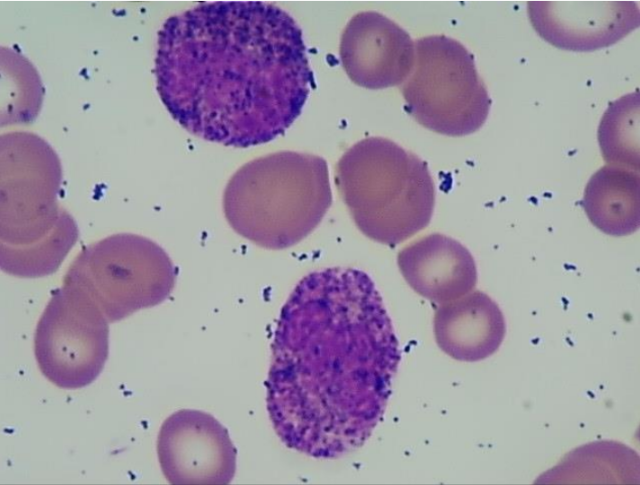
图 1 骨髓细胞形态学,成熟中性粒细胞颗粒增多,成熟红细胞呈缗钱状排列
骨髓活检:骨髓有核细胞增生程度不宜评估;粒/红比例不宜评估,粒系细胞少见,红系细胞少见,巨核细胞偶见。部分区域浆细胞多见;骨髓间质组织挤压明显;免疫组化:CD38 灶+,CD138 灶+,κ 灶(+);γ(-),CD20-,CD34 小血管+,CD117(-),CD61 巨核细胞偶见(+)。网染 3 级。意见:结合免疫组化,考虑浆细胞骨髓瘤伴骨髓纤维化。见图 2
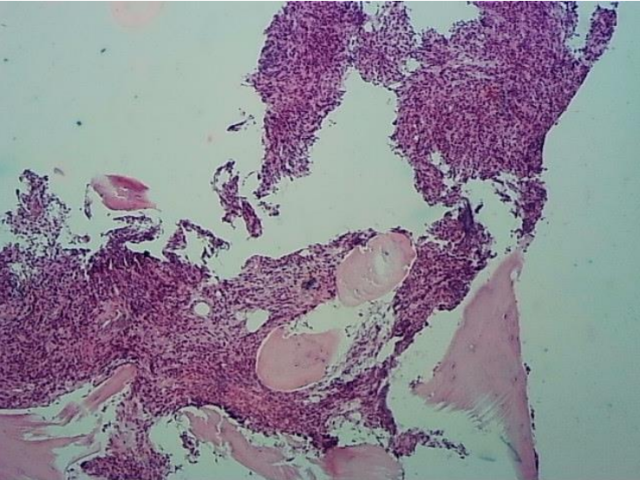
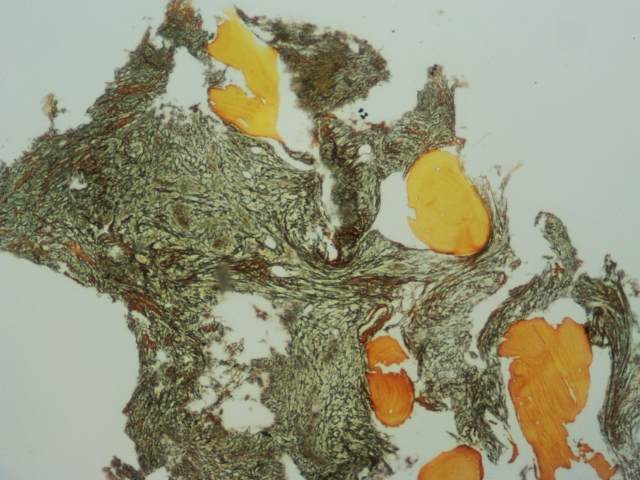
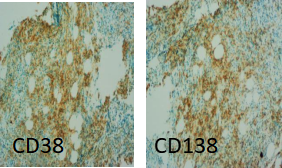
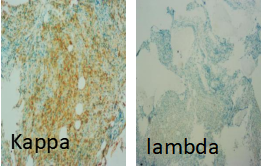
图 2 骨髓活检:HE 染色、网染、组化 CD38、CD138、Kappa、lambda
流式细胞术:流式标本中未见明显的原始细胞,可见较成熟的粒系细胞比例明显增多,占有核细胞总数 94.3%,其免疫表型 CD11b,CD16,CD13,CD15 未见明显异常,淋巴细胞中 T、B、NK 细胞其免疫表未见明显异常,未检测到明显的 CD38+,CD138+; 的浆细胞. 见图 3
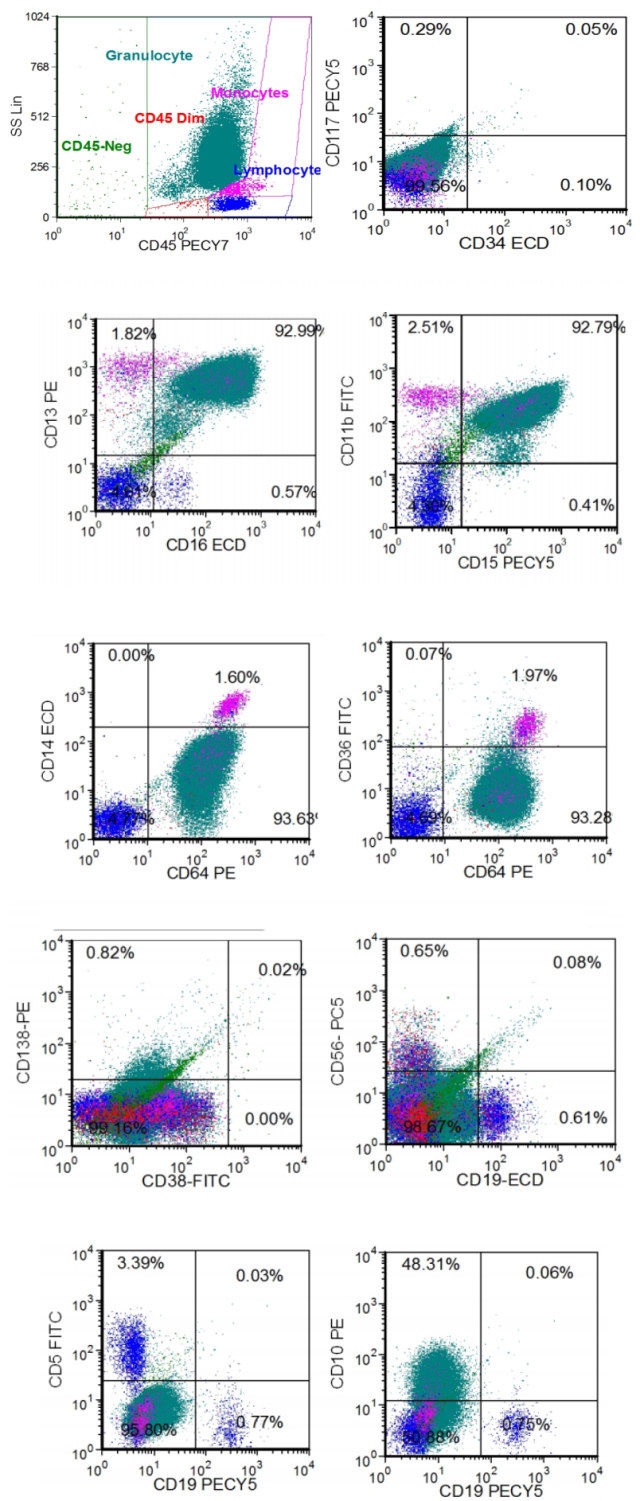
图 3 流式细胞术免疫表型分析
细胞遗传学检测:
骨髓细胞染色体核型分析:细胞生长不良,多次制片,仍未见可分析的分裂相。
BCR/ABL(FISH)检测:阴性。
MPN 相关分子学检查:JAK2-V617F 定量检测阴性。JAK2(外显子 12/13)突变阴性。CALR 基因突变阴性。MPL 基因突变阴性。MYD88 基因突变阴性。
分析:基于初步诊断,完善了骨髓形态学、流式免疫表型分析、染色体核型分析、FISH 检测、MPN 4 基因分子学检测。骨髓形态学检测骨髓涂片增生减低,粒系比例占 92.5%,以成熟中性粒细胞为主,NAP 积分增高。流式表型分析同样表现为中性粒细胞为主,占有核细胞总数 94%。骨髓涂片及流式检测的特点与外周血白细胞分型一致,并且均未发现异常的浆细胞。 另一方面,骨髓活检免疫组化 CD38 灶+,CD138 灶+,κ 灶(+),γ(-),网染 3 级。CD38、CD138 灶阳,提示骨髓内异常浆细胞增多,κ 灶(+)提示浆细胞为单克隆浆细胞,符合浆细胞肿瘤伴纤维化 3 级。
进一步分析:骨髓活检检测到大量的异常浆细胞,但骨髓涂片和流式均未检测到,应考虑是因为骨髓纤维化 3 级,以及肿瘤性浆细胞在骨髓内灶性生长的特点,所以骨髓涂片和流式收到标本稀释和涂片穿刺部位的影响,另外浆细胞是 B 细胞的终末期细胞,而肿瘤性的浆细胞自身更加脆弱一下,流式在标本处理过程中会丢失部分浆细胞,所以本例的骨髓涂片和流式未检测到异常浆细胞,但骨髓活检弥补了这个缺陷。
再进一步分析:骨髓涂片和流式以中性成熟粒细胞为主,骨髓活检提示纤维化 3 级,标本稀释还是髓系肿瘤?因为本例病史近 1 年,均以白细胞增高为主,且患者有巨脾,而多发性骨髓瘤通常不会有脾大,巨脾的情况,所以从这一点应考虑髓系肿瘤。本例外周血白细胞增高,>25×109/L,中性杆状核核中性分叶核粒细胞 >80%,幼稚阶段粒细胞 <10%,单核细胞计数 <1×109/L,无粒细胞发育异常。骨髓涂片虽增生减低,但与骨髓纤维化有关,涂片以中性粒细胞增生为主,NAP 积分增高。有巨脾。MPN 相关的基因检测阴性(包括 BCR-ABL、JAK2-V617F、CALR、MPL),综上,可以排除慢性粒细胞白血病、Ph-的骨髓增殖性肿瘤(PV、ET、PMF),但形态学特点及体征,需考虑慢性中性粒细胞白血病(CNL)。
基于以上分析,目前提示可能并存两种疾病:
1、浆细胞肿瘤--多发性骨髓瘤?
2、慢性髓系肿瘤--慢性中性粒细胞白血病(CNL)?
所以,需进一步完善诊断这两个疾病的相关检测,包括多发性骨髓瘤相关的 M 蛋白检测;诊断 CNL 特征性的分子学标记 CSF3R 基因突变检测。
M 蛋白鉴定:血清蛋白电泳和尿蛋白电泳图谱中均发现异常单克隆条带。血清免疫固定电泳:单克隆免疫球蛋白类型为 IgG-κ 型。 尿本周氏蛋白阳性,类型为 κ 游离轻链型。见图 4
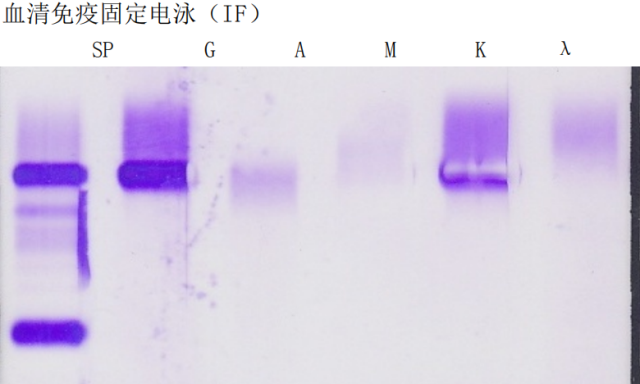
图 4 血清免疫固定电泳检测:单克隆免疫球蛋白类型为 IgG-κ 型
针对 CNL 的分子生物学检查:CSF3R 基因外显子 14 突变(-),外显子 17 检测到突变(+)。
本例最终诊断:
1、多发性骨髓瘤(MM;IgG-κ 型)
2、慢性中性粒细胞白血病(CNL)
分析与总结:慢性中性粒细胞白血病(CNL)是一种罕见的 BCR-ABL 融合基因阴性的骨髓增殖性肿瘤,而合并多发性骨髓瘤的病例更是罕见。本例的诊断难点在于:
1、骨髓增殖性肿瘤的鉴别诊断,包括慢性粒细胞白血病(CML)、慢性中性粒细胞白血病。两者外周血和骨髓都是粒系增生,以中性粒细胞为主,但各有特点。CML 以中性中幼粒、晚幼粒细胞为主,NAP 积分减低,而 CNL 以成熟阶段中性杆状及分叶核粒细胞为主。但两者确诊的关键在于遗传学的异常,CML 有特征性的 Ph 染色体和或 BCR-ABL 融合基因,而 CNL 有特征性的 CSF3R 突变。本例形态学的骨髓涂片提供了 CNL 的线索,最终通过 MPN 排除性的分子学检测包括 BCR-ABL、JAK2、CALR、MPL,和确诊性的 CSF3R 突变,明确了 CNL 的诊断。
2、骨髓涂片和流式免疫表型分型未检测到浆细胞的证据,但是骨髓活检浆细胞多见,特别是免疫组化 CD38 灶阳,CD138 灶阳,以及 κ 灶(+),γ(-),证实灶性分布的浆细胞是单克隆性质。为什么骨髓涂片及流式未检测到浆细胞,其主要原因在于,该骨髓纤维化严重,网染 3 级,所以导致标本的稀释,同时还有疾病本身特点,如异常浆细胞灶性分布,所以涂片对浆细胞的评估不如骨髓活检,另外流式在处理标本的时候也存在细胞丢失、破碎的情况,所以出现了阴性的检测结果,但通过原因分析及免疫组化,证实灶性单克隆浆细胞瘤的存在,充分体现了疾病的特点和多平台综合评估的重要性。本例通过进一步行 M 蛋白鉴定,明确了单克隆免疫球蛋白类型为 IgG-κ 型,结合患者有贫血症状,诊断为多发性骨髓瘤(MM),建议临床进一步结合影像学检测(CT 或 MRI,如果是 X 线,需包括头颅、脊柱、肋骨、骨盆等部位)等检测寻找异常浆细胞损伤靶器官的证据,包括 CRAB 症状和 SLiM 症状。
3、本例的骨髓纤维化引起的不同标本检测结果的差异性,其纤维化的形成原因,一方面髓系肿瘤会伴发继发性的纤维化,而 30% 左右的浆细胞肿瘤也会伴发骨髓纤维化,引起形态学检测浆细胞比例在骨髓涂片和骨髓活检上的差异性,所以强调浆细胞疾病骨髓涂片和活检同时送检的重要性。
4、本例对骨髓增殖性肿瘤相关疾病的诊断关键在于遗传学和分子学的应用,可以帮助临床建立确定性的诊断以及排除性的诊断,而分子学 CSF3R 突变的检测又为临床提供了治疗的靶点。CSF3R 基因突变形式主要包括: 外显子 14 近膜突变 (T615A 和 T618I 等) 以及外显子 17 截短突变 (D771fs, S783fs, Y752X, W791X) 等, 不同突变携带者会导致对酪氨酸激酶抑制剂的不同的敏感性, 携带 CSF3R 基因近膜突变的患者可能从 JAK 激酶抑制剂 (如 ruxolitinib) 中获益, 而发生截短突变的患者则可能对 Src 酪氨酸激酶抑制剂 dasatinib 高度敏感。
血液肿瘤性疾病相当复杂,WHO 造血和淋巴组织肿瘤诊断标准要求血液肿瘤要遵循 MICM(M-形态学、I-免疫学、C-细胞遗传学、M 分子生物学)的诊断原则。形态学和流式检测提供了快速的诊断线索和依据,而细胞遗传学和分子学检测对疾病的生物学特性进行评估,从遗传学角度明确诊断并提供疾病的治疗、预后等重要信息。各实验平台有其独特的特点,但又有各自的不足。所以,我们在血液病的诊断过程中要把疾病的特征和不同检测平台的特点相结合,合理选择检测平台和检测项目,使各检测评估相关补充和相互印证,以帮助临床更好的诊断和认识疾病。