

自体造血干细胞移植(ASCT)是淋巴瘤的有效治疗手段,ASCT 的成功与否与干细胞动员息息相关,外周血造血干细胞(PBSC)采集量越多,患者预后越佳。那么采取怎样的动员方案才能有效提高 PBSC 采集量呢?让我们一起来看看苏州大学附属第一医院的金正明教授是如何制定动员策略的。
病例 1:男性,26 岁
患者资料:2018 年 8 月因扁桃体反复发炎来院就诊,先后行扁桃体活检、PET-CT、免疫病理和淋巴瘤免疫分型检查。
检查结果
◉ 2018-8 扁桃体活检病理结果示:(双侧扁桃体)淋巴组织高度增生,结合免疫组化结果,倾向外周 T 细胞淋巴瘤。
◉ 2018-8 PET-CT 示:1. 全身多发淋巴结(扁桃体、咽旁、颌下、颈部、纵隔、腋窝、盆腔及腹股沟),部分相互融合,均伴葡萄糖代谢增高,符合淋巴瘤表现;2. 前纵隔软组织影,未见明显异常葡萄糖代谢增高,考虑囊肿不除外,建议随访。免疫病理:CD20(-)、CD79a(-)、CD3(+)、CD2(散在弱阳+)、CD10(-)、CD5(+)、CycilnD1(-)、Bcl2(+)、Bcl-6(-)、MUM1(-)、Ki-67(90%+)、MPO(-)、TDT(-)、CD123(-)、SOX11(-)。
◉ 2018-8 淋巴瘤免疫分型 (组织):分析见 98.6%CD45+SS 细胞群体,见 87.3% 幼稚细胞,符合 ETP 表型。
◉ 2018-8 淋巴瘤免疫分型 (骨髓):分析见 14.1% 的成熟淋巴细胞群体,未见异常表达。
诊断:外周 T 细胞淋巴瘤(PTCL)
初次动员治疗方案与采集结果
患者被诊断为 PTCL 后,于 2018 年 8 月 13 日至 12 月 20 日期间共接受 6 个疗程的 CHOPE 方案(环磷酰胺、阿霉素、长春新碱、强的松和足叶乙甙)+西达苯胺化疗,疾病完全缓解(CR)。
PTCL 具有恶性程度高、临床过程呈侵袭性、治疗效果差、预后不良等特点,目前尚无标准治疗方案,化疗后行 ASCT 治疗可能延长总生存期。为求进一步 ASCT 治疗,患者在移植前接受人粒细胞集落刺激因子(G-CSF)+普乐沙福动员方案——首先于 2019 年 5 月 3 日皮下注射 G-CSF(10 ug/kg/d,连续 5 天),随后于 5 月 6 日晚上 10 点皮下注射普乐沙福(0.24 mg/kg),最后于 5 月 7 日开始采集干细胞,动员和采集结果见图 1。
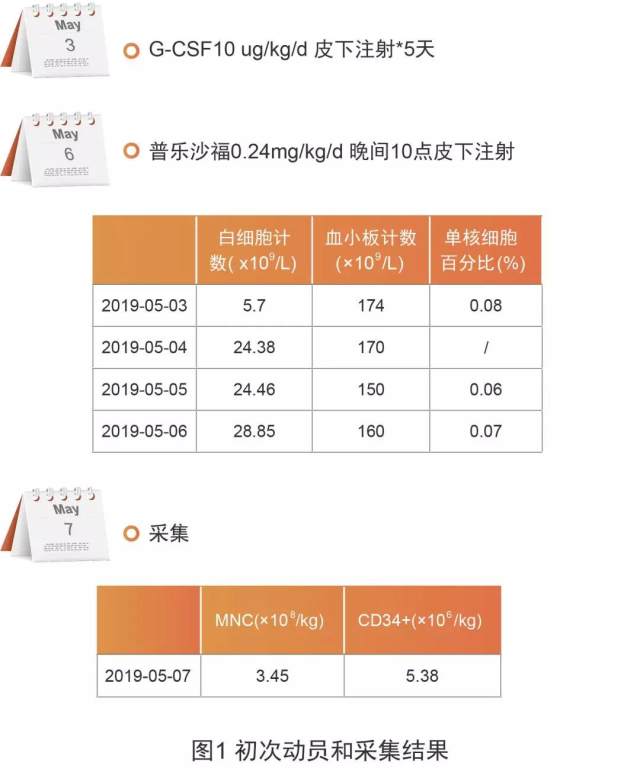
从以上采集结果可以看到,患者在接受 G-CSF 联合普乐沙福的动员方案后,首次采集便成功达到优质动员(CD34+细胞 ≥ 5×106/kg)。
病例 2:女性,49 岁
患者资料:2018 年 8 月因右侧腹股沟肿块伴低热盗汗来院就诊,查体:右侧腹股沟淋巴结肿大,约 2-3 cm,质硬,活动度差,无压痛,予抗炎治疗一周效果不佳。为进一步明确诊断,患者行病理、免疫病理和 PET-CT 检查。
检查结果
◉ 病理诊断:(由腹股沟淋巴结)淋巴组织增生性病变。
◉ 免疫病理:CD3(-)、CD20(+)、CD79a(+)、CD2(-)、CyclinD1(-)、sox11(-)、CD10(-)、Bcl-2(+70%)、Ki67(+60%)、Bcl-6(+)、MUM1(-)、CD19(+)、C-MYC(-)、CD5(-)、CD21(滤泡树突+),诊断为弥漫大 B 细胞淋巴瘤(生发中心型)。
◉ PET/CT 示弥漫大 B 细胞淋巴瘤确诊后:1. 全身多处肿大淋巴结,脾脏多处、均伴葡萄糖代谢增高,符合淋巴瘤表现。
诊断:弥漫大 B 细胞淋巴瘤(DLBCL)
患者被诊断为 DLBCL 后,于 2018 年 10 月至 2019 年 1 月共接受 6 个疗程的利妥昔单抗+CHOP(环磷酰胺、阿霉素、长春新碱和强的松)方案化疗。为观察疗效,患者在化疗期间进行 PET-CT 检查显示,病灶明显减少,代谢减低,提示利妥昔单抗+CHOP 化疗明显有效。
随后,患者又分别于 2019 年 2 月、3 月接受利妥昔单抗单药化疗,并在化疗结束后进行骨髓穿刺术和 PET-CT 复查:
◉ 2019-3 完善骨穿:二代测序检测到 KMT2C 突变(比例 4.4%),染色体、淋巴瘤免疫分型、FISH 均无异常。
◉ 2019-3 复查 PET-CT 示弥漫大 B 细胞淋巴瘤化疗后:左侧腋窝小淋巴结,脾大,均未见明显葡萄糖代谢增高,较前次 2018-12 检查相仿(2018-12:弥漫大 B 淋巴瘤化疗后:病灶明显减少,代谢减低,提示治疗明显有效)。
从复查结果来看,患者病情无明显变化,决定后续尝试 ASCT 治疗。《造血干细胞移植治疗淋巴瘤中国专家共识 (2018 版)》[1] 明确指出:对于治疗敏感的复发或原发难治(一线诱导治疗反应部分缓解、稳定或进展)的 DLBCL,可将 ASCT 作为标准的解救性巩固治疗策略。
与病例 1 中的患者一样,移植前该患者也采取 G-CSF 联合普乐沙福动员方案治疗——首先于 2019 年 5 月 17 日皮下注射 G-CSF(10 ug/kg/d ,连续 5 天),随后于 5 月 20 日晚上 10 点皮下注射普乐沙福(0.24 mg/kg),最后于 5 月 21 日开始采集干细胞,动员和采集结果见图 2。
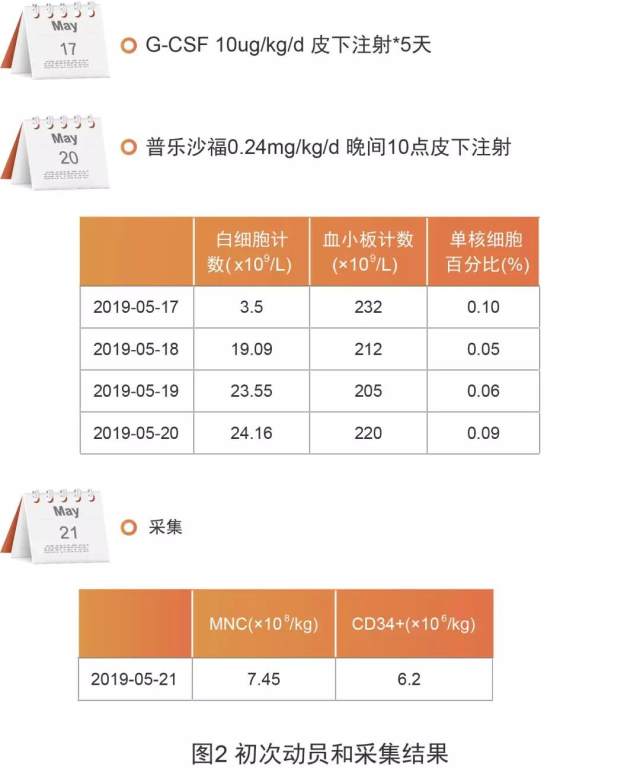
从以上采集结果可以看到,该患者首次采集同样成功达到优质动员(CD34+细胞 ≥ 5×106/kg)。
讨论
欧洲血液和骨髓移植学会(EBMT)专家组在立场声明 [2] 中指出,动员不良或失败的风险因素包括高龄、疾病晚期、既往接受大剂量或者多线化疗 [尤其是接受过氟达拉滨、来那度胺(尚存争议)、美法仑治疗的患者]、既往接受放疗、采集前外周血中 CD34+细胞计数低、动员前血小板计数低(尚存争议)。EBMT 建议,当患者具有 1 个或以上风险因素,应考虑尽早联用普乐沙福。以上 2 个病例动员前接受过多次化疗,出现了 EBMT 立场声明中列出的动员不良风险因素,可能导致动员结果不理想,进而影响 ASCT 顺利进行,因此这 2 例患者的动员策略都是在传统动员方案 G-CSF 的基础上联用普乐沙福,降低动员失败的风险,患者首次采集即实现优质动员。
2 例患者均在诱导治疗后达到 CR,EBMT 立场声明 [2] 推荐诱导治疗后达到 CR 的患者接受稳态动员,即不含化疗的动员方案。稳态动员对比非稳态动员(含有化疗的动员方案),主要的优势在于毒性相对较低、干细胞采集时间可以预测等,而 G-CSF 单药作为稳态动员方案存在动员失败和干细胞采集量小的风险 [3]。普乐沙福进入临床之后,大大改善了既往 G-CSF 单药动员的这一困境,G-CSF 联合普乐沙福进行动员不仅维持了稳态动员的优势,同时也提高了动员成功率甚至是优质动员成功率。来看看我国和美国的 III 期临床研究中这一新型动员方案的数据展示(表 1)[4,5]:
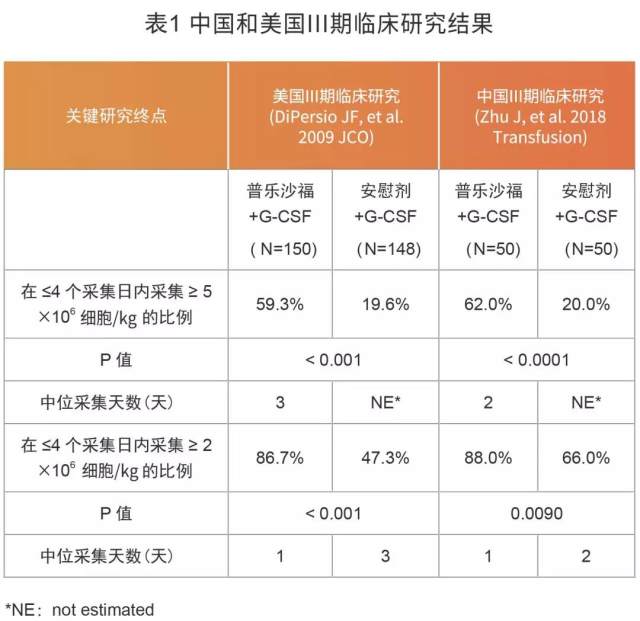
从表中数据来看,中国 III 期研究和美国 III 期临床研究均显示普乐沙福+G-CSF 的疗效优于安慰剂+G-CSF,普乐沙福组有更多患者达到优质动员,且达到这一目标的采集天数明显缩短。该研究结果证实以上两例淋巴瘤患者之所以首次采集即可达到优质动员,普乐沙福起到了功不可没的作用。
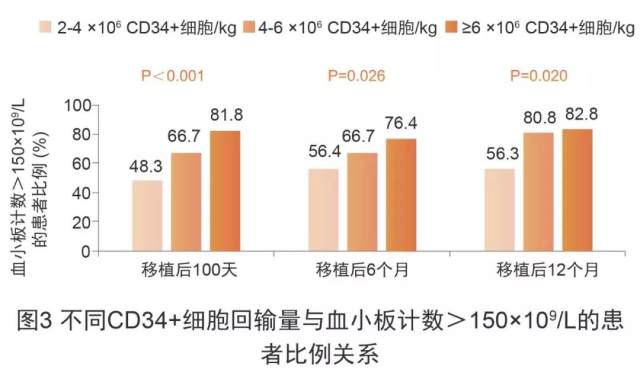
2014 年 ASBMT 指南 [6] 明确指出,较高的干细胞剂量有助于血小板和中性粒细胞更快植入并降低感染率和非复发死亡率,表明 PBSC 采集量越多,患者预后越佳。一项预后分析 [7] 纳入 438 例接受 ASCT 的非霍奇金淋巴瘤或多发性骨髓瘤患者,比较使用普乐沙福联用 G-CSF vs. 安慰剂联用 G-CSF 作为干细胞动员方案的 2 个多中心、III 期临床研究数据,结果显示 CD34+细胞回输量 ≥ 6×106CD34+细胞/kg 组第 100 天、6 个月、12 个月时血小板计数>150×109/L 的患者比例高于 2-4×106CD34+细胞/kg 组和 4-6×106 CD34+细胞/kg 组,这表明优质动员与 ASCT 后长期血小板恢复更优相关(图 3)。
另一项研究还发现优质动员显著改善 ASCT 后患者长期生存,一项单中心回顾性分析 [8] 纳入 270 例行 ASCT 的多发性骨髓瘤患者,其中 242 例为优质动员,28 例为动员不佳(在最多 5 个单采日内采集到<4×106 CD34+细胞/kg,或达到这一目标需要 ≥ 2 个动员周期),结果显示优质动员组患者的无进展生存期(PFS)和总生存期(OS)显著高于动员不佳组(图 4)。
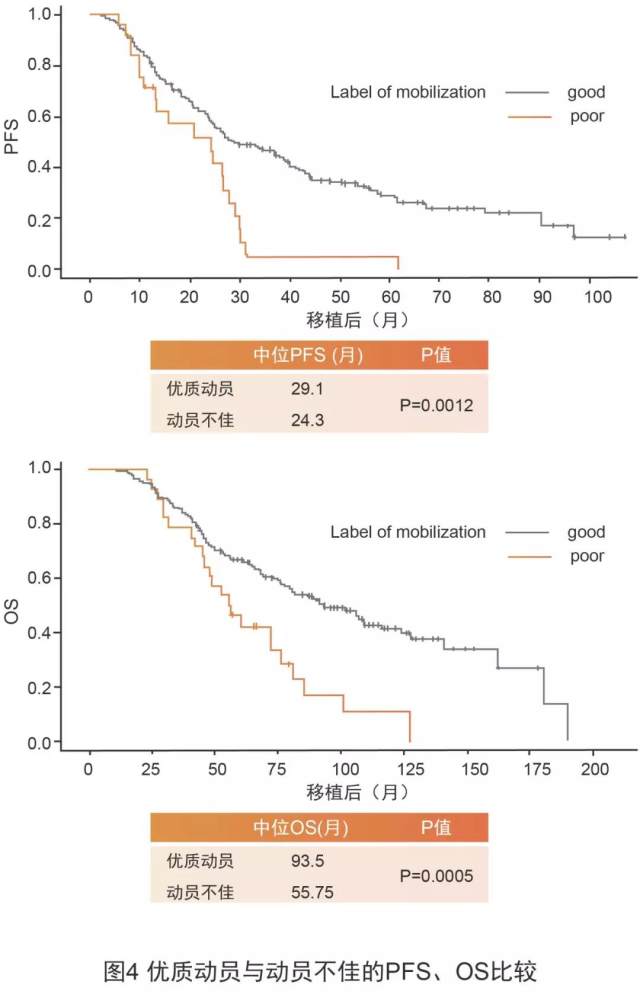
可见,优质动员可帮助患者更快重建造血功能,并减少出血、感染等并发症,进而改善生存 [9,10]。普乐沙福在中国获批之后,给需要进行造血干细胞移植的患者带来了新的动员方案选择,临床患者的应用结果也在真实世界中印证了 III 期临床研究的结果,凸显普乐沙福优秀的动员能力。
参考文献
1. 中国抗癌协会血液肿瘤专业委员会, 中华医学会血液学分会白血病淋巴瘤学组, 中国临床肿瘤学会抗淋巴瘤联盟. 造血干细胞移植治疗淋巴瘤中国专家共识 (2018 版). 中华肿瘤杂志.2018.40(12):927-934.
2. Mohty M, Hübel K, Kröger N.et al. Autologous haematopoietic stem cell mobilisation in multiple myeloma and lymphoma patients: a position statement from the European Group for Blood and Marrow Transplantation. Bone Marrow Transplant. 2014 Jul;49(7):865-72.
3. Carreras E, Dufour C, Mohty M et al. The EBMT Handbook for Hematopoietic Stem Cell Transplantation and Cellular Therapies. EBMT, 2019. https://www.ebmt.org/education/ebmt-handbook
4. Zhu J, Huang H, Chen H,et al. Plerixafor and granulocyte-colony-stimulating factor for mobilization of hematopoietic stem cells for autologous transplantation in Chinese patients with non-Hodgkin's lymphoma: a randomized Phase 3 study. Transfusion. 2018 Jan;58(1):81-87.
5. DiPersio JF, Micallef IN, Stiff PJ,et al. Phase III prospective randomized double-blind placebo-controlled trial of plerixafor plus granulocyte colony-stimulating factor compared with placebo plus granulocyte colony-stimulating factor for autologous stem-cell mobilization and transplantation for patients with non-Hodgkin's lymphoma. J Clin Oncol. 2009 Oct 1;27(28):4767-73.
6. Duong HK, Savani BN, Copelan E.et al. Peripheral blood progenitor cell mobilization for autologous and allogeneic hematopoietic cell transplantation: guidelines from the American Society for Blood and Marrow Transplantation. Biol Blood Marrow Transplant. 2014 Sep;20(9):1262-73.
7. Stiff PJ, Micallef I, Nademanee AP, et al. Transplanted CD34(+) cell dose is associated with long-term platelet count recovery following autologous peripheral blood stem cell transplant in patients with non-Hodgkin lymphoma or multiple myeloma.Biol Blood Marrow Transplant. 2011 Aug;17(8):1146-53.
8. Moreb JS, Byrne M, Shugarman I, et al. Poor peripheral blood stem cell mobilization affects long-term outcomes in multiple myeloma patients undergoing autologous stem cell transplantation.J Clin Apher. 2018 Feb;33(1):29-37.
9. 冯祥艳. 冯四洲. 郑以州. 外周血干细胞动员研究现状. 中华血液学杂志 2011; 32(2):142-144.
10. 黄晓军. 实用造血干细胞移植 [M]. 北京: 人民卫生出版社.2014.
审批号:SACN.PLE.19.10.13308 有效期至2021年4月