在刚刚结束的ESMO-ASIA(欧洲肿瘤内科学大会-亚洲)大会上,PD-1免疫检查点抑制剂治疗中国局部晚期和转移性食管癌患者,以及治疗不可切除的转移性肺鳞癌的两项临床研究(KEYNOTE-181和KEYNOTE-407)结果双双发布。结果显示帕博利珠单抗(K药)单药用于二线治疗出现进展的局部晚期或转移性中国食管癌患者,及联合化疗(卡铂和紫杉醇)一线治疗中国鳞状非小细胞肺癌患者所带来的总生存获益(OS),以及死亡风险降低幅度(基于HR值)都优于两个研究的整体人群的数据结果1 2 3 4。
继K药食管癌全球数据和亚洲人群数据双双公布后, 众所期盼的KEYNOTE-181中国人群数据由北京大学肿瘤医院副院长,沈琳教授在2019欧洲肿瘤内科学(ESMO)大会上发布。结果显示,K药治疗中国食管鳞癌患者的中位总生存(mOS)达到8.4个月,相比化疗组延长了2.8个月(化疗组的mOS为5.6个月),死亡风险都降低45%; 12个月的生存率35.7%,是化疗组(15.3%)的两倍多(看下图B)。
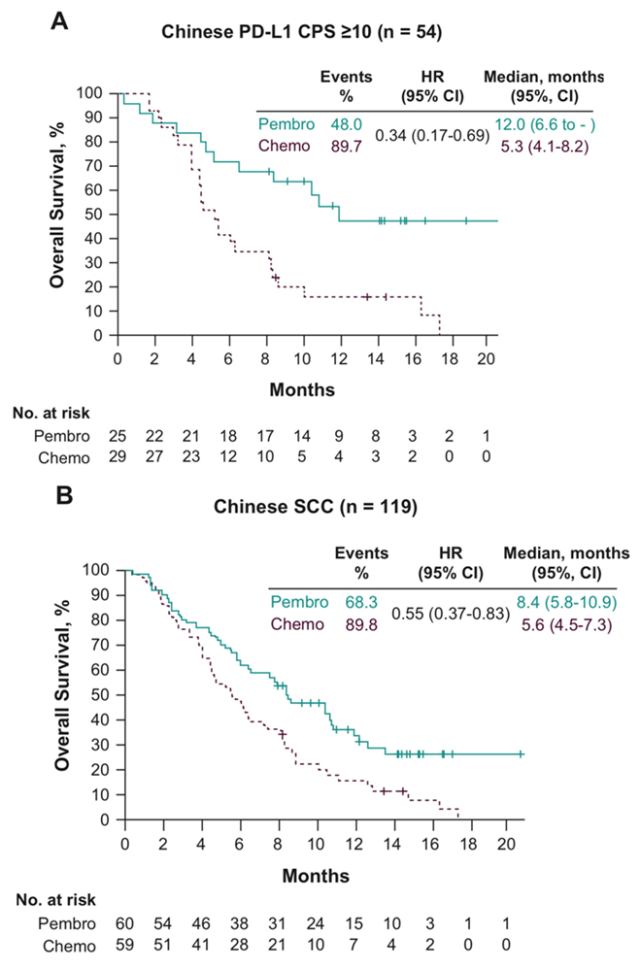
K药相比化疗为食管鳞癌和PD-L1表达阳性的患者带来显著OS改善5
K药治疗PD-L1表达阳性(CPS≥10)的食管癌人群的中位OS更是达到12个月(化疗组5.3个月),死亡风险降低66%, 超越当前食管癌一线治疗方案带来的生存获益。 12个月的生存率达到了53%; 这意味着有超过一半的患者在12月时仍然能生存,是化疗组(16.1%)的3倍多(看上图A)。
如果与整体人群研究数据相比,K药治疗中国食管鳞癌、PD-L1表达阳性及意向治疗人群的的死亡风险降低幅度更显著(看下图) 1 2 5。
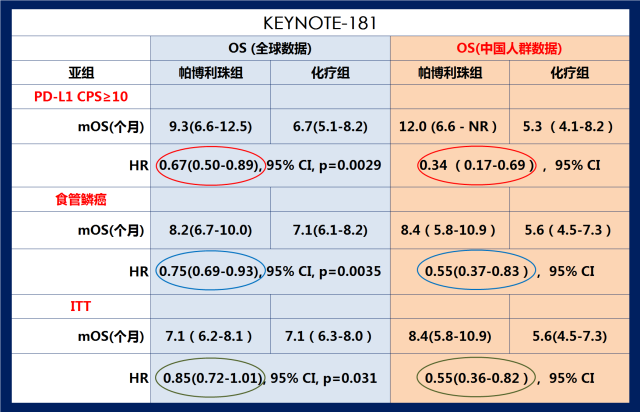
KEYNOTE-181 III期临床研究中中国亚组与全球OS数据的对比
KEYNOTE-407的中国扩展研究结果显示,K药治疗中国肺鳞癌患者的中位OS为17.3个月(化疗组12.6个月),死亡风险降低56%, 12个月的生存率达到了79%(看下图中中国扩展研究2)。与KEYNOTE-407的整体人群研究结果相比,K药降低中国患者死亡风险的幅度更显著,接近整体人群2倍(56% 对比29%)6 7。
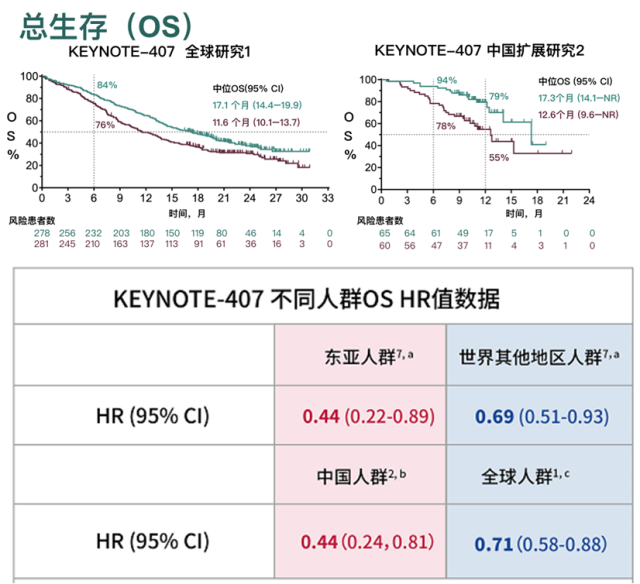
KEYNOTE-407 III期临床研究中中国亚组与全球OS数据的对比6 7
在今年9月的世界肺癌大会上,广东省人民医院终身主任吴一龙教授公布了K药单药一线治疗PD-L1表达阳性(TPS≥1%)的局部晚期和转移性非小细胞肺癌(NSCLC)的KEYNOTE-042研究的中国亚组及中国扩展人群的研究结果,结果显示中国人群的数据与KEYNOTE-042的整体人群的研究数据一致,而且在中位OS和死亡风险降低方面也更具有优势。
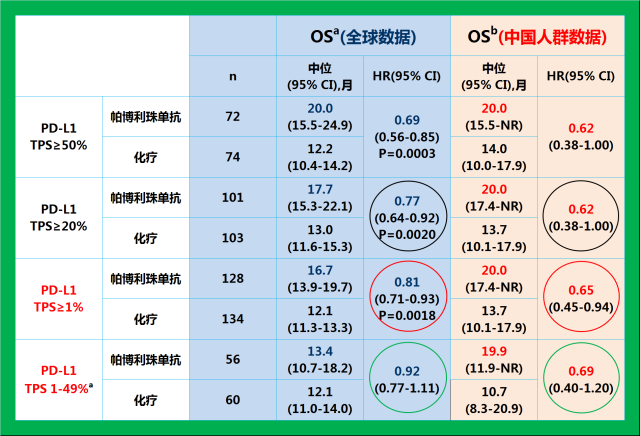
KEYNOTE-042临床研究中国亚组及中国扩展研究数据与全球OS数据的对比8 9
至此,K药当前正式公布的3个III期临床研究中治疗中国患者的数据结果都显示,相比整体人群数据,K药治疗(无论是单药还是联合化疗治疗),为中国患者带来的OS改善和死亡风险的降低更显著。
PD-1治疗安全性与疗效同等重要
但是针对中国患者,PD-1单抗治疗带来的不良反应是否与整体人群一致,或甚至比化疗方案更低呢?
免疫治疗相比化疗,总体的不良反应发生率更低。但由于免疫治疗的独特作用机制,在临床治疗上必须重视其带来的免疫相关性不良反应(irAE)的预测及处理。
PD-1免疫检查点抑制剂激活了被肿瘤细胞所禁锢的T细胞活性, 而T细胞活性的释放对组织的影响是全方位、非特异性的,因此,这类药物可以影响到各个器官和各个组织,尤其是与免疫治疗相关的组织和器官更容易受到侵袭,例如甲状腺。
一些临床少见的irAE更要高度重视,尤其是可能影响疗效或是影响患者生存或是导致严重后果的irAE,必需高度重视,如比较少见的免疫相关性脑炎、心肌炎、胰腺炎等,这些情况要尽早诊断与治疗。
最后,不同的PD-1单抗的不良反应谱也都会有所不同,在临床上治疗上需要区别对待。
当前在国内已获批的五个PD-1单抗中,纳武利尤单抗(O药)和K药是两个进口的PD-1单抗,这两者都拥有针对中国人群和整体研究人群的对比数据。
O药单药治疗中国人群安全性数据
CHECKMATE-078是一项由吴一龙教授牵头开展的多中心、随机III期研究,比较了O药与多西他赛在含铂双药化疗治疗后出现疾病进展的IIIb/IV期EGFR和ALK阴性的NSCLC患者中的疗效与安全性(二线治疗)。研究入组了451例中国患者(同时入组少量俄罗斯和新加坡患者),按2:1随机分配接受O药(n=338)或多西他赛(n=166)治疗,至疾病进展或发生不可耐受的毒性。该研究结果于2018年的AACR大会上由吴一龙教授口头汇报,并于2019年在Journal of Thoracic Oncology在线发表 [10]。
O药组3~4级治疗相关不良事件(TRAEs) 的发生率为10% (低于多西他赛组 的47%)。O药组因3-4级治疗相关不良反应比例为5%(同样低于多西他赛组的14%)。CHECKMATE-017和CHECKMATE -057分别是O药针对主要为欧美人群的二线治疗鳞和非鳞NSCLC的两项研究。两项结果所显示的O药的3-4级不良反应发生率分别为7%和10.5%。对比CHECKMATE-078研究中的不良反应,O药的不良反应谱未显示东西方人种差异。1
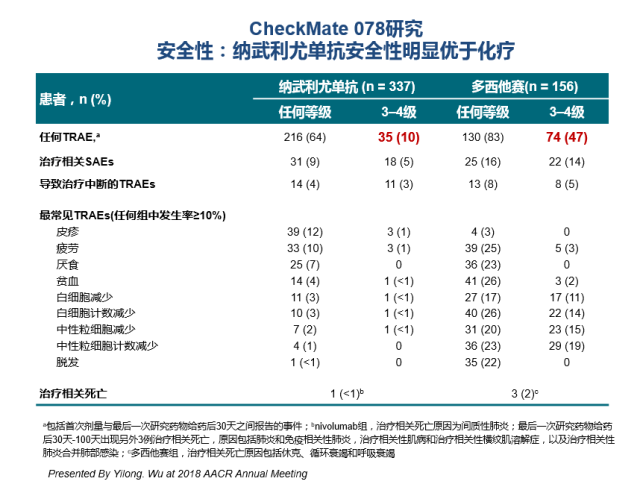
CHECKMATE-078临床研究结果所反映的TRAEs(中位随访8.8个月) 10
在今年CSCO大会上,中国医学科学院附属肿瘤医院肿瘤内科王洁教授公布了CHECKMATE-078研究的2年随访数据, 这是目前我国PD-1单抗治疗随访时间最长的数据。
2年随访结果显示,O药组和多西他赛组的总体不良反应发生率分别为65%和84%,O药组3-4级的TRAE的发生率低于多西他赛,分别为12%和47% 11。
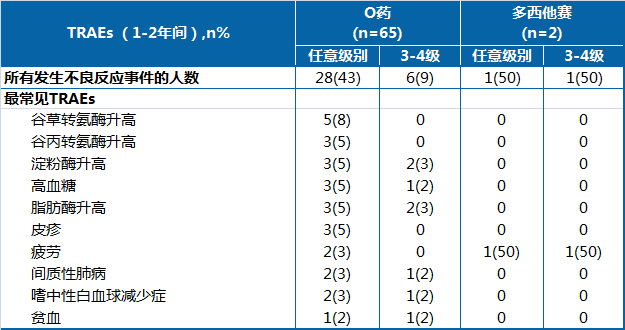
CHECKMATE-078的两年随访研究中1-2年之间发生的主要TRAEs 11
常见的TRAEs主要表现为皮肤毒性(22%), 肝毒性(20%), 内分泌毒性(11%), 肺毒性(8%),肾毒性(6%)以及消化道毒性(3%),过敏/输液反应发生率<1%。
K药单药治疗中国人群的安全性数据
KEYNOTE-181是全球第一个PD-1单抗对比标准化疗方案治疗局部晚期和转移性食管癌的大型Ⅲ期随机对照研究。该研究入组了亚洲亚组共纳入了355例患者,其中中国亚组共纳入了123例患者,随机分配至帕博利珠单抗组(n=62,食管鳞癌,60例)和化疗组(n=61,食管鳞癌,59例)。
K药组的与治疗相关的不良反应发生率低于化疗, 3-5级不良反应的发生率更是仅有化疗组的一半,分别为21.0%和42.4%。
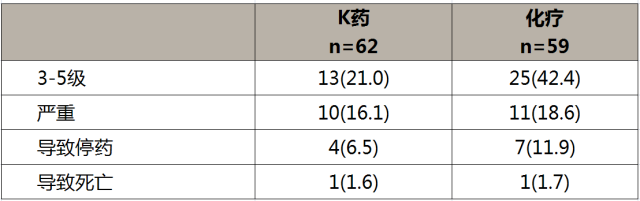
K药治疗(中位随访15.1个月)中国食管癌的3-5级TRAE发生率仅有化疗组(中位随访14.7个月)的一半1 5
K药治疗中国患者的TRAE发生率略高于整体人群的TRAE发生率,分别为76%和64%; 因TRAE导致的停药率与整体人群的研究数据基本一致,但仅为化疗组的一半。
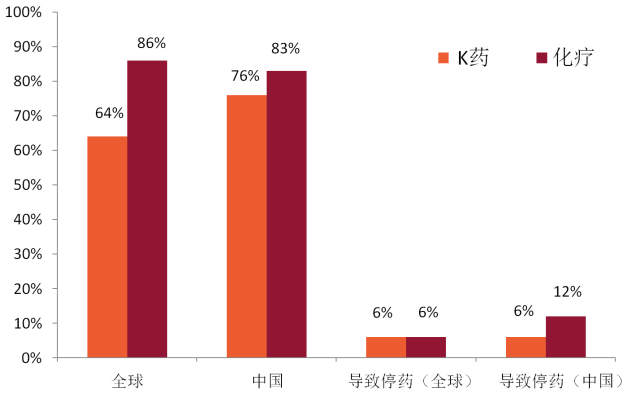
K药治疗中国食管癌的TRAE发生率及TRAE导致的停药率与全球数据基本一致1
主要的TRAE为甲状腺功能减退,肝功能ALT和AST指标升高,便秘,恶心,肺炎,皮疹。与整体人群的不良反应一致,未显示有明显的东西方人种差异。
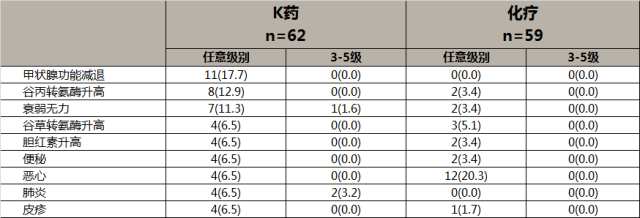
K药治疗中国食管癌患者的主要TRAEs 1 5

KEYNOTE-181研究中K药((中位随访7.1个月)对比化疗(中位随访6.9个月)治疗整体人群的TRAEs 2
KEYNOTE-042是一项全球,开放标签的III期临床研究,对比帕博利珠单抗单药与化疗一线治疗EGFR/ALK阴性,PD-L1阳性局部晚期或转移性NSCLC的疗效和安全性。该研究结果于2018年ASCO首次公布,并于2019年4月刊登于著名的医学杂志《柳叶刀》。
KEYNOTE-042共纳入了262例PD-L1阳性(TPS≥1%)的中国患者(中国亚组,n=92;中国扩增,n=170),随机分配给予帕博利珠单抗(n=128)和化疗(n=134)治疗。 研究结果显示, 治疗相关不良反应和3-5级不良反应发生率分别为79%和17%,均低于化疗组的92%和68%,
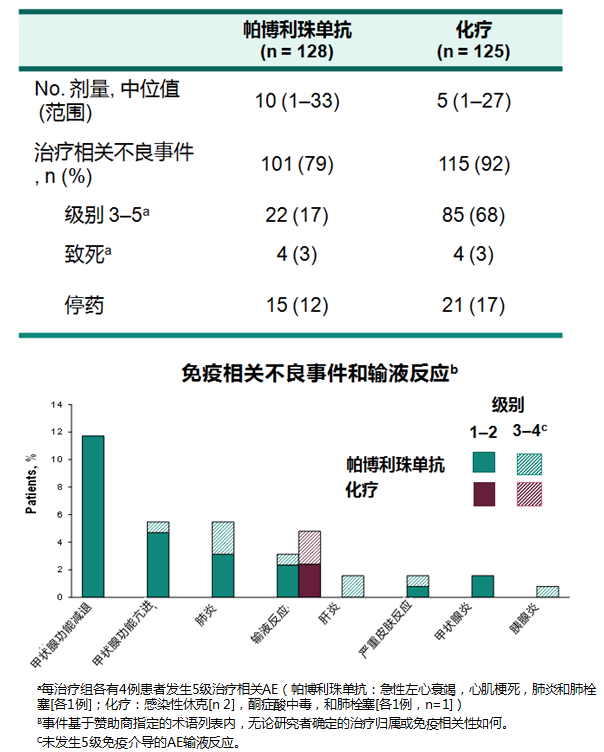
KEYNOTE-042研究的中国亚组和中国扩展人群研究中K药的TRAE发生率和主要irAEs(中位随访11.3个月) 5
主要irAE表现为甲状腺功能亢进和减退,甲状腺炎,间质性肺炎等。与整体人群的不良反应一致,未显示东西方人种差异。
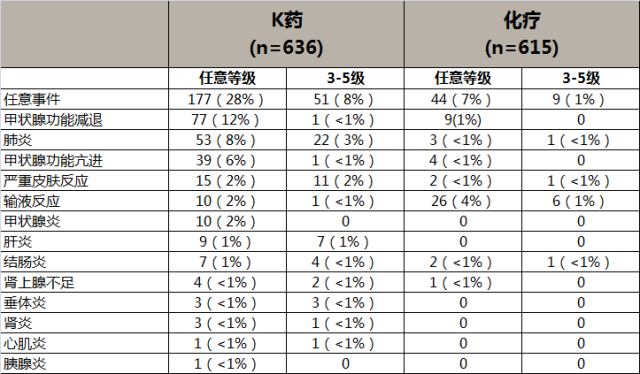
KEYNOTE-042研究中,K药对比治疗整体人群的irAEs发生率6
CHECKMATE-078, KEYNOTE-181和KEYNOTE-042这三个PD-1单抗单药治疗的研究结果都显示,K要和O药治疗中国人群的TRAE、3-5级不良反应都要低于化疗,而且中国人群的irAE类型与全球的基本一致。 K药和O药在治疗NSCLC的不良反应发生谱略有不同,而且K药治疗不同的肿瘤的不良反应也略有差异。
在今年的ASCO大会上, K药单药治疗NSCLC(KEYNOTE-001)的单臂五年随访数据公布,并同步刊登在Journal of Clinical Oncology杂志。KEYNOTE-001是K药治疗晚期NSCLC入组量最大、随访最长的疗效和安全性数据,入组的多为欧美人群。其中,NSCLC队列共入组患者550例,初治患者101例,经治(至少接受过一线治疗)患者449例。
发布的结果显示, 与K药治疗相关的不良的发生率为71%, 3~5级治疗相关AE的发生率为13%。其中,免疫介导不良事件(irAE)发生率为17%(92/550),与3年随访数据相似。大多数irAE为1~2度,常见的irAE包括甲状腺功能减退、肺炎、甲亢、皮肤毒性。
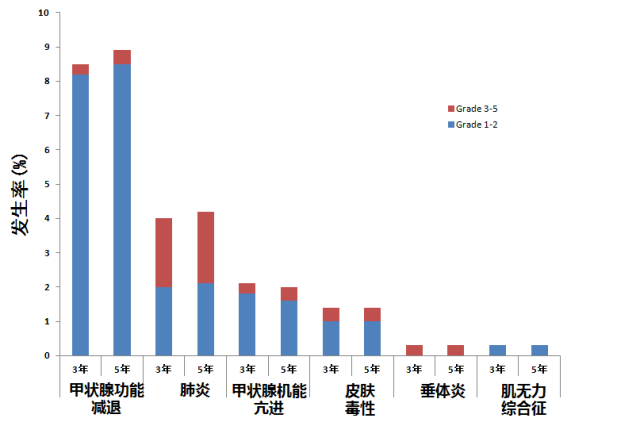
K药单药治疗随访3年和5年间发生的各类irAEs 12
KEYNOTE-181和KEYNOTE-042研究中的中国人群数据与K药的5年随访研究的数据相比,并未显示特殊和不同的TRAE和irAE。
K药联合化疗治疗的不良反应
在刚刚结束的ESMO-ASIA大会上,吉林省肿瘤医院的程颖教授首次汇报了KEYNOTE-407中国扩展研究。 KEYNOTE-407是一项在未经治疗的转移性鳞状NSCLC患者中进行的国际、随机,双盲,安慰剂对照,Ⅲ期试验,主要终点为OS和PFS。全球研究和扩展研究设计相似, 将125例来自中国大陆的患者按照1:1的比例随机分配接受K药(n=65)或者安慰剂(n=60)(35周期)+卡铂和紫杉醇治疗(4周期)。
研究结果显示, 任何不良反应和3-5级不良反应发生率与化疗组相似,主要免疫相关不良反应为甲状腺功能亢进和减退,甲状腺炎,间质性肺炎等。与整体人群的不良反应一致,未显示有东西方人种差异。
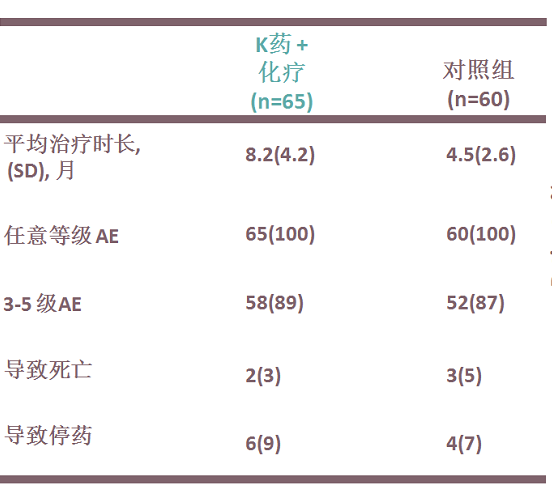
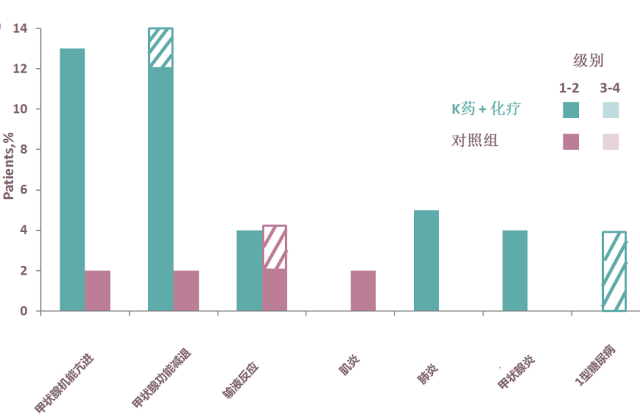
KEYNOTE-407 III期临床研究中中国亚组(中位随访7.8个月)的TRAE 和irAE发生率3
国产PD-1单抗的不良反应
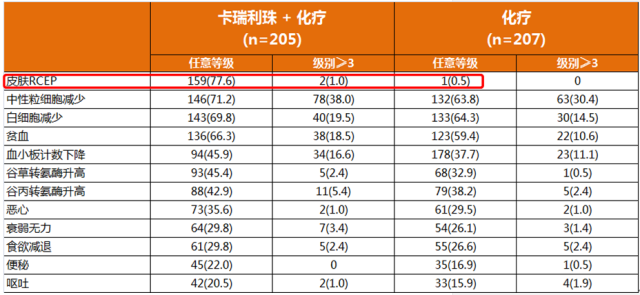
当前在国内获批的三个国产PD-1单抗中,卡瑞利珠单抗是目前唯一具有正式发布的III期临床结果的PD-1单抗。
在今年11月7日-9日在北京举办的第15届世界食管疾病大会上,国内最大规模的PD-1单抗单药二线治疗中国食管鳞癌随机III期临床研究(ESCORT)研究结果公布。ESCORT研究旨在评估卡瑞利珠单抗对比研究者选择的化疗用于一线化疗失败的局部晚期或转移性食管癌患者的有效性和安全性。主要终点为OS,次要终点包括客观缓解率(ORR)、无进展生存(PFS)、生活质量、不良事件以及生物标志物与疗效之间的关系。ESCORT研究共入组457例中国患者,随机接受卡瑞利珠单抗(228例)或化疗(229例)。
与化疗相比,除了反应性毛细血管增生症(RCCEP)之外,几乎在其它所有不良反应发生率上,卡瑞利珠单抗组都要低于化疗组。 唯独RCCEP(反应性毛细血管增生)的发生率高达79.6%; 而在已发布的K药或O药的III期临床研究中,都没有报道RCCEP的发生。
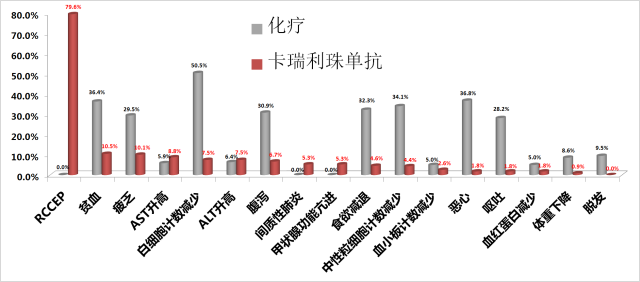
卡瑞利珠单抗治疗组的RCCEP(反应性毛细血管增生)的发生率高达79.6% 13
在今年的世界肺癌大会上,卡瑞利珠单抗联合化疗一线治疗非鳞非小细胞肺癌的SHR-1210-303的III期临床研究结果公布。结果同样显示,与化疗相比,除了反应性毛细血管增生症(RCCEP)之外,几乎在其它所有不良反应发生率上,卡瑞利珠单抗组的不良反应于化疗组相似。 唯独RCCEP(反应性毛细血管增生)的发生率高达77.6%(化疗组0.5%)。
卡瑞利珠单抗联合化疗一线治疗非鳞NSCLC(中位随访时间11.9个月)的反应性毛细血管增生的发生率为77.6% 14
在去年(2018年)ESMO大会上公布的卡瑞利珠单抗二线治疗肝细胞癌的临床研究中,其治疗组的总体RCCEP发生率为66.8%(q2w, 63.3%, q3w 70.4%)15。
今年1月,英国杂志《mAb》发表研究文章,阐述了SHR-1210(卡瑞利珠单抗在早期临床研究中的代号)脱靶机制,认为卡瑞利珠单抗可能 「脱靶」激活血管内皮生长因子受体2(VEGFR2)的信号通路,从而导致独有的毛细血管增生引起的血管瘤的高比例发生16 2
VEGFR2一般分布于血管和淋巴管内皮,其功能主要是调节淋巴管内皮细胞和血管内皮细胞,促进血管生成,还有促进淋巴管和调节淋巴细胞迁移等作用。目前已在国内上市的多个小分子抗血管生成药物,包括索拉非尼、舒尼替尼、瑞戈非尼、仑伐替尼等都能通过抑制VEGFR2信号传输通路来发挥抗肿瘤作用。
PD-1单抗临床应用必须考虑药物安全性
近几年,免疫治疗已改变了多个恶性肿瘤的治疗的临床实践。在国内,在晚期非小细胞肺癌(NSCLC)治疗领域,K药已获批三个一线治疗适应症。 O药也获批二线治疗晚期转移性NSCLC及头颈部鳞癌; 多个国产PD-1单抗获批治疗经典霍奇金淋巴瘤,或不可切除的恶性黑色素瘤。今年可能还会迎来多个PD-L1单抗获批治疗III期不可切除的NSCLC和小细胞肺癌。明年,免疫治疗的光辉也将“照耀”我国的食管癌治疗(K药和卡瑞利珠单抗治疗食管癌的适应症皆已获国家药品监督管理局受理)。
随着越来越多的PD-1/PD-L1单抗在国内进入临床应用,医生在选择治疗方案时,必定会对不同PD-1单抗的不良反应、耐受性问题日趋重视。对于可能影响疗效,影响患者生存或是导致严重后果的irAE,比如比较少见的免疫相关性脑炎、心肌炎、胰腺炎等一定会给予高度重视。
另外,高度特异性RCCEP的发生也提示不同PD-1单抗的不良反应会不同。虽然反应性毛细血管瘤多为1-2级,而且多发生于表皮,但不可排除在长期使用过程中可能也会发生于内脏器官,或出现反复出血、感染,恶变,甚至危及生命的情况。
在针对经常需要同步放化疗的中期和局部晚期食管癌患者,或者III期不可切除的NSCLC患者时,安全性和可靠性自然成为除疗效之外的两个选择PD-1/PD-L1单抗最重要,也是首当其冲要考量的因素。
作者:丁客
[1] Kim S-B, Pembrolizumab versus Chemotherapy in Patients With Advanced/Metastatic Adenocarcinoma or Squamous Cell Carcinoma of the Esophagus as Second-Line Therapy, Oral Presentation, ESOM-ASIA, 2019
[2] Shah M.A et al., Pembrolizumab versus Chemotherapy in Advanced Esophageal Cancer: Phase 3 KEYNOTE-181 Study, Oral Presentation, ASCO-GI, 2019
[3] Cheng Y et al.,KEYNOTE-407 China Extension Study: Pembrolizumab Plus Chemotherapy in Chinese Patients with Metastatic Squamous NSCLC, Oral Presentation, ESMO-Asia, 2019
[4] Paz-Ares et la., Pembrolizumab plus Chemmotherapy for Squamous Non-Small-Cell-Lung Cancer, N Engl J Med. 2018;379(21):2040-2051
[5] Chen J et al., Pembrolizumab versus Chemotherapy in Patients With Advanced/Metastatic Adenocarcinoma or Squamous Cell Carcinoma of the Esophagus as Second-Line Therapy: Analysis of Chinese Sub-group in KEYNOTE-181, Abstract, ESMO, 2019
[6] Cheng Y et al.,KEYNOTE-407 China Extension Study: Pembrolizumab Plus Chemotherapy in Chinese Patients with Metastatic Squamous NSCLC, Oral Presentation, ESMO-Asia, 2019
[7] Paz-Ares et la., Pembrolizumab plus Chemmotherapy for Squamous Non-Small-Cell-Lung Cancer, N Engl J Med. 2018;379(21):2040-2051
[8] Wu Y.L et al., KEYNOTE-042 China Study: First-line Pembrolizumab vs Chemotherapy in Chinese Patients with Advanced NSCLC with PD-L1 TPS ≥1%, Mini-Oral Presentation, 2019 WCLC
[9] Mok, T.S.K etal., Pembrolizumab versus chemotherapy for previously untreated, PD-L1-expressing, locally advanced or metastatic non-small-cell lung cancer (KEYNOTE-042): a randomized, open label, controlled, phase 3 trial. Lancet, April 4th, 2019
[10] Wu YL et al., Nivolumab Versus Decetaxel in a Predominantly Chinese Patient Population With Previously Treated Advanced Non-Small-Cell-Lung Cancer: CheckMate 078 Randomized Phase III Clinical Trial, Journal of Thoracic Oncology, 2019. 01
[11] Wang J et al., 2-Year Follow-up From CheckMate 078: Nivolumab Versus Docetaxel in a Predominantly Chinese Patient Population With Previously Treated Advanced Non-Small-Cell-Lung Cancer (NSCLC),Oral Presentation, CSCO, 2019
[12] Garon E et al., Five-Year Overall Survival for Patients With Advanced Non-Small-Cell-Lung Cancer Treated With Pembrolizumab: Results From the Phase I KEYNOTE-001 Study, Journal of Clinical Oncology, 2019.6.2
[13] Huang J et al., Phase 3 study of camrelizumab vs chemotherapy for locally advanced/metastatic esophageal cancer: The ESCORT Study, Oral Presentation, the 15th OESO World Conference for Esophaeal Diseases, Nov. 7-9th, 2019
[14] Zhou CC et al., A Randomized Phase 3 Study of Camrelizumab plus Chemotherapy as 1st Line Therapy for Advanced Non-Squamous Non-Small Cell Lung Cancer with negative EGFR and ALK, Oral Presentation, WCLC, 2019
[15] Qin SQ et al., A Randomized Multicentered Phase 2 Study to Evaluate SHR-1210 (PD-1 Antibody) in Subjects with Advanced Hepatocellular Carcinoma (HCC) who Failed or Intolerable to Prior Systemic Treatment, Oral Presentation, 2018 ESMO, Oct. 10, 018
[16] Finlay WJJ et al., Anti-PD-1 SHR1210 aberrantly targets pro-angiogenic receptor and this polyspecificity can be ablated by paratope refinement. MAbs, 2019, VOL 11, NO. 1, 26-44