丁香园特邀南昌大学第一附属医院孙庭教授对「地加瑞克临床研发历程」进行深度剖析,详细介绍地加瑞克治疗前列腺癌的相关知识,期待给大家带来新的启发与理解。
详细采访内容请见下文
孙庭 教授
教授、主任医师、医学博士、博士研究生导师
南昌大学第一附属医院泌尿外科主任
江西省泌尿外科研究所副所长
中华医学会泌尿外科分会全国委员
中华医学会泌尿外科分会肿瘤学组委员
中国医师协会中西医结合医师分会泌尿外科学专业委员会常委
中华医学会江西省泌尿外科学会主任委员
江西省泌尿外科专科医联体理事会副理事长
江西省卫生系统跨世纪学术和技术带头人
江西省中青年学科带头人
江西省高校中青年学科带头人
鉴于临床前实验获得良好结果,研发人员随后进行多项临床试验以探究地加瑞克治疗前列腺癌的疗效、安全性、给药剂量等问题。
Ⅰ/Ⅱ期临床试验
Ⅰ期临床试验主要验证药效和药代,结果显示①皮下和肌肉注射相对于静脉注射给药,半衰期更长;②地加瑞克药代动力学具有剂量和浓度依赖性1。随后研发人员在多地区开展Ⅱ期临床试验以验证药物治疗前列腺癌的疗效,探索最佳给药剂量。
英国随机Ⅱ期试验,共纳入 129 名不同分期的前列腺癌患者 (55 - 87 岁),分别接受三种不同剂量的治疗方案 (在治疗的第 0、3、28 天给皮下注射如下剂量地加瑞克:80/80/40, 80/ - /20, 40/40/40,每 28 天 1 疗程)。研究显示,给药方案 80/80/40 是最有效的,睾酮降至 ≤ 0.5 ng / ml。随访 6 个月,三组患者分别有 87.5%、72.2%、58.8% 睾酮 ≤ 0.5 ng / ml。
多中心,随机,剂量爬坡 II 期临床试验,入组 172 例 (48 - 89 岁) 不同分期前列腺癌患者。分别给予皮下注射不同浓度(20 mg/ml ~ 60 mg/ml)地加瑞克 120 mg ~320 mg ,在第 3、28 天,通过测量睾酮和前列腺特异性抗原(PSA)对 169 例患者进行疗效评估。结果显示:地加瑞克呈现剂量和浓度依赖效应。96% 的患者在 240 mg(40 mg/ml) 给药剂量可达去势 (睾酮 ≤ 0.5 mg / ml),是最有效的方案 2。
在北美进行的开放性标签,随机 II 期试验,共入组 127 例病人,平均年龄为 76 岁 (47 - 93 年),随机分为两组,初始剂量为 200 mg,随后维持剂量为每月给药 60 mg (200/60) 或 80 mg (200/80),所有给药均为皮下注射。共 87/127 例 (69%) 患者完成研究,结果显示:给药第三天,89% 的患者睾酮 ≤ 0.5 ng / ml,组间无统计学显著差异 。1 个月后,88% 的患者睾酮 ≤ 0.5 ng / ml(维持剂量 60 mg 组 VS. 维持剂量 80 mg 组 = 93% VS. 83%;p = 0.073)。整个随访期间,86% 维持剂量 60 mg 组患者与 77% 维持剂量 80 mg 组的患者睾酮水平 ≤ 0.5 ng/ml。治疗一个月后睾酮 ≤ 0.5 ng / ml 患者,1 年后有 93% 维持剂量 60 mg 组患者、98% 维持剂量 80 mg 组患者睾酮持续 ≤ 0.5 ng/ml(p = 0.669)。两组患者在给予地加瑞克治疗 14 天、56 天后,PSA 下降 50%、90%,1 年后 PSA 中位水平下降 96%。二氢睾酮(DHT)、黄体生成素(LH)水平均快速下降 (给药后 3 天下降超过 80%)3。
欧洲和南非进行的探索剂量 II 期临床试验,共入组 187 例平均年龄 72 岁 (52~93 岁) 前列腺癌患者。患者随机分为 6 组 , 分别给予地加瑞克初始剂量 240 或 200 mg, 维持剂量分别为每月 80, 120, 160 mg 的方案治疗,所有给药均为皮下注射,共 147/187 例 (78%) 患者完成试验。
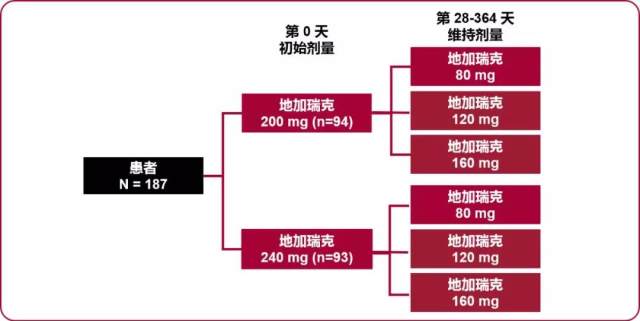
图 1 欧洲和南非进行的探索剂量 II 期临床试验给药方案
结果显示:在给药第 3 天,88% 初始剂量 200 mg 组患者及 92% 初始剂量 240 mg 组患者睾酮水平降至 ≤ 0.5 ng/ml。治疗 1 个月,初始计量 240 mg 组患者睾酮水平 ≤ 0.5 ng / ml 比例明显较 200 mg 初始剂量组患者高(95% vs 86%;p = 0.048)。(图 2)
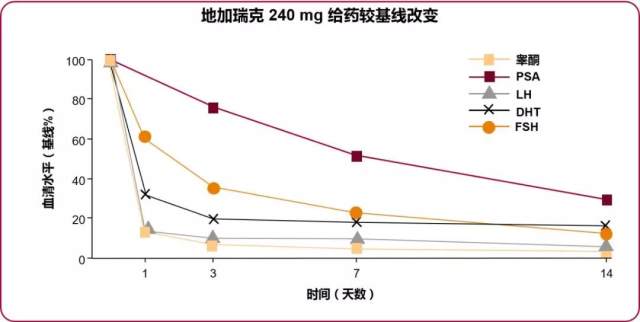
图 2 地加瑞克 240 mg 给药后各指标较基线改变,睾酮抑制优于 200 mg 组
至随访结束,在给予维持剂量 160 mg 组患者血清睾酮水平维持 ≤ 0.5 ng / ml 比例达 100%,所有患者的 PSA 水平降低 97%~98%, PSA 降低 90% 所需中位时间为 8 周 4。(图 3)
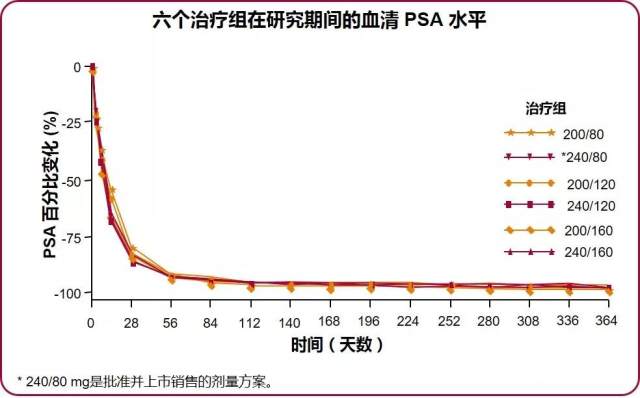
图 3 各治疗组在研究期间 PSA 得到很好控制
患者多数不良事件为轻到中度,约 11%~13% 患者出现至少一种严重不良事件。最常见的不良事件包括:剂量依赖性潮热(27~ 48%)、疲劳(3~23%)、注射部位疼痛(3 ~19%)。
Ⅱ期临床试验显示,初始剂量 240 mg,维持剂量 80 或 160 mg 是适当的给药剂量,Ⅲ期试验采该剂量。
Ⅲ期临床试验
随后进行的随机、开放性Ⅲ期临床试验, 2006 年 2 月至 2007 年 10 月间共入组 610 例前列腺癌患者,中位年龄为 72 岁 (50 - 98 岁), 中位 PSA 19 ng/ml , 睾酮 3.93 ng/ml。患者随机分为 3 组, A 组:地加瑞克初始剂量 240 mg (2 × 3 ml s.c.), 维持剂量 80 mg/月 (1 × 4 ml s.c.);B 组:地加瑞克初始剂量 240 mg(2 × 3 ml s.c.), 维持剂量 160 mg/月 (1 × 4 ml s.c.);C 组:亮丙瑞林 7.5 mg/月 (1 × 1 ml i.m.)。试验的主要研究终点为给药后 28~364 天,睾酮 ≤ 0.5 ng/ml。(图 4)
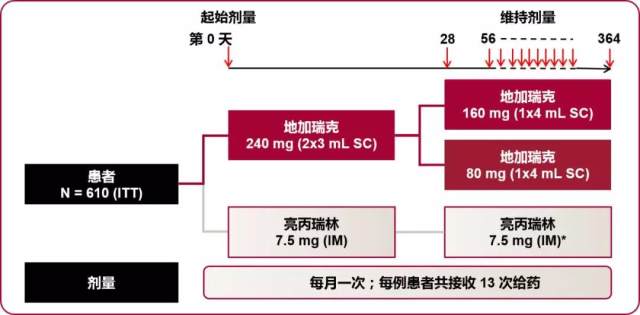
图 4 三期临床试验给药方案
结果显示 A~C 3 组患者达到主要研究终点的比例分别为 97%、98% 和 96% ,证实地加瑞克治疗前列腺癌疗效非劣效于亮丙瑞林。给药 3 d 后 , 96.1%A 组患者及 95.5%B 组患者睾酮水平迅速降至 ≤ 0.5 ng/ml, 而 C 组无患者达到,甚至睾酮水平上升约 65%。(图 5)
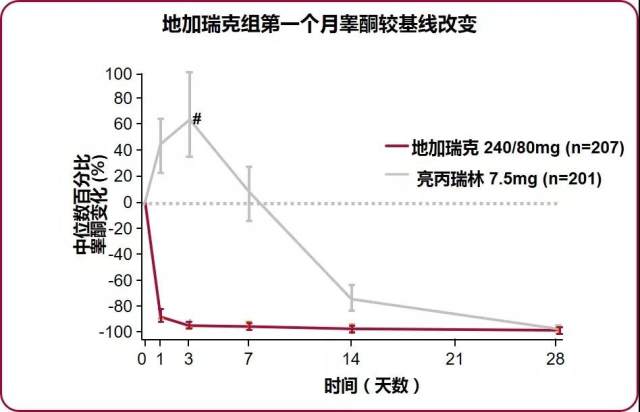
图 5 地加瑞克组第一个月睾酮较基线改变,快速去势,无睾酮激增
给药 14 d,3 组患者的 PSA 水平分别下降 64%, 65%, 18%,给药 28 d 后 3 组患者的 PSA 水平分别下降 85%, 83%, 68%。(图 6)
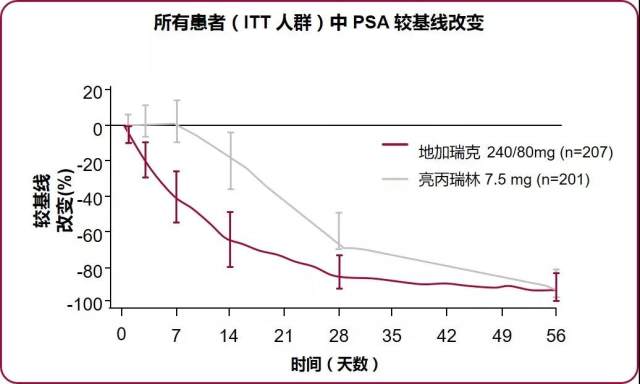
图 6 地加瑞克组 PSA 降低显著更迅速
地加瑞克治疗,中位 LH 和 FSH 浓度迅速下降,并被持续抑制直至研究结束。研究结束时,地加瑞克治疗患者 FSH 浓度下降了 88.5% ,亮丙瑞林治疗患者 FSH 下降 54.8%。分别有 81% 地加瑞克、78% 亮丙瑞林治疗患者观察到不良事件,3 组患者出现严重不良事件比例分别为 10%、12%、14%5。
临床试验结果证实地加瑞克治疗前列腺癌良好的疗效,可接受的不良事件,进而在 2008 年美国 FDA 批准其上市用于晚期前列腺癌治疗,随后该药在多个国家相继获批上市。
参考文献:
[1] Van H P. Evaluation of degarelix in the management of prostate cancer. Cancer Management & Research, 2010, 2(1):39-52.
[2] Persson B E, Olesen T K, Jensen J K. Degarelix: A New Approach for the Treatment of Prostate Cancer. Neuroendocrinology, 2009, 90(3):235-244.
[3] Gittelman M, Pommerville P J, Persson B E, et al. A 1-Year, Open Label, Randomized Phase II Dose Finding Study of Degarelix for the Treatment of Prostate Cancer in North America. Journal of Urology, 2008, 180(5):1986-1992.
[4] Poppela H V, Rosette J J D L, Persson B E, et al. Degarelix: A Novel Gonadotropin-Releasing Hormone (GnRH) Receptor Blocker—Results from a 1-yr, Multicentre, Randomised, Phase 2 Dosage-Finding Study in the Treatment of Prostate Cancer. European Urology, 2008, 54(4):805-815.
[5] Klotz L, Boccongibod L, Shore N D, et al. The efficacy and safety of degarelix: a 12-month, comparative, randomized, open-label, parallel-group phase III study in patients with prostate cancer. Bju International, 2010, 102(11):1531-1538.