主诉
患者王某某,女,65 岁。发现乙肝表面抗原阳性 10 余年,间断呕血 2 年入院。
现病史
患者 10 余年前体检发现 HBsAg 阳性,未治疗。7 年前查 HBV DNA 提示异常(未见单),给予「恩替卡韦」抗病毒治疗,后定期复查,HBV DNA 转阴。2 年前出现呕血,呈鲜红色,量多(具体不详),无黑便,不伴腹痛、腹胀,至当地医院予止血药物应用后好转出院。2 月前再次出现呕血,呈鲜红色,量约 200 ml,无黑便,至当地医院予止血药物应用后好转出院。另诉全身关节疼痛,具体时间不详,诱因不详。
既往史
患「高血压病」10 余年,最高至 180/100 mmHg,应用「复方利血平氨苯喋啶片」治疗,未规律监测血压;
患「子宫肌瘤」10 余年,10 年前于当地医院行「子宫肌瘤切除术」;
患「支气管哮喘」5 年,未治疗;
患「冠心病」4 年,曾于「北京阜外医院」行「冠脉支架置入术」,植入支架 3 枚,术后规律服用「瑞舒伐他汀」3 年,「氯吡格雷」「阿司匹林」2 年;
2 年前,2 月前因「上消化道出血」分别输注悬浮红细胞 8u。
婚育史
50 岁时停经,育有 1 女。
入院查体
体温 36.6°C,脉搏 76 次/分,呼吸 18 次/分,血压 138/75 mmHg。发育正常,体型肥胖,神志清楚,全身皮肤粘膜无黄染,有肝掌,无蜘蛛痣,巩膜轻度黄染,双侧瞳孔等大等圆,对光反射灵敏,心肺听诊无明显异常。肝脏肋下未触及,脾肋下可触及约 10 cm。腹膨隆,移动性浊音阴性,无夜波震颤。无压痛及反跳痛。双下肢无水肿,肌力无异常。
辅助检查
1、实验室检查
血常规:WBC 2.0×109/L, RBC 3.20×1012/L, HB 93 g/L, PLT 92×109/L
肝功能:ALT 13U/L,AST 19U/L,GGT 31U/L,ALP 133U/L,TB 11.1umol/L,DB 6.19umol/L,IB 4.9umol/L, ALB 36.3 g/L, PAB 121 mg/L
血氨:54.8 umol/L
血凝实验:PT 11.2S, PTA 100%, INR 1.0
肾功能:基本正常
电解质:基本正常
粪便常规:隐血弱阳性
尿常规:葡萄糖 3+,尿蛋白±
病毒标志物:HBsAg 阳性,HBeAg 阳性, HBcAb 阳性;HCV-Ab 阴性; HAV-IgM 阴性;HDV-IgM 阴性; HEV-IgM 阴性,HEV-IgG 阴性,CMV-IgG 阳性, EB-IgG 阳性,
HBV DNA 6.28E+05IU/mL; EBV DNA 阴性;CMV DNA 阴性
寄生虫抗体全套:阴性
自免肝抗体:阴性
甲胎蛋白: 正常
CEA、CA125、结缔组织病全套均未见明显异常,
高尔基体蛋白 73 379.6ng/mL,
PCT 0.077 ng/ml,
铜蓝蛋白、铁蛋白均正常。
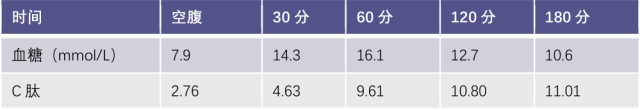
2、血糖和血清 C 肽
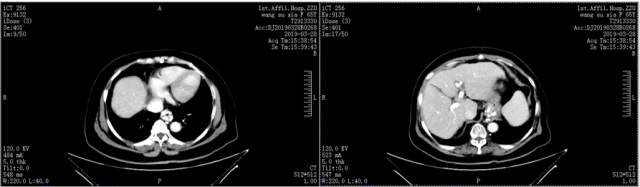
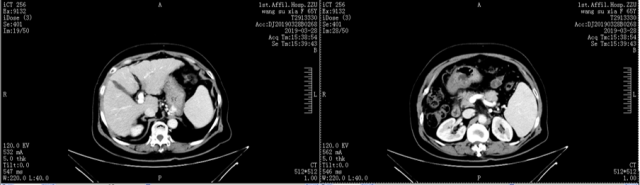
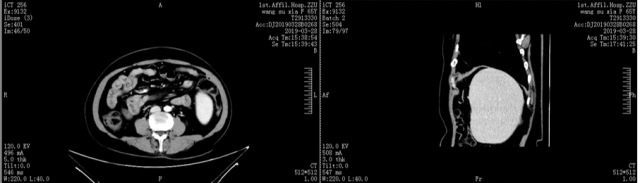
3、CT 检查
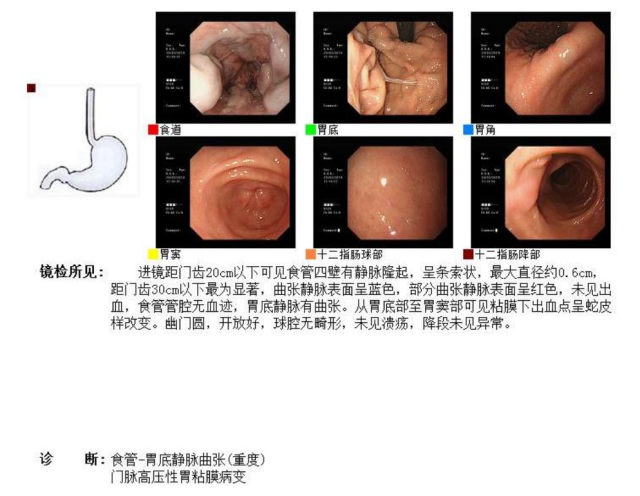
4、电子胃镜:重度食管-胃底静脉曲张,门脉高压性胃粘膜病变
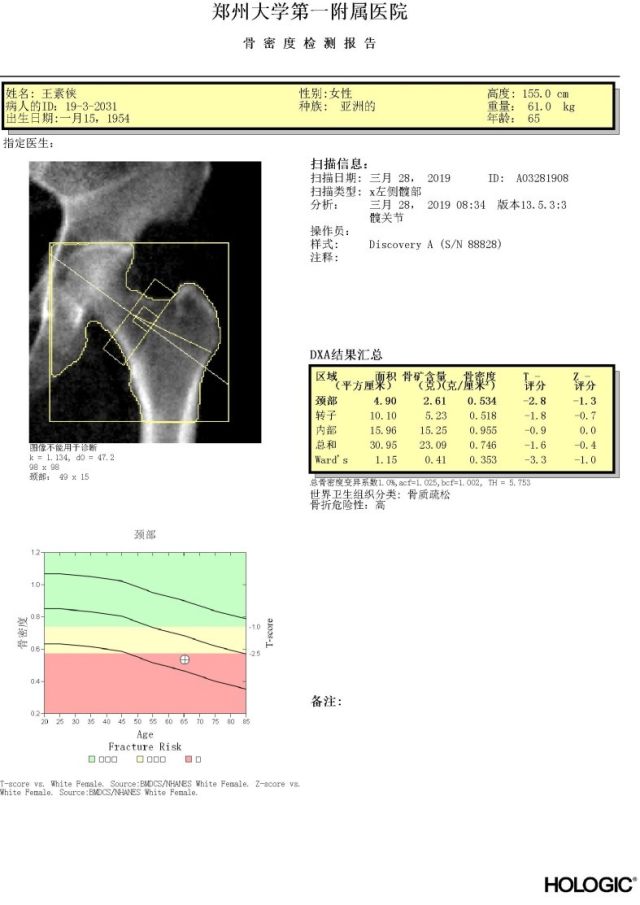
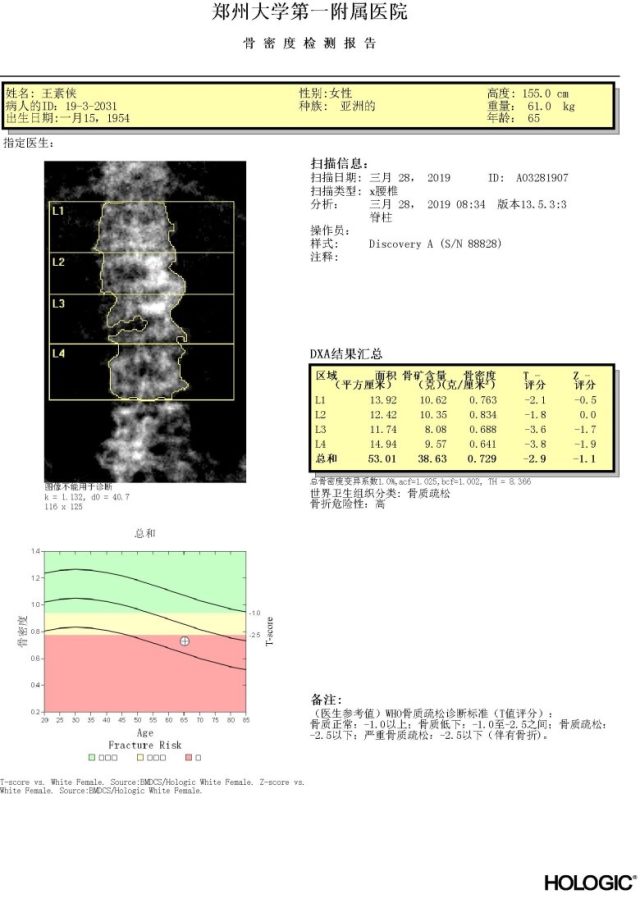
5、骨密度检测:腰椎和髋骨骨密度 T-值<-2.5,骨折风险高危
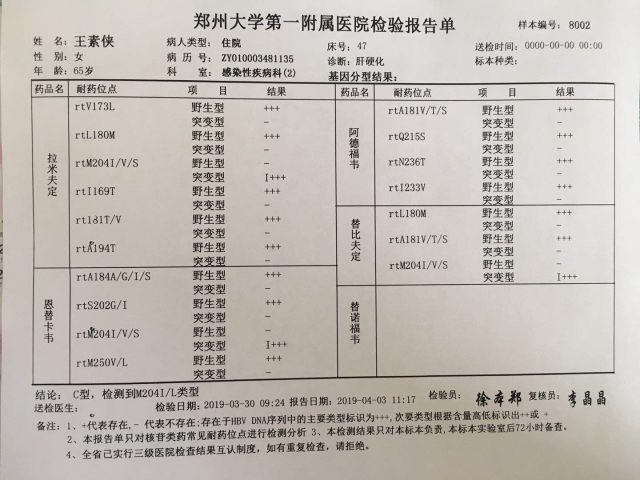
6、耐药检查:rt M204 I/L 变异
诊断
1、肝硬化失代偿期 乙型病毒
脾功能亢进
门静脉高压 食管胃底静脉曲张
2、骨质疏松 重度
3、高血压病三级 很高危
4、2 型糖尿病
5、支气管哮喘
6、冠心病 冠脉支架植入术后
7、子宫切除术后
治疗经过
1、抗病毒治疗:抗病毒药物调整为 TAF,4 周复查 HBV DNA 2.32E+03 IU/mL。
2、骨质疏松治疗:补钙、补充维生素 D3、加用抗骨质疏松药物,全身疼痛症状较前好转。
3、预防出血:于外科行脾切断流术,术后白细胞及血小板均恢复正常。
4、控制血糖和血压:糖尿病饮食及胰岛素治疗,血糖控制稳定。
病例分析
该病例是一位乙肝肝硬化失代偿期患者。长期使用恩替卡韦抗病毒治疗,期间外院定期复查 HBV DNA 转阴,但病情逐渐进展。入院时 HBV DNA 仍为阳性(6.28E+05IU/mL),这可能与患者未采用高精度方法检测,虽然结果未阴性,但病毒仍未降至<20 IU/mL。持续的 HBV DNA 病毒复制可能是导致乙肝肝硬化发生和进展的主要原因。
该病例同时是一位绝经期女性。女性绝经后由于雌激素水平降低,雌激素对破骨细胞的抑制作用减弱,破骨细胞的数量增加、凋亡减少、寿命延长,导致其骨吸收功能增强,是引发骨质疏松症的高危因素。骨质疏松症在初期通常没有明显的临床表现,但随着并且的进展,骨量不断流失,患者会出现骨痛、脊柱变形,甚至发生骨质疏松性骨折等后果。该病例另诉全身关节疼痛,椎骨和髋骨 DXA 骨密度测量 T-值<2.5,诊断为骨质疏松症。1
骨质疏松症的诊断标准 (符合以下三条中之一者) |
|
|
|
此外,该病例合并糖尿病、高血压等多种慢性疾病。糖尿病、高血压、年龄 ≥ 50 岁、慢性 HBV 感染都是肾脏损伤的高危因素。2
对于有类似骨肾损伤风险的慢乙肝患者,长期抗病毒治疗中的药物的骨肾安全性是临床特别需要关注的问题。近年来,乙肝患者 NAs 暴露带来的骨肾损伤风险也越来越受到关注。
香港>5.3 万人的队列研究显示,核苷酸类药物暴露会显著增加髋部骨折风险 3。欧洲一项前瞻性研究显示,没有骨质疏松症的患者使用 TDF 或 ETV 平均治疗 32 个月后,ETV 组和 TDF 分别有 9.1% 和 10.4% 的患者经骨密度检测确诊为骨质疏松症,且两种治疗方案对骨密度/骨折的影响无差异(表 1)。4
表 1:前瞻性研究中,ETV 与 TDF 平均治好了 32 个月后的 T 值和骨折风险评估工具得分
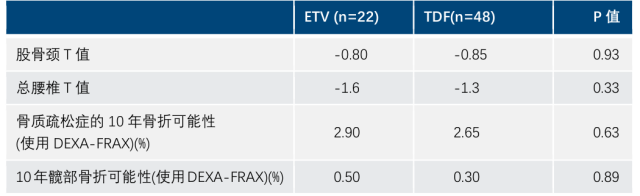
在肾脏安全性方面,虽然过去较多报道了 ADV、TDF 长期治疗引起肾功能下降的不良反应。但近期一些随机对照临床试验和大型队列研究都提示,长期使用 TDF 和 ETV 的对肾脏均有损害 5-6。如美国一项回顾性队列研究对 Stanfold 数据中 815 例 CHB 患者进行长期分析,随访 4 年的结果显示,ETV、TDF 和 ADV 长期治疗均显著影响患者肾功能(图 2)。6
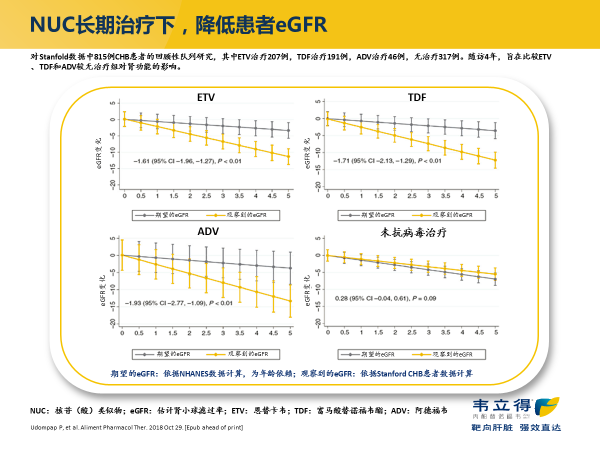
图 2. NUC 长期治疗对 eGFR 的影响
乙肝新药富马酸丙酚替诺福韦(TAF)的一大优势就是靶向肝脏,降低了 TAF 在外周的暴露,从而大幅改善了对肾脏和骨骼的安全性,进一步增加了长期用药的安全系数。
TAF 对比 TDF 的 III 期临床试验 48 周、96 周和 144 周的结果均一致显示,TAF 治疗抑制 HBV DNA 的疗效与 TDF 相似,而 ALT 复常率更高,并且肾脏安全性和骨骼代谢的相关参数更优。
TAF 治疗对骨密度的影响更小,治疗 2 年,TAF 组的脊柱和髋关节的 BMD 变化相对轻微(图 3)。7
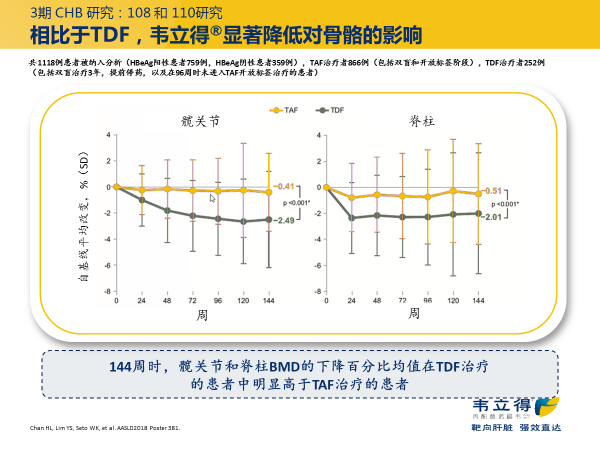
图 3. TAF 对比 TDF III 期研究 144 周的骨密度变化
对 III 期临床中 TDF 转换为 TAF 治疗的患者进行分析,也发现换用 TAF 治疗后,骨肾参数明显改善(图 4)。8
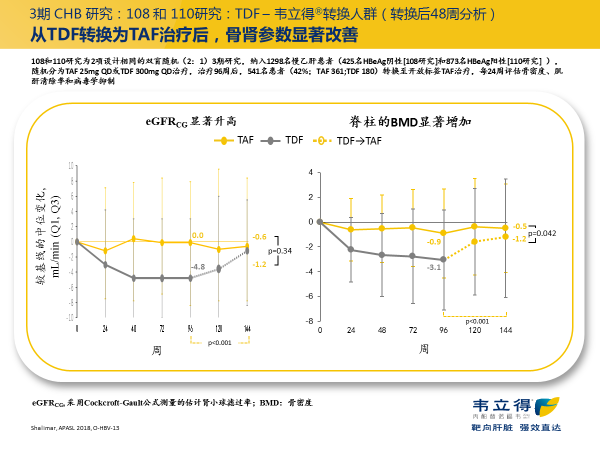
图 4. III 期研究 TDF 转换为 TAF 后的 eGFR 和骨密度变化
基于不同 NUC 的骨肾安全性不同,最新的 EASL 指南、AASLD 指南都推荐 TAF 优先用于伴肾功能不全或骨病或存在肾功能不全或骨病风险的 CHB 患者。9-10正在使用 TDF 治疗的患者若有潜在的肾脏损害或骨病或有肾损害或骨病风险,应考虑转换至 ETV 或 TAF(如果既往有核苷类似物暴露史,应选择 TAF)。9AASLD 指南则明确提出,ETV 和 TDF 所致潜在肾脏和骨骼疾病风险无显著差异,故 AASLD 在这两种药物之间无偏向性指导意见,而 TAF 所致骨骼和肾脏损害的风险发生率低于 TDF。 10
除具有良好的肾脏和骨骼安全性外,TAF 的整体安全性和耐受性有所提升,体现在 11:
★ 无需针对年龄为 65 岁及以上的患者调整剂量。
★ 轻、中、重度肾功能不全患者无需调整剂量。
★ 没有观察到 TAF 治疗的患者出现近端肾小管病变或范可尼综合征。
★ 无需针对肝功能损害患者调整剂量。
★ 关于生殖毒性,动物研究未发现 TAF 存在直接或间接有害影响。
1. 中华医学会骨质疏松和骨矿盐疾病学会. 中华骨质疏松和骨矿盐疾病杂志. 2017; 10(5): 413-443.
2. 中华医学会肝病学分会. 伴有肾损伤及其高危风险的慢性乙型肝炎患者抗病毒治疗专家共识. 临床肝胆病杂志, 32(12): 2241-2247.
3. Wong GLH, Tse YK, Wong VW, et al. Long-term safety of oral nucleos(t)ide analogs for patients with chronic hepatitis B: A cohort study of 53,500 subjects. Hepatology. 2015;62:684-693.
4. Tonon M, Piano S, Romano A ,et al. Assessment of bone mineral density in patients with cirrhosis treated with third-generation nucleos(t)ide analogues: comparison between tenofovir and entecavir. Eur J Gastroenterol Hepatol. 2018 Mar;30(3):284-290.
5. Sriprayoon T, Mahidol C, Ungtrakul T, et al. Efficacy and safety of entecavir versus tenofovir treatment in chronic hepatitis B patients: A randomized controlled trial. Hepatol Res. 2017 Mar;47(3):E161-E168.
6. Udompap P, Kim D, Ahmed A, et al. Longitudinal trends in renal function in chronic hepatitis B patients receiving oral antiviral treatment. Aliment Pharmacol Ther. 2018 Dec;48(11-12):1282-1289.
7. Chan HL, Lim YS, Seto WK, et al. AASLD2018 Poster 381.
8. Shalimar, APASL 2018, O-HBV-13
9. European Association for the Study of the Liver. EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection. J Hepatol (2017), http://dx.doi.org/10.1016/j.jhep.2017.03.021
10. Terrault NA, Lok AS, McMahon BJ, et al. Update on Prevention, Diagnosis, and Treatment and of Chronic Hepatitis B: AASLD 2018 Hepatitis B Guidance. Hepatology. 2018, https://doi.org/10.1002/hep.29800
11. 富马酸丙酚替诺福韦片(韦立得)产品说明书. 2018 年版
