过去十年以来免疫检查点抑制剂 (ICIs) 是癌症治疗领域最重要的进展,给癌症患者带来新的希望,这些 ICIs 包括抗细胞毒性 T 淋巴细胞抗原 4(CTL A-4)、抗程序性细胞死亡 1 (PD-1) 和抗程序性细胞死亡 1 配体 1 (PD- L1) 抗体。但是癌症免疫疗法并非是万能的,治疗过程中出现了一系列新的免疫相关不良反应 (irAEs),这些不良反应通常与传统的化疗相关毒性明显不同。
2019 年 5 月发表于 Nature Reviews Clinical Oncology(影响因子 IF:34.106)的一篇综述,详述了癌症免疫疗法中这些不良事件的流行病学及其动力学、危险因素、亚型和病理生理学,以及关于筛查和监测策略的新见解,强调了管理 irAEs 的重要影响。

靶向免疫检查点的单克隆抗体能够恢复抗肿瘤免疫,从而逆转免疫逃逸或逃避,促进肿瘤细胞死亡。近几年,CTLA-4 抗体与 PD-1 抗体的联合疗法被广泛研究,联合疗法比单药治疗效果更好,但是其毒性也增加了。
irAEs 发生的频率不仅取决于使用的药物、暴露时间和给药剂量,也取决于个别患者的具体特征,如内在危险因素。致命性 ICI 相关不良反应发病率约为 0.3%-1.3%。无论使用何种 ICI,具有致命后果的毒性往往发生在治疗过程的早期并迅速发展,尤其是在接受药物联合治疗的患者中。对于 ICI 联合治疗,发生致命毒性事件的平均时间约为 14.5 天,而对于接受 ICI 单药治疗的患者,此类事件的发生往往延迟至 40 天 (P < 0.001)。一项荟萃分析显示,不同治疗方案的死亡率差异很大。
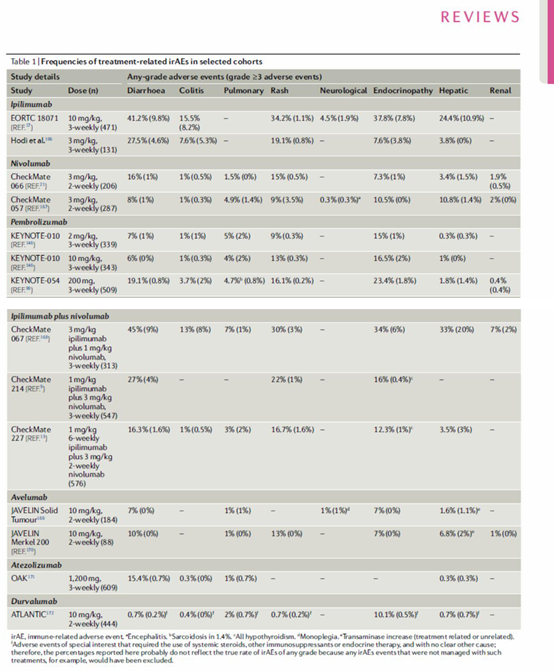
irAEs 的发生率和动力学怎么样呢?大部分 ≥ 3 级 irAEs 发生在起始治疗后 8-12 周内,其中腹泻和/或结肠炎最为常见 (发生在约 20% 的患者中),而皮疹通常最早出现 (图 a),其它相对不太常见的毒性反应 (发生在 3%-20% 的患者中) 包括瘙痒、肝炎和内分泌疾病(如垂体炎和甲状腺炎)。肝毒性通常比内分泌毒性发生得更快(开始治疗后 4-9 周内 vs 7-10 周内)。此外,一些罕见毒性 (发生在<2% 的患者中) 包括巩膜外层炎和/或葡萄膜炎、胰腺炎、肾炎、重症肌无力等。
研究表明,接受抗 PD-1 或抗 PD-L1 抗体的患者比接受抗细胞毒性 T 淋巴细胞抗原 4 (CTLA-4) 抗体的患者任何级别的 irAEs 发生率都要低,同时接受这两类药物联合治疗的患者的 irAEs 发生率最高。等级 ≥ 3 irAEs 的发生率分布相似,分别有 6% 的患者接受了抗 PD-1 和/或抗 PD-L1 抗体、24% 的患者接受了抗 CTLA-4 抗体和 55% 的患者接受了两种抗体联合治疗发生了等级 ≥ 3 irAEs。总的来说,接受联合免疫检查点抑制剂 (ICIs) 治疗的患者比接受单一治疗的患者更早发病。Ipilimumab(抗 CTLA-4 抗体)诱发的结肠炎通常发生在首次注射后 4-8 周,最后一次治疗剂量之后>2 个月后几乎从来没有见过结肠炎 (从结肠炎到最后一次使用 ipilimumab 的平均报告时间为 11 天 (范围:0-59)。ICI 诱发的垂体炎通常发生在 6 周-14 周的治疗中,在接受 ipilimumab 治疗的转移性黑色素瘤患者中,平均发病时间为 8 周。据报道,在接受 ICIs 治疗的患者在生化检测中出现新发或加重的甲状腺功能异常平均时间通常为 4-7 周。ICI 诱导的肝炎的发病时间似乎更加多变,一个小系列患者的数据表明,在治疗 1-14 周期间可能出现肝脏检测异常,中位发病时间为 3-9 周。据报道,接受 ipilimumab 治疗的患者在开始治疗的 1-7 周内出现神经功能障碍,尽管重症肌无力的发病稍早 (2-6 周,未显示),抗 PD-1 抗体治疗 4.5 周,联合 ICI 治疗 2 周。来自系统回顾的数据证实了这一间隔,表明神经功能的中位发病治疗 6 周后,经适当管理的 irAEs 预期 4 周内可部分或完全恢复。据报道,在接受 ipilimumab 治疗的患者中,从治疗开始到急性间质性肾炎 (AIN) 的发生间隔为 2- 12 周,且在治疗开始后 26 周出现延迟性 AIN。接受抗 PD-1 和/或抗 PD-L1 抗体治疗的患者 AIN 发病延迟,往往需要较长时间(3-12 个月)。风湿性 irAEs 是一种新的疾病学分类,平均发病时间为 7.3 周,发病时间广泛分散,在 ICIs 治疗>50 周还有可能出现此类不良反应。与接受抗 PD-1 或抗 PD-L1 抗体或 ICI 联合治疗的患者相比,接受抗 CTL A-4 抗体的患者肺炎非常罕见。据报道,在接受任何 ICIs 治疗的患者中,肺炎的平均发病时间为 2.5 个月 (由 2 个- 24 个月不等),预计可在 2-8 周内缓解轻微至中度肺炎的症状。另一项研究显示,肺炎的发病时间较短,从最初注射抗 PD-1 抗体开始,最早可在 9 天内发病。
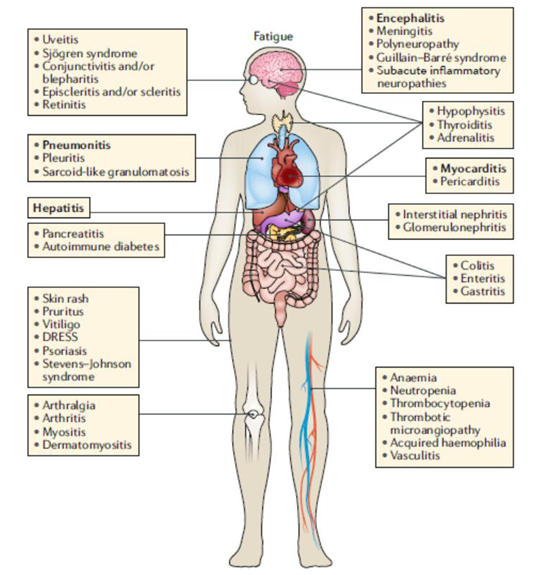
免疫检查点抑制剂 (ICIs) 促进 T 细胞的活化和发展,由于 T 细胞群的多样性和这些细胞浸润大多数器官的能力,ICIs 可以引起广泛的免疫相关不良事件 (irAEs),毒性可以以不同的频率和严重程度影响几乎任何器官。临床医生应该意识到这种情况很少见,然而威胁生命的 irAEs 不断地报道。下图中最常受影响的器官和最常见的 irAEs 在方框中标注出来,最容易造成死亡的用粗体标注出来。综述分别详细介绍了皮肤 irAEs、下消化道 irAEs、肺部 irAEs、脑垂体炎(hypophysitis)、甲状腺 irAEs、肝脏 irAEs、心脏 irAEs、神经 irAEs、眼 irAEs、风湿性 irAEs、肾脏 irAEs、血液学 irAEs 等
irAEs 该如何管理与监测呢?
目前已有多个关于 irAEs 管理的指南发布, irAEs 管理的要点如下:
在因免疫相关不良事件 (irAEs) 而停用免疫检查点抑制剂 (ICIs) 后,应根据个人情况,考虑到每个患者的临床环境和具体临床需要,决定重新引入免疫检查点抑制剂 (ICIs)。
神经系统 irAEs 应保守管理,只有对皮质激素敏感且完全解决周围神经病或重症肌无力的患者,才应尝试再挑战。相比之下,即使患有轻微脑炎的患者也不应再次暴露于 ICIs。
对于眼睛、肝脏、胰腺和肺部不良反应强烈的患者,建议永久性停用 ICIs。用抗细胞毒性 T 淋巴细胞抗原 4 (CTLA-4) 抗体再挑战是禁忌的,因为严重结肠炎的患者有复发和/肠穿孔的高风险。
建议在开始 ICIs 前进行严格的临床检查,包括评估每位患者的基线肠蠕动。
腹痛、腹泻和/或直肠出血应促使彻底的临床检查,包括消除感染原因,如艰难梭状芽胞杆菌感染,应取活检标本进行病理描述和分子分析。
等级 ≥ 2-3 的结肠炎表明需要停止 ICIs 并立即开始类固醇治疗。在 2-5 天内无症状改善时考虑英夫利昔单抗。延迟内镜检查与增加治疗难治性的风险相关。
分级 ≥ 3 的患者应考虑住院治疗,分级较低的患者应根据患者的共病情况、虚弱状况和进化动力学进行调整。
在症状持续改善 48 小时并延长 4-6 周后,应考虑类固醇的逐渐减少,以避免与 ICIs 的长半衰期相关的耀斑现象。
当某些症状出现时(如呼吸困难、咳嗽和心悸),应提倡全面的临床检查,包括排除感染性肺炎、肿瘤进展、肺栓塞、心脏事件和胸膜癌。
1 级肺炎提示需要保留 ICI,密切的临床随访直到症状消失。皮质类固醇应该在没有临床改善的情况下开始使用。≥ 2 级疾病提示除 ICI 外需要皮质类固醇。英夫利昔单抗和/或环磷酰胺治疗难治性肺炎时应考虑到这种方法的有效性有限和感染风险高。
激素耐受性不良的患者 irAEs 应考虑个性化的免疫抑制策略,包括使用针对关键炎症细胞因子的单克隆抗体。
在内分泌紊乱患者恢复 ICI 治疗前,应确保症状控制和恢复激素替代治疗(或格雷夫斯病患者的抗甲状腺药物治疗)
当出现无症状的生化异常时(如血清肌酐、肝酶和/或肌钙蛋白/肌酸激酶水平升高),应进行全面的临床检查。ICIs 可以在指标规范化之后恢复,然后进行密切监视。电解质紊乱应该引起怀疑是内分泌 irAEs(下垂体炎或肾上腺炎)或肾并发症。
irAEs 潜在风险因素
高危因素 (适应症避免使用免疫检查点抑制剂 (ICIs),如果不可能避免,在个性化监测策略下使用 ICIs)
结缔组织病(CTDs):炎性肌病 (多发性肌炎、皮肌炎)、系统性红斑狼疮、干燥综合征、系统性硬化症、抗合成酶综合征、类风湿关节炎、重度银屑病、混合性 CTD
血管炎:肉芽肿性多血管炎 (韦格纳肉芽肿病)、微小血管炎、好酸球性多発血管炎性肉芽肿症、严重的白塞病、大动脉炎、巨细胞动脉炎、血栓闭塞性脉管炎、川崎病、结节性多动脉炎、严重的免疫球蛋白 A (IgA) 血管炎(Henoch–Schönlein 紫癜)、严重的皮肤血管炎、风湿性多肌痛、严重的冷球蛋白血症和未分化的全身血管炎
其他自身免疫性疾病:原发性胆汁性肝硬化、严重自身免疫性肝炎、多发性硬化、严重的抗磷脂综合征、重症肌无力、格林·巴利综合征、炎症性肠病、及米费症候群、Vogt-Koyanagi-Harada 综合症、嗜酸性筋膜炎(舒尔曼综合症)、复发性多软骨炎和严重的自身炎症性疾病
治疗相关的因素:联合 ICIs 治疗,抗细胞毒性 T 淋巴细胞抗原 4 (CTLA-4) 抗体和任一种抗程序性细胞死亡 1 (PD-1) 或抗程序性细胞死亡 1 配体 1 (PD-L1) 抗体
内在因子:肿瘤与遗传异质性、肿瘤类型、肿瘤微环境与微生物群
中间风险因素 (在密切监视下管理 ICIs)
限制性和/或以前治疗过的自身免疫性疾病:I 型糖尿病,自身免疫性甲状腺炎,不严重的 IgA 肾病,IgM 肾病,白塞病、自身炎症性疾病、自身免疫性肝炎和抗磷脂综合征、恶性贫血、白癜风、Still 疾病和成人发病 Still 疾病、冷凝集素病、特发性血小板减少性紫癜和乳糜泻
限制性结缔组织病:银屑病关节炎和/或银屑病
irAEs 监察策略建议
一般预处理评估
身体状态:包括体重、身高、BMI
心血管功能: 包括心率、血压、心电图、血清肌钙蛋白和肌酸激酶水平、脑钠肽 N-末端前激素 (NT- proBNP)、血电解质和胸片
肾功能:包括估计的肾小球滤过率、尿中蛋白尿、肌酐尿、钙尿、钠尿及蛋白与肌酐比值分析
肝脏功能:包括血清总胆红素、天冬氨酸转氨酶 (AST)、丙氨酸转氨酶 (ALT)、γ-谷酰基转移酶 (GGT) 和碱性磷酸酶
免疫功能及/或感染状况:包括血清 C 反应蛋白 (CRP)、血沉、全血计数、抗核抗体筛查、补体 C3 和/或 C4、HIV-1 或 HIV-2、乙型肝炎病毒、丙型肝炎病毒和/或戊型肝炎病毒、人 T 淋巴细胞病毒 (HTLV-1) 和/或 HTLV-2,免疫球蛋白 G/免疫球蛋白 A/免疫球蛋白 M 用量、免疫减弱或免疫固定
分泌功能:包括血清皮质醇和促肾上腺皮质激素 (ACTH) 水平 (上午 8 点)、促黄体生成素 (LH),促卵泡激素 (FSH)、雌二醇、睾丸素、促甲状腺激素 (TSH)、游离 T4
胃肠功能:监测预处理前肠蠕动、粪便乳铁蛋白、钙保护素
预处理血清样品的保存
对特异性免疫相关不良事件 (irAEs) 和/或自身免疫性疾病的建立怀疑工作机制
疑似结缔组织疾病:存在抗 Ro/SSA、抗 La/SSB、抗 Sm、抗 nRNP/U1-RNP、抗 Scl-70、抗拓补异构酶、抗双链 DNA、抗 Jo1、抗组蛋白、抗 gp210、抗 p62、抗 sp100、抗着丝粒和/或抗 PM-Scl 自身抗体
疑似血管炎:存在抗中性粒细胞胞质抗体 (ANCAs) 与 c- ANCA 蛋白酶、p- ANCA 过氧化物酶和非典型 ANCA (x- ANCA 或 a- ANCA) 及冷球蛋白血症
疑似炎症性肠病:存在抗谷氨酰胺转胺酶自身抗体 (抗 tTG、抗 eTG)、抗酿酒酵母抗体
疑似自身免疫性肝炎:抗线粒体、抗肝肾微粒体 1 型、抗肌动蛋白、抗平滑肌自身抗体
抗甲状腺抗体的甲状腺炎:抗甲状腺球蛋白,抗微粒体和/或抗甲状腺过氧化物酶和抗 TSH 受体自身抗体
疑似类风湿关节炎:存在类风湿因子和抗环瓜氨酸肽
疑似糖尿病:存在循环胰岛细胞自身抗体
疑似重症肌无力:抗乙酰胆碱受体、抗麝香、抗神经节苷脂抗体
疑似抗合成酶综合征:存在抗磷脂抗体
疑似结节病:血管紧张素转换酶,折算钙含量和 24 小时尿钙测量
所有患者
出现新的自身免疫性疾病症状,如关节痛、肌痛、呼吸困难、心脏疼痛或心悸、腹泻、腹痛、干燥综合征、皮疹、结膜炎、硬皮病、头痛、恶心和呕吐等,应立即对疑似自身免疫性疾病的迹象进行调查
检查测试是可取的,但并非强制的
总之,这篇综述中指出,与临床实践中出现的大多数挑战类似,临床医生对这类新不良事件的特征有广泛的了解是帮助他们做出正确治疗决定的最佳工具。引入个性化的监测策略,使 irAEs 能够根据每个患者的风险状况进行管理,这将是一项重要的临床发展。
Filipe Martins, et al. Adverse effectsof immune-checkpoint inhibitors: epidemiology, management and surveillance. Nature Reviews Clinical Oncology (2019 May 15).