免疫组库 (immune repertoire,IR) 是指在任何指定时间,某个个体的循环系统中所有功能多样性 B 细胞和 T 细胞的总和。传统的免疫组库研究技术通常是用多重 PCR 技术或 5'RACE 扩增决定 B 细胞受体(BCR)或 T 细胞受体(TCR)多样性的互补决定区(CDR3 区),再结合高通量测序技术实现,但往往只能检测 TCR 和 BCR 一条链的序列信息。2015 年,10× Genomics 发布了基于微流控和油滴包裹技术的 Chromium 单细胞系统平台,可实现高通量的单细胞转录组和单细胞 V(D)J 测序。不但可以将 TCR/BCR 双链完美匹配,而且可以细化到单细胞水平,同时获得表达谱信息。
图 1 | 10× Genomics 单细胞系统
1、技术原理
10× Genomic 单细胞免疫组库测序是建立在 GemCode 技术上的微流体平台,将带有条形码和引物的凝胶珠与单个细胞包裹在油滴中;接下来在每个油滴内,凝胶珠溶解,细胞裂解释放 mRNA,通过逆转录产生用于测序的带条形码的 cDNA。液体油层破坏后,cDNA 一分为二,后续同时进行基因表达和免疫组库文库构建;其中 TCR 或者 BCR 的 V(D)J 序列通过设计在 TCR 或者 BCR、lg 的 C 区域的巢式 PCR 引物进行富集。然后使用 Illumina 测序平台对文库进行测序检测,即可一次性获得大量单细胞的基因表达和免疫组库数据,实现在单细胞水平同时对基因表达和免疫组库进行研究。

图 2 | V(D)J 重组产生 TCR/BCR 多样性

图 3 | 10× Genomics 单细胞免疫组库实验原理
2、实验流程
利用 10× Genomics 平台完成单细胞的分离、反转录成 cDNA 后,选择不同的研究目的进行文库构建:5' 基因表达文库、TCR 的 V(D)J 文库或和 BCR 的 V(D)J 文库。
将 cDNA 分成 2 份或 3 份同时进行 TCR/BCR 的 V(D)JJ 富集、文库构建和测序和 5' 单细胞转录组文库构建、测序,获得每个细胞表达谱和 V(D)J 全长序列,获得数据进行细胞亚群聚类、细胞表达特征和标记分子筛选等分析。
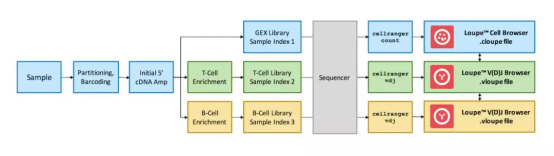
图 4 | 5'单细胞表达谱和 V(D)J 免疫组库实验流程
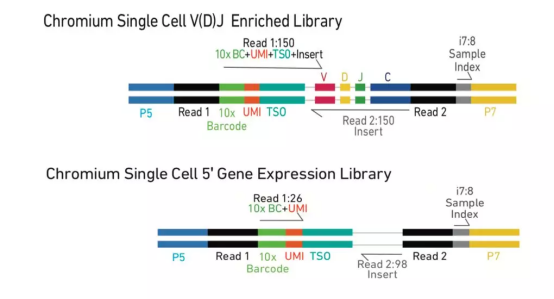
图 5 | 5' 单细胞表达谱和 V(D)J 免疫组文库的比较
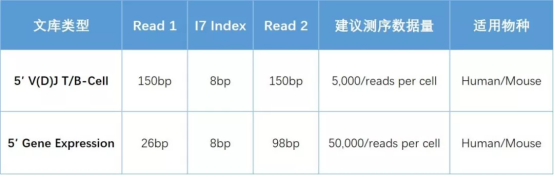
表 1 | 5' 单细胞表达谱和 V(D)J 免疫组文库及测序参数
3、分析内容

4、几种免疫组库检测方法比较

5、应用领域
免疫组库在肿瘤方面的应用
肿瘤细胞是具有免疫原性的,会引起 T 淋巴细胞浸润到肿瘤组织中,即浸润淋巴细胞(Tumor-infiltrating lymphocytes, TIL),多项研究表明肿瘤组织中 TIL 的存在及数量与病人生存期相关,因此 TIL 也许可作为一种肿瘤预后的生物标记物。免疫组库技术已用于多种肿瘤类型的 TIL 研究,例如结直肠癌、卵巢癌、肝癌、黑色素瘤。此外,免疫组库可以捕捉肿瘤发生时免疫微环境的变化,寻找免疫治疗的靶点,从而辅助免疫治疗更好的抗击肿瘤。
免疫组库在移植和免疫重建上的应用
器官或者骨髓移植时,经常会诱发宿主排斥反应的发生,从而发生慢性移植抗宿主病。同种异体反应,被随机分布在整个 T 细胞组库的交叉反应,因此延迟 T 细胞恢复和限制的 T 细胞受体多样性与异体移植后感染和疾病复发的风险增加相关。免疫组库测序技术可以检测移植后 T 细胞库,进行从而识别移植后感染或者复发的高危人群。
免疫组库在自身免疫性疾病方面的应用
自身免疫免疫性疾病是由于机体对自身抗原发生免疫反应而导致自身组织损害所引起的疾病。因此,利用免疫组库技术可分析异常表达的免疫细胞(T 细胞或抗体),作为临床诊断的标志物。寻找优于现有标准的生物标记物、研究免疫系统在自身免疫中的机制,从而为疾病的诊疗提供依据。
免疫组库在其他方面的应用
免疫组库在感染性疾病、抗体开发、用药及疫苗评估等多个方面均有应用价值。例如通过免疫组库研究,可以检测感染类疾病过程中的免疫动态变化;在抗体开发方面,可以获得特征性的 BCR(Ig)序列,缩短抗体开发的流程;也可以针对某种疾病用药后的外周血样本进行评估,确认药物是否激发免疫反应及其功效。
6、样本要求
◆ 样品类型:新鲜人或小鼠细胞悬液、血液(全血、PBMC 等)。
◆ 质量要求:细胞活性大于 80%,浓度为 500~2000 cell/μL,体积大于 50 μL,细胞直径小于 40 μm。
◆ 保存运输:为减少样本运输环节对细胞造成的影响,欧易生物提供上门服务。
经典案例 1
Single-Cell Map of Diverse Immune Phenotypes in the Breast Tumor Microenvironment
CELL 影响因子: 30.41 Elham Azizi at el. 23 August 2018, Pages 1293-1308.e36 https://doi.org/10.1016/j.cell.2018.05.060
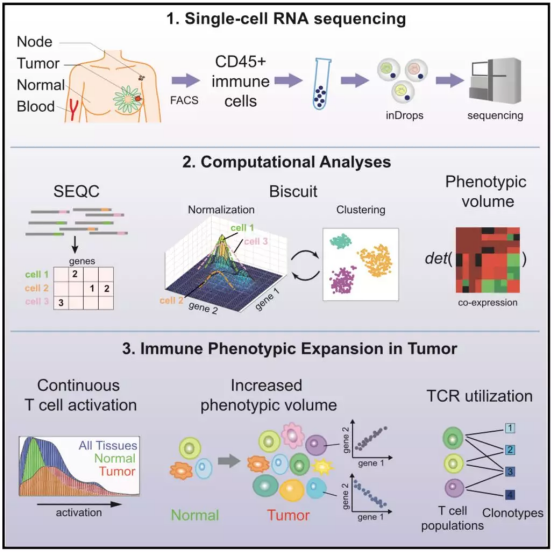
了解肿瘤微环境中免疫细胞的表型,对于癌症进展和免疫治疗反应的研究至关重要。研究者使用单细胞 RNA 测序分析了来自 8 位原发性乳腺癌患者的 45,000 个免疫细胞,同时也添加了正常乳腺组织、血液和淋巴结中的免疫细胞作对照。研究者开发了预处理流程 SEQC 和贝叶斯聚类和归一化方法 Biscuit,用来解决单细胞数据固有的计算难题。研究中观察到正常免疫细胞与肿瘤组织中免疫细胞之间有显著相似性,但后者针对肿瘤微环境出现特异性连续表型扩展。对来自另外 27,000 个 T 细胞的成对单细胞 RNA 和 T 细胞受体(TCR)测序,结果揭示了 TCR 组合使用对表型多样性的影响。研究结果支持 T 细胞连续活化模型,但不符合癌症中的巨噬细胞极化模型。本研究结果对表征肿瘤浸润免疫细胞具有重要意义。
经典案例 2
Landscape of infiltrating T cells in liver cancer revealed by single-cell sequencing
CELL 影响因子: 30.41
Chunhong Zheng at el. 15 June 2017, Pages 1342-1356.e16
https://doi.org/10.1016/j.cell.2017.05.035
2017 年 6 月 16 日,《Cell》杂志发表了由北京大学生命科学学院 BIOPIC 中心、北京未来基因诊断高精尖创新中心、北大-清华生命科学联合中心张泽民研究组,首都医科大学附属北京世纪坛医院暨北京大学第九临床医学院肝胆胰外科彭吉润研究组,以及美国 AMGEN 公司的欧阳文军研究组合作的题为 Landscape of infiltrating T cells in liver cancer revealed by single-cell sequencing 的研究论文,本研究首次在单细胞水平上描绘了肝癌微环境中的免疫图谱,通过对超过 5000 个 T 细胞的单细胞测序数据及分析,发现可能的肝癌靶点基因。基于生物信息学分析,通过对 T 细胞进行亚群分类、发展轨迹分析及比较不同亚群中 T 细胞克隆的分布,该研究探索了不同亚群之间的关系,鉴定每个亚群特异的基因表达,揭示了肿瘤中的 T 细胞在功能、分布和发展状态方面和其他部位的 T 细胞截然不同。