感谢由陆军军医大学第一附属医院西南医院MDT团队提供的精彩案例
本期案例展示的是1例胰腺癌的多学科综合治疗分析。2014年中华医学会外科学分会胰腺外科学组制定的《胰腺癌诊治指南》已将MDT讨论纳入诊断胰腺癌的常规流程[1]。2016版NCCN胰腺癌临床实践指南 [2]中也将MDT评估推荐为术前必要环节。
多学科诊疗的模式,应该根据每个患者的综合情况、肿瘤部位、侵及范围、临床症状,有计划的合理综合相关科室的诊疗手段,最大程度的控制、根治肿瘤,减少相关的并发症,从而改善患者生活质量,延长患者生存期。
陆军军医大学第一附属医院MDT团队集合肝胆胰外科、肿瘤内科、医学影像科、介入科、内镜科等各大学科,从各自的专业角度出发,制订针对性的诊疗方案,充分应用介入、内镜、化疗、营养、免疫治疗等多种手段,有效地提高了患者的生活质量、改善患者的预后。
初诊情况
患者女性,53岁。
主诉:肤黄、尿黄,纳差消瘦1月;患者于1月前出现肤黄、尿黄,纳差及体重下降,2016年8月经门诊入住山西省人民医院普通外科。
入院后术前诊断:胰腺癌;于2016年7月在山西省人民医院行胰十二指肠切除术。
术后病理示:胰腺腺癌。自发病来,精神尚可,饮食一般,大小便尚可。
既往史:患者4年前曾行子宫肌瘤腔镜切除术。
入院查体:皮肤粘膜正常,无黄染,腹部可见一手术疤痕,另可见一根T管,腹软,无明显压痛及反跳痛,未触及明显腹部肿块,肝肋缘下未扪及,肝脾区无叩痛,肾区无叩痛,腹部移动性浊音阴性,膀胱区无压痛,肠鸣音5-6次/分。
实验室检查示:肿瘤标记物CA19-9 > 500u/ml。
影像学检查:CT及MRI提示:胰腺钩突低密度3.5cm肿瘤。
初步诊断:胰腺癌术后。
MDT讨论及诊疗经过
第一次MDT讨论及治疗过程
1.MDT讨论
☆ 林恒副主任医师(肝胆外科胰腺组):
胰腺癌是常见的恶性肿瘤,恶性程度极高,近年来,随着影像学、病理、内镜及免疫治疗等学科的发展,胰腺癌手术切除率有了极大提高,围手术期病死率及严重并发症发生率显著下降,但病人预后仍无明显改善。此患者因发现皮肤巩膜黄染入住山西省人民医院,完善CT及MRI提示:胰腺钩突低密度3.5cm肿瘤,后行胰十二指肠切除术,术后病理提示胰腺腺癌。胰头癌恶性程度高,即使得以手术切除,病人亦多于术后1~2年内出现肿瘤复发或转移,术后中位生存期仅为22∼25个月。因此,应积极开展多学科综合治疗。
☆ 王槐志主任医师(肝胆外科胰腺组):
本例女性患者53岁,病理证实为胰腺腺癌。根据CONKO-001 [3]、ESPAC-3 [4]研究,推荐所有胰腺癌切除术后的患者均应接受6月的辅助化疗。虽然总体的研究结果并没有证明联合方案优于单药化疗,但分层分析后发现,对于体力评分较好的患者,联合化疗的效果优于单药化疗。患者已行根治性手术切除1月,现各项复查指标无化疗禁忌症,推荐行吉西他滨+卡培他滨的联合化疗,并密切观察患者对化疗的耐受性。
☆ 龚茜芬副主任医师(营养科):
对此类胰腺癌的患者需进行常规的营养筛查及评估,如果出现营养的风险或者营养不良,应积极给予营养支持治疗,从而预防肿瘤所导致恶病质的发生。建议给以患者25∼30kcal/kg体重,蛋白质1.2∼2.0g/kg体重,再根据患者的营养及代谢情况调整营养的供给。同时给予患者营养教育如饮食习惯、饮食构成和饮食的搭配。如患者在化疗过程中出现厌食或消化不良,可给予相关药物如胰酶片等改善食欲,促进消化。
☆ 张宏宇主任医师(肝胆外科胰腺组):
不同肿瘤可以通过不同环节的异常抑制免疫系统对肿瘤细胞的有效识别和杀伤从而产生免疫耐受,甚至促进肿瘤的发生、发展。肿瘤免疫治疗可以通过重新启动并维持肿瘤-免疫循环,恢复机体正常的抗肿瘤免疫反应,从而控制与清除肿瘤。目前主要有两种抗体,一种与T细胞表面的PD-1结合,另一种抗体与肿瘤细胞表面的PD-L1结合,使得T细胞的开关保持打开,从而清除肿瘤。该患者的基因检测结果显示:TMB值低于三分位值,PD-L1表达阴性。不适宜行免疫治疗。厄洛替尼联合GEM与单药GEM的对比研究结果,虽然联合治疗较GEM有统计学显著生存获益,但获益时间非常有限,所以先予一线方案联合化疗。过程中对患者进行ECOG评分。并监测血常规、生化、CA19-9, 胸部CT、上腹部增强CT等,及时调整综合治疗方案。
2.诊治经过
入院后于2016年8月行基因检测检查示:TMB比较低,PD-L1表达阴性。
于2016年9月8日开始化疗治疗,采用方案:GEM 1000mg/m2 ivgtt第1、8日 ;卡培他滨1000mg/(m2·d)po第1∼14日,每3周重复,共6个周期。
于2017年3月复查CT示(图1):肝门部复发伴肝转移,继续给予规律化疗治疗。
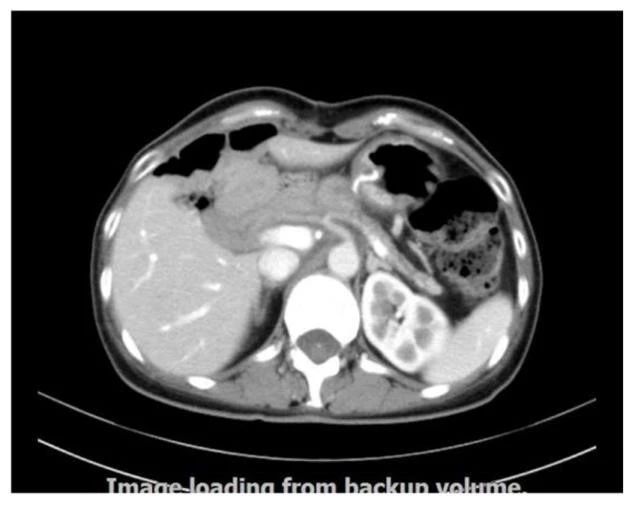
图 1 术后7月复查CT
2017年7月,复查CT(图2、图3)示:胰腺癌术后表现,胰尾部结节,性质待定。肝脏多发小结节,肠系膜及腹膜后多发淋巴结增大,包绕肠系膜上动静脉,考虑转移可能性大。上静脉局部管腔狭窄闭塞,腹腔内多发迂曲增粗侧支循环。
治疗方案调整:化疗改为伊立替康脂质体180mg/m2 第1日,亚叶酸钙400mg/m2 第1日 ,之后5-Fu2400mg/m2 civ, 46小时 ,2周重复。
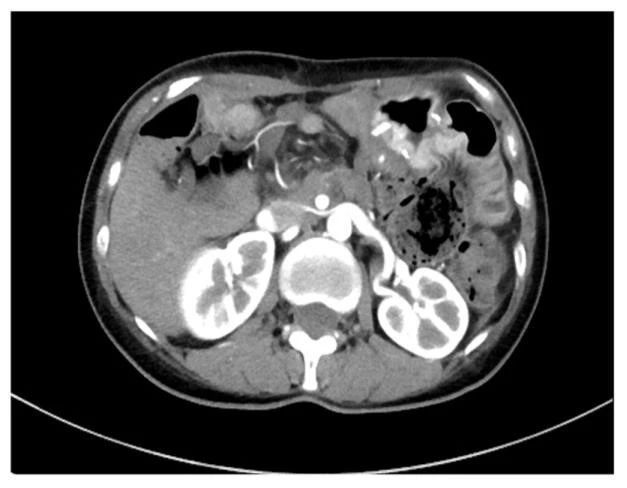
图 2 术后1年复查CT
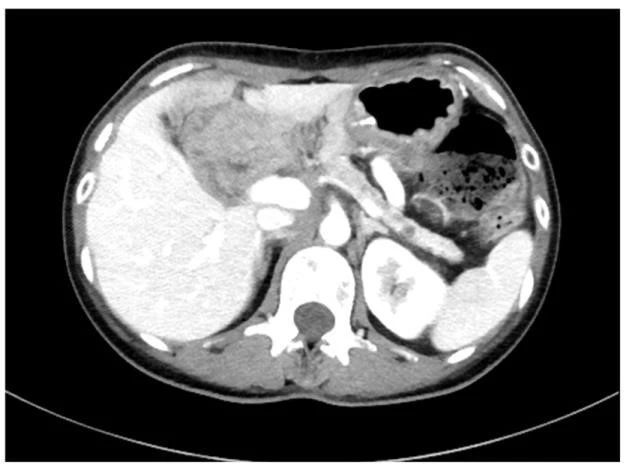
图 3 术后1年复查CT
2018年1月消化道反复出血 ,复查CT示:胰肠吻合口旁新增软组织结节,复查可疑,吻合口右旁多发结节,腹膜后及肠系膜淋巴结增大,较前变化不大。肠系膜上静脉、脾静脉汇合段管腔狭窄,食管胃底静脉曲张。
考虑由于肿瘤侵犯导致门静脉狭窄,再次入院后行经皮经肝门静脉支架植入术治疗(图4)。
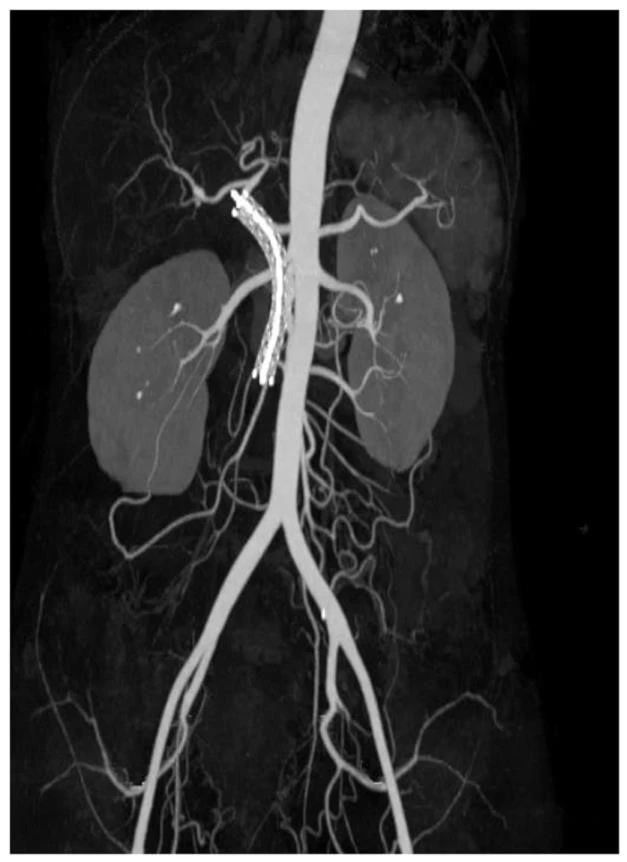
图 4 第一次支架
2018年2月下旬出现下肢顽固性的水肿,腹水;3月初出现明显的黄疸。
复查指标:
· 白细胞数目:9.55 × 109/L;
· 红细胞数目:2.23 × 1012/L;
· 血红蛋白 :66g/L;
· 血小板 :166 × 109/L;
· 总胆红素:268.8µmol/L;
· 直接胆红素:153.9µmol/L;
· 间接胆红素 :114.9µmol/L;
· 白蛋白:31.8g/L;
· 谷丙转氨酶:54.5 IU/L;
· 谷草转氨酶:66IU/L。
第二次MDT讨论及治疗过程
1.MDT讨论
☆ 张宏宇主任医师(肝胆外科胰腺组):
本例患者于2018年2月下旬出现双下肢顽固性的水肿、腹水。行腹部B超回报:肝周可见20mm间距液性暗区,盆腹腔可见间距约120mm的液性暗区。低蛋白血症纠正后腹水仍旧无法减少,结合CT结果,考虑下腔静脉受到肿瘤压迫导致阻塞,可能为静脉阻塞性漏出性腹水,但患者肿瘤晚期,且考虑局部复发,肝脏转移,亦需排除血性腹水可能性。建议完善腹腔穿刺,抽取腹水进一步明确腹水原因。患者出现黄疸,结合MRI及CT结果,考虑肿瘤压迫导致胆肠吻合口狭窄,通过PTCD(经皮经肝胆管引流术),可有效降低患者胆红素水平,减轻黄疸,改善肝功能。
☆ 黄学全主任(影像介入科):
2018年1月患者出现消化道反复出血,复查CT示:肠系膜上静脉、脾静脉汇合段管腔狭窄,食管胃底静脉曲张。考虑由于肿瘤侵犯导致门静脉狭窄,导致门静脉高压,食管胃底静脉曲张,行经皮经肝门静脉支架植入术治疗。结合患者B超,CT,MRI检测结果,门静脉主干内径10mm,门静脉右支流速16cm/s,白蛋白41g/L,考虑因肿瘤压迫导致下腔静脉狭窄,导致顽固性的腹水,建议给予下腔静脉支架植入术。患者梗阻性黄疸可行PTCD术,待全身情况允许时行胆肠吻合口支架植入术。
☆ 吉清主任(消化内科):
引起腹水原因甚多,应尽快确定腹水的性质,寻找病因,为减轻腹水引起的症状可进行必要的对症综合治疗。限制钠、水摄入,纠正低蛋白血症,应用利尿剂,从小剂量开始逐渐增大剂量,同时需严防电解质紊乱。如大量腹水影响到患者的呼吸或患者腹胀症状难以忍受时,可采取放腹水治疗,以减轻症状。患者黄疸原因考虑为梗阻性,需尽快解除梗阻,通畅引流,采取PTCD术风险小,但术后丢失大量胆汁,需注意内环境紊乱,营养不良等相关问题。
2.诊治经过
由介入科行下腔静脉支架植入术(图5),同时继续加强营养补给,纠正低蛋白血症,适度利尿,患者顽固性腹水逐渐减少,腹胀症状明显减轻;后行PTCD术,经PTCD通道给予胆肠吻合口的支架植入术治疗。

图 5 下腔静脉支架植入术
植入支架后,患者胆红素明显下降,肝功能明显好转(图6)。
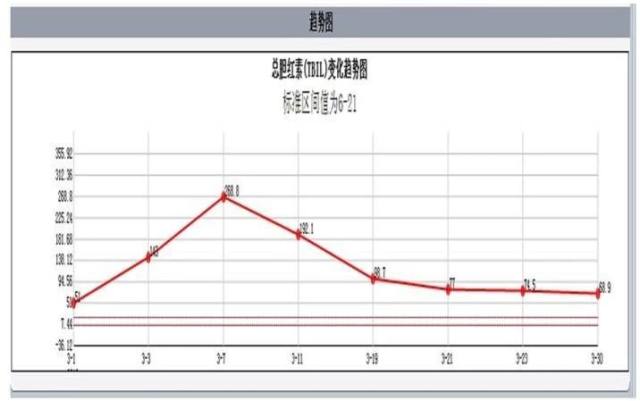
图 6 总胆红素变化趋势图
1周复查CT及腹部平片可见放置的支架:门静脉支架、下腔静脉支架,胆肠吻合口支架,解决肿瘤压迫所导致的门脉高压、下腔静脉高压、胆肠吻合口狭窄问题(图7)。
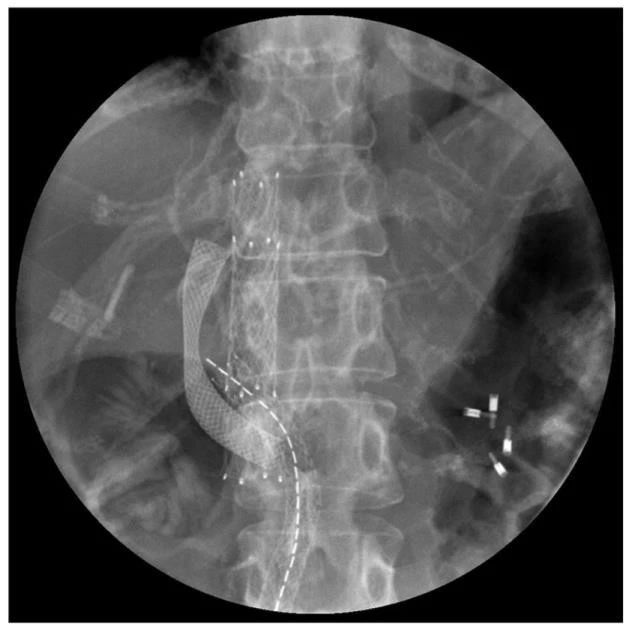
图 7 患者历经门静脉支架植入术、下腔静脉支架植入术,胆肠吻合口支架植入术,解决肿瘤压迫所导致的门脉高压、下腔静脉高压、胆肠吻合口狭窄问题
2018年5月在患者及家属的要求下,介入科行CT引导下穿刺活检(图8)。行第二次基因检测,全外显子基因检测。
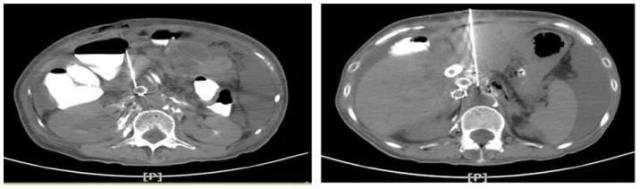
图 8 CT引导下穿刺活检
第二次基因检测结果:TMB高于三分位值(图9、图10),开始免疫治疗。
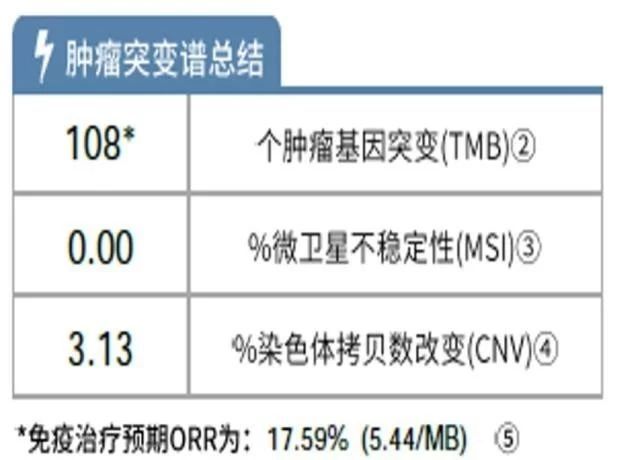
图 9 肿瘤突变谱总结
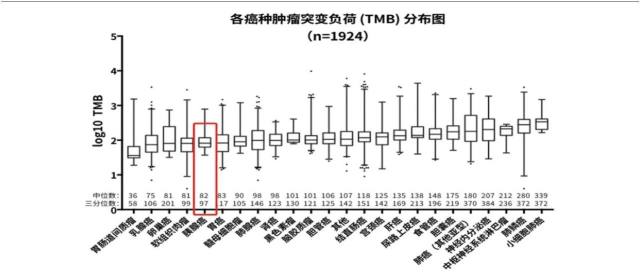
图10 各癌种肿瘤突变负荷分布图
治疗方法及结果:
患者接受Keytruda派母单抗单药治疗(2mg/kg)。两次治疗后疗效不明显,2018年5月初返回太原,继续使第三次治疗。两周后患者外出活动正常饮食并准备出院。一月后出现反复寒战高热败血症死。
讨论
近年来,MDT诊疗模式已经广泛应用于肿瘤学领域。而胰头癌恶性程度高,5年存活率<5% [5],多数患者一经诊断,已为进展期,仅约20%∼30%的患者有手术切除的机会;即使得以手术切除,患者多于术后1∼2年内出现肿瘤复发或转移,术后中位生存期仅为22∼25个月。因局部进展或远处转移无手术机会的病人,中位生存期仅为6∼9个月。同时,胰腺癌临床诊断困难、手术指征难以把握、围手术期及术后管理较为复杂,更需要多针对患者的不同情况实施综合性的诊疗。
本例患者治疗过程中,病情出现数次变化。手术后经一线化疗方案后肿瘤复发转移,改用二线化疗方案。后因门静脉高压导致消化道出血,给与门静脉支架植入术,消化道出血症状得到明显控制。经下腔静脉支架植入术,解决了肿瘤压迫所导致的下腔静脉狭窄导致的顽固性腹水。后又因肿瘤复发导致胆肠吻合口狭窄,给与胆肠吻合口支架植入术后梗阻性黄疸消退。该患者经过MDT讨论,制定了针对性的治疗策略,不同程度的改善了生存质量。
近期,美国癌症联合委员会(AJCC)发布了第8版肿瘤分期系统,对第7版TNM分期进行了修订与更新,其中对结直肠癌引入了非解剖性参数如微卫星不稳定、RAS基因及BRAF基因型等作为预后风险及疗效预测的附加指标,体现出肿瘤的评价体系已经从传统解剖学、形态学向生物学的转变[6] 。而胰腺癌则存在非常大的滞后性,分型仍局限于传统的形态学分型或分期,临床治疗方案的确立仍依靠经验性治疗,治疗的手段匮乏、模式单一,尤其是缺乏敏感的化疗药物、靶向治疗药物、免疫治疗药物及具有靶向治疗意义的评价指标。在这样的现实背景下,MDT模式是融合多学科优势、体现精准性治疗、完善个体化诊治方案的有效途径[7]。同时外科医生在临床诊疗思维模式上,要积极改变,完成从形态学上升到生物学,从外科学上升到肿瘤学的提升。
免疫负性调控分子PD-1/PD-L1在临床抗肿瘤治疗中的作用越来越引起人们的重视。PD-L1表达于不同肿瘤细胞的表面,其高表达会增强癌细胞抵抗机体免疫系统的攻击能力,是肿瘤发生、发展和转移的重要因素。PD-1抑制剂或PD-L1抑制剂通过阻断PD-1与PD-L1结合,刺激机体免疫系统,恢复T细胞的活性,从而增强抗肿瘤免疫效应。目前,PD-1/ PD-L1抑制剂已应用于肺癌、黑色素瘤、肾细胞癌等肿瘤治疗中,胰腺癌正处于临床试验阶段,初步的成果令人鼓舞。但是,如何提高药物的临床应答率、提高免疫治疗药物的治疗效果、建立个体化的联合治疗方案、避免联合用药的毒副作用依然是PD-1/PD-L1 阻断治疗的重大课题。深入探索免疫负性调控分子作用的机制、筛选出更加有效的预测疗效的标志物,对于提高PD-1/PD-L1阻断治疗有效率、克服毒副作用及防止肿瘤复发具有重要意义。同时,建立严格的免疫治疗评价体系及标准,探索不良反应发生的机制,将可能为预测预后风险及疗效、建立相应的个体化处置方案提供理论依据。可以期待,免疫治疗在不久的将来会像化疗一样成为胰腺癌患者的常规治疗手段之一。
参考文献:
[1] 中华医学会外科学分会胰腺外科学组 胰腺癌诊治指南(2014)[J]. 中华外科杂志, 2014, 52(12): 881 – 887.
[2] National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology:Pancreatic Adenocarcinoma(Version 2.2018)(2018-07-10). https://www.nccn.org
[3] Oettle H, Neuhaus P, Hochhaus A, et al. Adjuvant chemotherapy
with gemcitabine and long-term outcomes among patients with resected pancreatic cancer: the CONKO-001 randomized trial[J]. JA-MA, 2013, 310(14): 1473 – 1481.
[4] Neoptolemos JP, Moore MJ, Cox TF, et al. Effect of adjuvant chemotherapy with fluorouracil plus folinic acid or gemcitabine vs observation on survival in patients with resected periampullary adenocarcinoma: the ESPAC-3 periampullary cancer randomized trial[J]. JAMA, 2012, 308(2): 147 – 156.
[5] Hidalgo M. Pancreatic cancer[J]. N Engl J Med, 2010, 362(17): 1605–1617.
[6] Khorana AA, Mangu PB1, Berlin J, et al. Potentially Curable Pancreatic Cancer: American Society of Clinical Oncology Clinical Practice Guideline[J]. J Clin Oncol., 2016, 34(21): 2541 – 2556.
[7] 中国研究型医院学会消化道肿瘤专业委员会,中国医师协会外科医师分会多学科综合治疗专业委员会. 胰腺癌多学科综合治疗协作组诊疗模式专家共识[J]. 中国实用外科杂志, 2017, 37(1): 35 – 36.
关于领星
领星医学是由中美生物医学科学家携手资深肿瘤专家共同开创的肿瘤精准医疗服务平台,是一家集精准治疗方案筛选、精准治疗实施、精准治疗监测于一体的国际化公司,致力于从信息层面到操作层面集成化的高效服务,为肿瘤患者带来实质临床获益。通过人工智能,医疗大数据的驱动,逐步优化医疗资源的配置,医疗决策的落地,打通整体化,全方位的医疗路径,为中国的肿瘤患者和医生提供个体化精准医疗的临床解决方案及面向全球资源的对接服务。
领星医学检验所是领星医学和北京大学生命科学华东产业研究院联合挂牌的实验室,取得卫计委颁发的医疗机构执业许可,致力于为全国肿瘤患者或医疗机构提供以精准治疗为目的、以基因检测为核心的个体化检验项目与服务。
实验室严格按照ISO15189:2012、美国临床实验室改进修正CLIA'88、美国病理学家协会(CAP)的标准建立了完善的质量管理体系,为美国医疗机构提供临床检验报告的资质,以便有效利用欧美先进医疗技术,更好地为肿瘤患者、医疗机构提供服务。
此外,领星医学还将不断扩充和完善现有数据库,打造集约化的国际化标准检测平台、服务于最先进临床研究的生物信息分析平台和中国最大且符合国际标准的临床数据库,实现产业集群联动,成为具有国际水准的精准医学创新载体。
领星医学始终秉承从精准出发,不断创新,将最新的基因检测技术应用到临床,为临床医生提供专业的分子诊断策略,为更多肿瘤患者带来曙光。