感谢吉林大学第一医院钱磊医师提供的优秀案例

钱磊医师
吉林大学第一医院肿瘤中心主治医师
参与主要课题:国家科技部重大慢性非传染性疾病防控研究:肺癌诊疗方案及临床路径优化;国家卫计委重大疾病防治科技行动计划肿瘤防治类专项:吉林地区肺癌精准诊治应用研究及推广
▊ 病情介绍——入院前
患者男性,71 岁,缘于 2015 年 7 月因体检行肺部 CT 检查发现「双肺多发结节」(图 1,A-B),进一步行 PET-CT 检查,提示双肺结节代谢不高,考虑良性病变可能性大,后期规律复查,病变大小无明显变化。
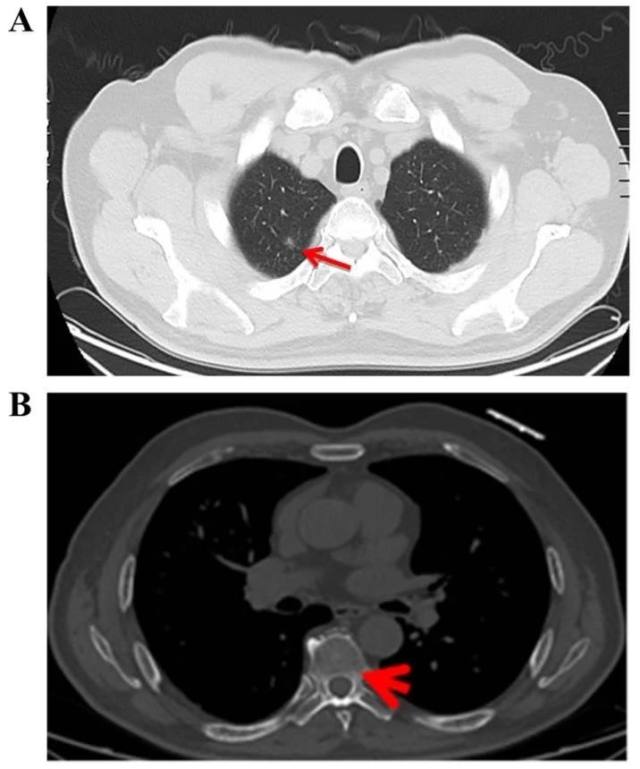
图 1 A-B 显示 2015 年 7 月首次发现右肺上叶毛玻璃影及可疑椎体骨质改变
2017 年 5 月复查肺 CT,提示右肺上叶毛玻璃影体积及密度增大,并出现第 7 胸椎显著的骨质破坏(图 2,A-B), 行 PET-CT:双肺多发磨玻璃结节,考虑恶性;右侧肺门及纵膈(2R、4R 组)淋巴结转移癌;右第 2 肋骨、右第 8 后肋、胸 7 椎体、骶骨骨转移癌;右第 12 肋骨骨质破坏,不除外骨转移。
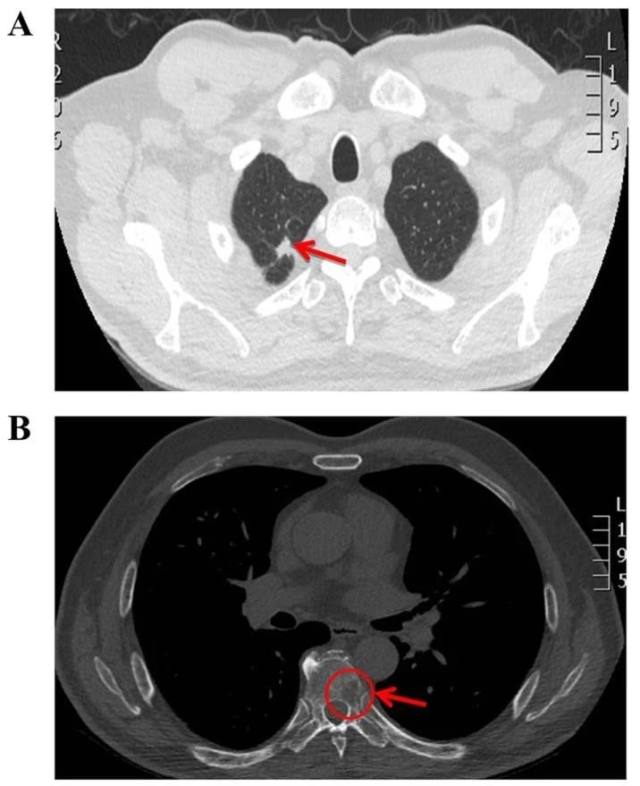
图 2 A-B 显示 2017 年 5 月患者右肺上叶病变实变,第 7 胸椎骨质破坏明显
为明确病理诊断,2017 年 6 月 6 日患者外院行胸腔镜下右肺上叶部分切除术。
术后病理:肺中-低分化腺癌。
免疫组化结果:ALK-VentanaD5F3 (-),ALK-Neg (-),BRAF-V600E (-),EGFR (3+),ROS1 (2+),Her-2 (-),C-MET(2+)。
基因检测结果:EGFR、ALK、ROS-1 阴性。
▊ 病情介绍——入院时
2017 年 6 月 26 日首次就诊于我科,考虑诊断为「右肺肺癌(腺癌 cT4N2M1b IV 期)、多发骨转移癌、右肺上叶部分切除术后。
症状:背部酸胀感,乏力;呼吸无困难,无咳嗽、咳痰
查体:未见明显异常
KPS 评分:90 分
PG-SGA:1 分
既往史:有长期高血压、冠心病、糖尿病,以及长期大量饮酒、吸烟史
因考虑患者存在第 7 胸椎骨转移,且骨质破坏较重,转入脊柱外科。2017 年 6 月 26 日局麻下行胸 7 椎体球囊撑开椎体成形术,并取病变组织,行病理检查。
病理结果回报:胸 7 椎体活检组织为转移性腺癌,结合免疫组化结果来源于肺。
免疫组化:Ki-67(+< 5%),TTF-1 (+),NapsinA (+),EGFR (+)。
Q:对于这样一例老年、合并疾病多、排斥化疗的肺腺癌患者,后续该如何选择进一步的系统治疗方案呢?
我们可以进行驱动基因的检测,同时进行 PD-L1 的检测。对于驱动基因阴性而 PD-L1 表达阳性的患者,有机会选择免疫疗法。此外,还需要结合其他重要的疗效预测指标,例如微卫星不稳定、错配修复基因功能缺陷、肿瘤突变负荷、Indel 数目和比例等。
分子病理检测结果:
● 患者 PD-L1 表达检测:
骨转移灶:肿瘤 15%+,炎细胞 20%+。
肺原发灶:肿瘤 10%+,炎细胞 70%+。
● 骨转移灶免疫组化:
MLH1(+20%,中),MSH2(+5%,中),MSH6(+5%,中)
● 肺组织全外显子组测序:
MSH6 缺失拷贝数 1.35, 提示送检样本中有错配修复基因损伤。
TMB 检测值为 49 个。
微卫星不稳定性检测值为 0.06%。
● 外周血全外显子组测序:
TMB 检测值为 408 个。
微卫星不稳定性检测值为 0.57%。
● 免疫治疗超进展因素分析:
患者肺组织与外周血的全外显子组测序结果显示,CCND1、CDK4、CDK6、EGFR、FGF19、FG-F3、FGF4、MDM2、MDM4 均未见异常。
综合分析:
● 组织标本 TMB 不高,而血标本 TMB 值显著高(以 95 为界);
● 骨转移灶免疫组化 MMR 表达低,全外显子测序 MSH6 缺失;
● MSI 低水平(以 3.5% 为参考值);
● Indels 数目和比例较文献报道肿瘤一般水平显著增高;
● 免疫治疗超进展相关基因未见异常突变,但患者年龄较大,存在超进展风险。
综合考虑,该患者具有对免疫疗法敏感的疗效指标且未见超进展相关因素,最终决定在密切关注下对该患者使用免疫治疗。
▊ 病情介绍——疗效评价
2017 年 7 月患者开始免疫治疗, 给予 Pembrolizumab 200 mg,每 21 天一次静点。
三个疗程后 (2017 年 10 月 9 日) 第一次疗效评价(图 3, A-B;图 4,A-B)。
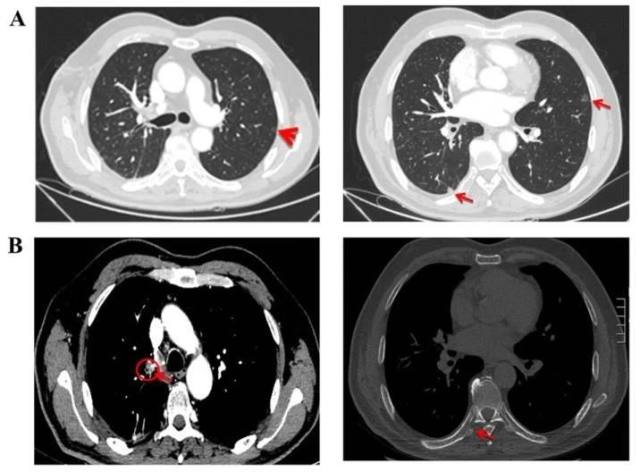
图 3 2017 年 7 月 17 日,治疗前基线期主要肿瘤病灶情况
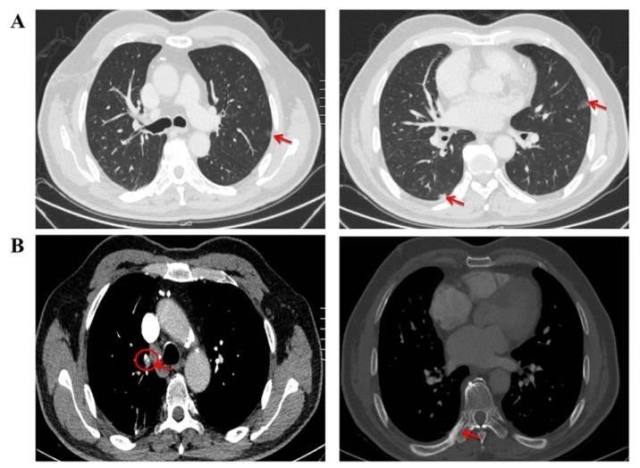
图 4 2017 年 10 月 9 日,3 疗程治疗后主要肿瘤病灶变化情况
疗效评价:患者的毛玻璃影似乎较前增大,密度似乎增加;纵膈淋巴结较前略有缩小,骨转移由破骨性改变转为成骨性改变。
Q:患者病灶略有增大,是疾病进展还是假性进展?
假性进展在人群中的发生率一般在 7-10%,其发生的原因是由于免疫激活后淋巴细胞浸润导致的肿瘤组织增大。假性进展的鉴别标志物一般包括 IL-8、乳酸脱氢酶、ctDNA 动态变化等,其中 ctDNA 的敏感性和特异性较好。
在一项黑色素瘤的研究中,将 ctDNA 的动态变化进行了良性和恶性的定义:
良性变化:基线和治疗过程中均未检测到 ctDNA 或基线可以检测到 ctDNA,但治疗过程中 ctDNA 浓度下降至少 10 倍甚至无法检测到;
恶性变化:基线可以检测到 ctDNA 且治疗过程中 ctDNA 浓度保持稳定或增加。
该患者外周血 ctDNA 丰度(图 5)由治疗前的 34.48%(2017-07-4),下降至 0.14%(2017-09-29),并在之后的多次监测中维持低水平。因此,尽管第一次评价患者的病灶略有增大,仍然考虑免疫治疗有效,可以继续用药。
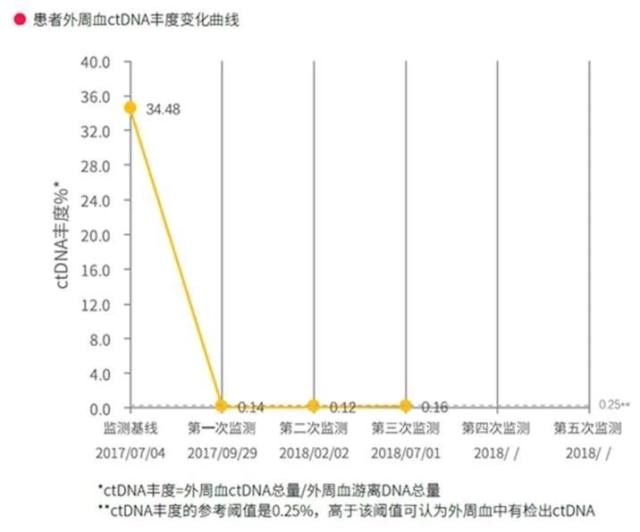
图 5 患者外周血 ctDNA 检测丰度变化情况
Q:患者目前治疗效果理想,治疗过程是否容易出现耐药?
关于免疫治疗耐药,研究表明 PTEN、JAK1/2 突变、β2M 缺失等会介导获得性耐药。而该患者无论是组织还是血液全外显子组检测的结果均显示,与免疫治疗耐药相关的基因均未发现突变(图 6)。
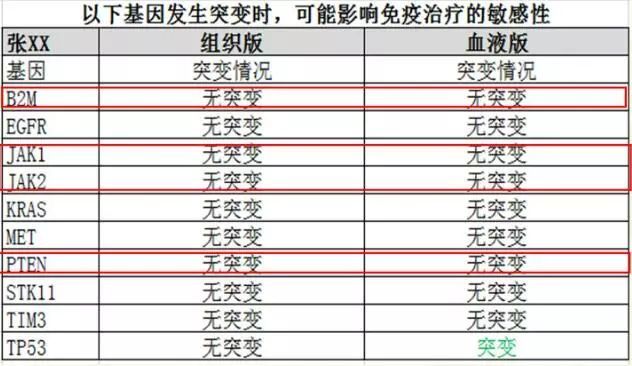
图 6 影响免疫治疗敏感性基因的检测结果
但是,由于肿瘤会随着治疗的发展不断产生变化,在治疗的过程中,可以进行液体活检定期监测关键基因位点,以争取在肿瘤发生耐药或进展之前早做准备,调整后续治疗方案。
至 2018 年 7 月为止,患者总共完成 16 疗程 Pembrolizumab 治疗,随后,患者自行停药。2019 年 2 月,即最近一次患者于海南省复查肺部 CT,肿瘤评估仍为 SD 状态。至此,患者无进展生存时间 (PFS) 超过 20 个月。
▊ 总结
● 预测疗效、避免超进展、识别假性进展是免疫治疗前后需要重点关注的问题,超进展必须提前预测,避免有害治疗;假性进展则需要尽早判定,坚定治疗的信心;
● PD-L1 作为疗效指标作用有限,需综合考量 MSI、MMR、TMB 以及新兴的 Indels 等指标;
● 一些基因扩增改变需要警惕超进展的发生;
● ctDNA 监测可能是提供识别假性进展的有效方法;
● 全外显子组测序可为免疫精准诊疗提供关键的信息。
▊ 关于领星

图片来源:领星