感谢由重庆医科大学附属第一医院邱建国医师提供的精彩案例

邱建国医师
主治医师,临床医学博士,重庆市医学会肝胆外科专业委员会青年委员,主要研究领域为肝脏肿瘤外科、肝癌侵袭转移的机制研究以及肝脏移植。
以第一完成人完成四川省科技厅支撑项目一项并参与多项国家自然科学基金,主持重庆市科委项目一项。
以第一作者发表 SCI 学术论文 13 余篇,参编英文专著 1 部。
▊ 基本信息
患者男性,49 岁。
既往史:既往有高血压病史,血压控制可;乙肝 30+年,20 年前因头皮外伤行头皮缝合术,10+年前因阑尾炎于巫山县人民医院行阑尾切除术,4 年前于我院行肛瘘切除术。
▊ 病情第一阶段
治疗方案
因「CT 发现肝占位 4+年,中上腹疼痛 3 天」于 2013 年 8 月第一次入院。血常规肝功未见明显异常,乙肝小三阳 AFP:40.98 ng/l;HBV-DNA:1.96 × 106。2013-8-21 剖腹探查+肝脏左外叶切除+肝脏右叶肿块切除术。2013-9-4 于我院 DSA 室于局麻下行「艾力 160 mg+艾恒 200 mg+吡柔比星 40 mg」方案经股动脉介入化疗。2013-09-09 出院。
第二次入院
2013-11-11 因第二次化疗再次入院,11-12 行 TACE。11-19 复查腹部增强 MRI 提示:肝脏形态不规则,左外叶缺如,肝右叶局部凹陷,考虑术后改变,随访。肝内多发大小不等类圆形结节,肝右叶包膜下两个结节强化不明显,肝周一过性强化,符合介入后改变,随访;余肝内多发结节,与 2013.8.15 旧片比较,部分病灶有缩小。肝门区及腹主动脉旁淋巴结显示。2013-11-24 AFP:14.73;2013-11-29 出院。
第三次入院
2014-01-06 因 TACE 再次入院。2014-01-08 MRI 提示:肝脏形态不规则,左外叶缺如,肝右叶局部凹陷,考虑术后改变,随访。肝内多发大小不等类圆形结节,肝右叶包膜下两个结节强化不明显,肝周一过性强化, 符合介入后改变, 随访;与 2013-11-19 片比较肝右后叶 2 个类圆形结节强化程度减低,考虑介入术后改变可能,随访;肝右后叶近肝包膜见一小片状信号影,较前片比较为新发病灶,增强后动脉期轻度强化,静脉期呈等信号,延迟后及肝胆期呈低信号;余肝内多发结节,较前片比较未见明显变化,建议随访复查。肝门区及腹主动脉旁淋巴结显示。2014-01-07 AFP:5.47;2014-01-09 行 TACE。2014-01-10 出院。
▊ 病情第二阶段
为行肝移植再次入院
2014-03-04 在全麻下行病肝切除术+同种异体肝移植术,术中见:腹中无腹水,肝脏有结节性硬化表现,大小约 20 × 15 × 7 cm,肝左外叶已切除,肝右叶表面可扪可见鱼肉样包块,约 3.2 × 2.5 cm 至 1.5 × 1.0 cm 大小,根据患者术前, 术中探查等情况,考虑为肝癌可能。病理诊断报告见图 1,术后肝功能变化见图 2。
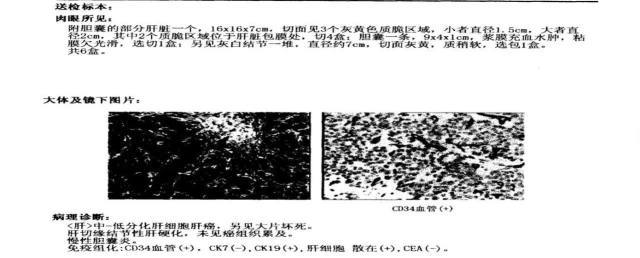
图 1 病理诊断报告
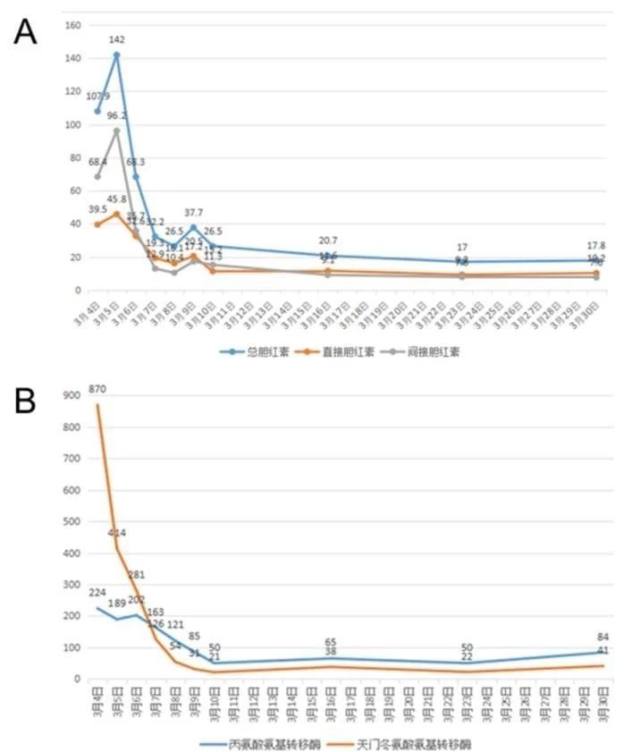
图 2 术后肝功能变化。A)总胆红素,直接胆红素和间接胆红素;B )丙氨酸氨基转移酶,天门冬氨酸氨基转移酶
▊ 病情第三阶段
移植肝肿瘤复发再手术
2016-06-07 患者男性,52 岁, 因「 肝移植术后 2+年,B 超发现肝左外叶占位 2 天」入院;AFP:43.5。E 抗体、核心抗体阳性;6.10 行腹部增强 CT,结果见图 3。
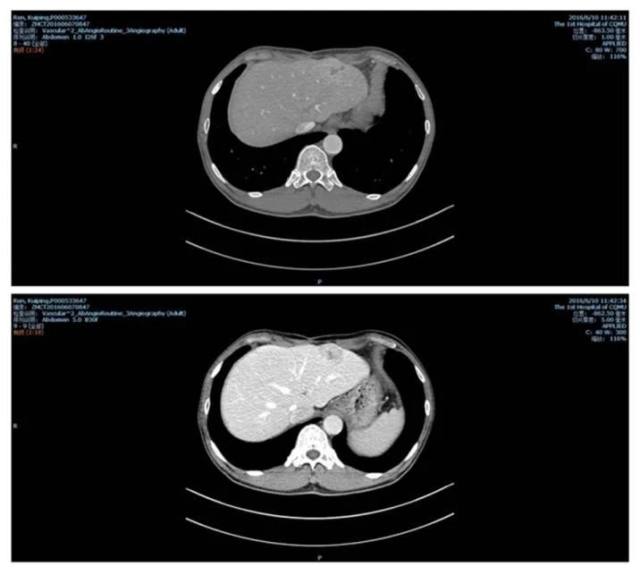
图 3 2016-06-10 腹部增强 CT
2016-06-14 在全麻下行「左肝外叶切除术+肠粘连松解术」。术后于 2016-07-05 出院,出院后一直口服索拉非尼抗肿瘤治疗;病检结果见图 4。

图 4 2016-06-15 病理诊断报告
▊ 病情第四阶段
移植肝肿瘤切除术后肿瘤复发
2017-11-13 再次入院。患者男性,53 岁,因「肝移植术后 3+年, 发现肝占位性病变 5 天」 入院。AFP:114 ng/l。11-14 日胸腹部 CT(图 5)
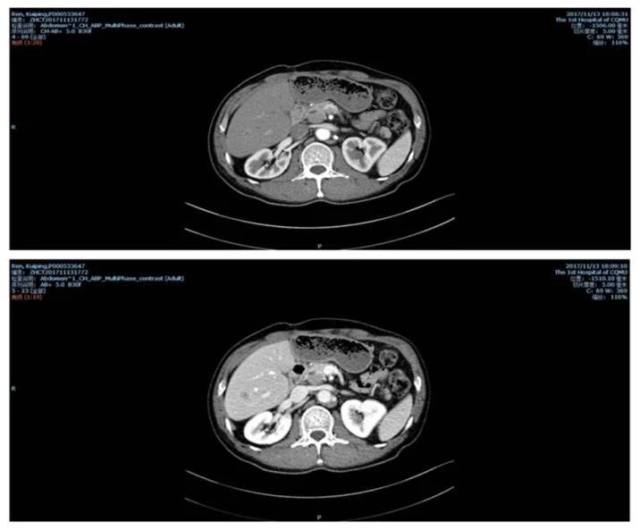
图 5 2017-11-14 胸腹部 CT
提示:右肺上叶微小结节,考虑炎性肉芽肿可能,随访以除外转移。肝左叶缺如,肝裂处点片状高密度影,符合术后改变。肝右后叶占位,考虑肝癌复发可能性大。门静脉增宽,提示高压。
2017-11-13 日行经皮肝肿瘤射频消融术。2017-11-18 日好转出院。
2018-02-28 患者男性,53 岁, 因「 肝移植术后 3+年, 肝肿瘤射频消融术后 3+月, 发现肝占位 2 天」入院;超声结果见图 6。

图 6 2018-02-28 彩超检查报告
2018-03-01 行经皮肝肿瘤射频消融术;03-02 出院。
2018-05-03 患者男性,54 岁, 因「 肝移植术后 3+年,发现肝占位 2 月」入院;5.4 彩超检查报告见图 7。
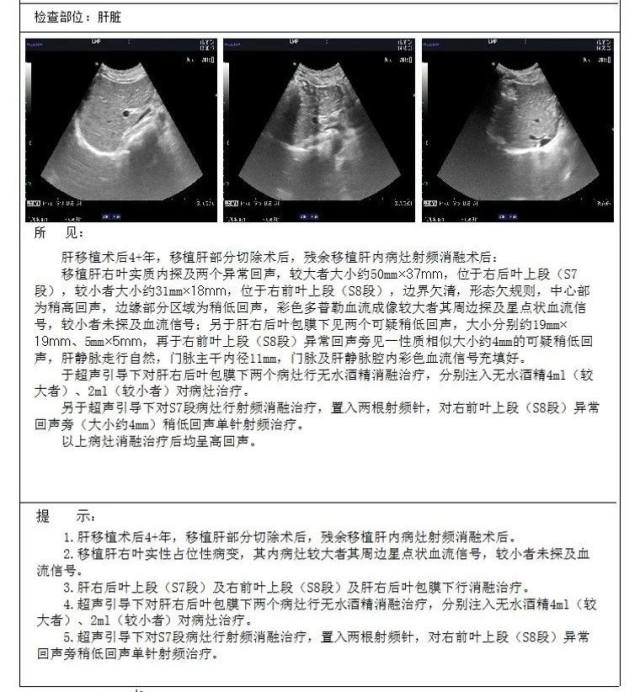
图 7 2018-05-04 彩超检查报告
2018-5-04 经皮肝肿瘤射频消融术+无水酒精肝肿瘤注射。
2018-05-07 AFP:182.36 ng/l;05-07 出院。
2018-06-09 门诊复查腹部增强 CT(图 8)
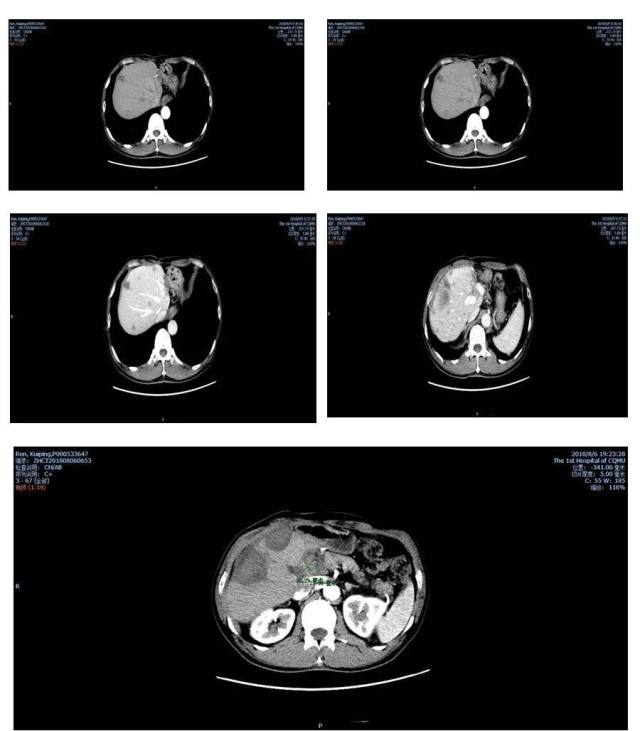
图 8 2018-06-09 腹部增强 CT
提示:肝内多发结节、肿块,考虑转移,较 2017-11-13 前片病灶明显增多、增大;另肝右叶两个较大肿块,其内斑片状较高密度影,增强扫描后无强化,提示凝固性坏死可能,结合临床。胰头旁淋巴结肿大,与胰头分界不清,考虑转移可能性大。右肺上叶微小结节,较 2017-11-13 前片一枚结节为新发,随访。右肺上叶前段、中叶内侧段少许纤维化灶。AFP >300 ng/l.
患者目前诊断考虑肝癌肝移植术后肝癌复发合并肝内多发转移(肺转移? 腹腔淋巴结转移?),后续治疗方案该如何制定?
▊ 免疫治疗联合靶向治疗
精准医学是将个体疾病的遗传学信息用于指导其诊断或医疗的医学,随着各国基因组计划的启动,我国在 2016 年 3 月启动「精准医学研究」重点专项,标志着精准医学时代的到来。
下图表示出肿瘤细胞的十大特征并列出相应的靶向药、化疗药物以及免疫检查点药物(图 9)。

图 9 肿瘤细胞的十大特征
下图列出了肝癌信号通路与驱动基因,其中重要通路有 EGFR 通路、RTK/RAS/PI3K 通路以及 WNT 通路,重要的基因有 PIK2CA、CTNNB、TP53 基因。
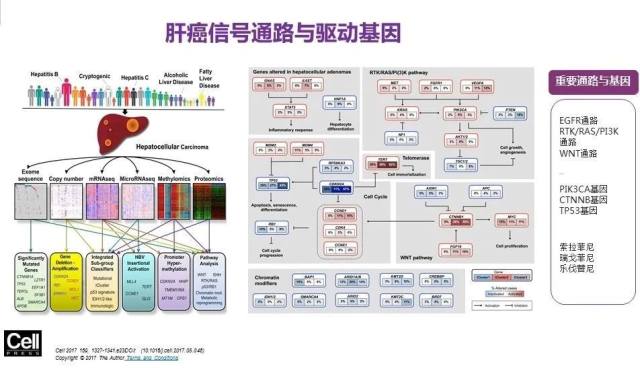
图 10 肝癌信号通路与驱动基因
肝癌靶向药物最新研究进展,索拉菲尼不用于术后辅助治疗(早中期)(图 11)。
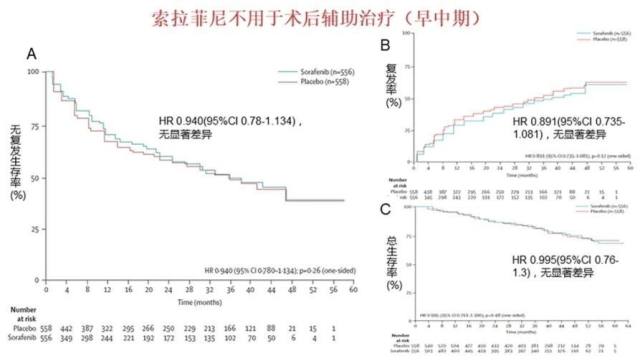
图 11 A 无复发生存率(%),B 复发率(%),C 总生存率(%)
PD-1/PD-L1 免疫疗法(immunotherapy)是当前备受全世界瞩目、正掀起肿瘤治疗的革命,引领癌症治疗的变革,为患者带来新的希望的新一类抗癌免疫疗法,旨在充分利用人体自身的免疫系统抵御、抗击癌症,通过阻断 PD-1/PD-L1 信号通路使癌细胞死亡,具有治疗多种类型肿瘤的潜力,实质性改善患者总生存期。
那么,PD-1/PD-L1 这类免疫治疗药物能否适用于这类免疫状态改变的器官移植患者呢?
PD-1 和 CTLA-4 信号通路在下调免疫系统活性方面非常重要。这两个信号通路都涉及到器官移植的耐受性,如果使用免疫检查点抑制剂,则可能会对这两个信号通路造成影响,导致对移植器官的排异反应。目前对于器官移植的患者使用免疫检查点药物没有任何指南,那么究竟是否完全关闭了这扇门?是否有吃螃蟹的病人呢?(图 12)

图 12 PD-1 病例报道
目前所有文献报道的案例是 12 个,12 名患者多数是肾移植,2 例患者是肝移植,1 例患者是心脏移植。大多数病例是之前治疗失败后的转移性黑色素瘤。(图 13)
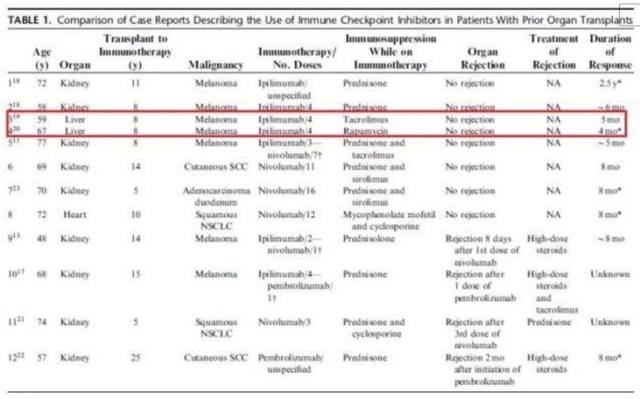
图 13 进行免疫检查点治疗的文献报道案例
在进行免疫检查点治疗的时候,所有患者使用免疫抑制治疗来避免排异反应。12 例中有 4 例发生了器官抑制排斥反应,4 例全部是肾移植, 使用血液透析来处理。12 例患者有 8 例患者病情稳定。其中在 2 名肝移植患者中,接受伊匹单抗治疗后,1 名患者肿瘤缩小,另外 1 名患者在开始治疗后 4 个月疾病才进展。似乎免疫治疗的疗效没有受到抗排异药物太大的影响。
针对此患者的治疗方案,进行免疫抑制剂联合靶向药物。
2018-06-25 行 SHR-1210 200 mg 每三周 1 次。乐伐替尼:10 mg,qd,p.o。
▊ 疗效评估
由于肿瘤的生长和凋亡比正常细胞快,因此肿瘤病人的外周血中存在大量来自于肿瘤细胞的游离 DNA 片段。ctDNA 以及肿瘤基因突变负荷(TMB)检测可作为预测 PD-1 抑制剂疗效的重要的生物标志物指标,具体疗效评估见(图 14-17)。
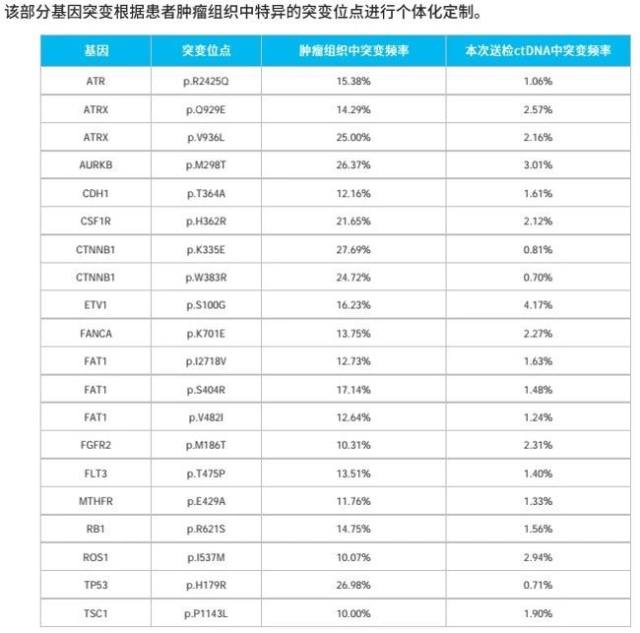
图 14 疗效评估之个体化定制突变位点检测结果
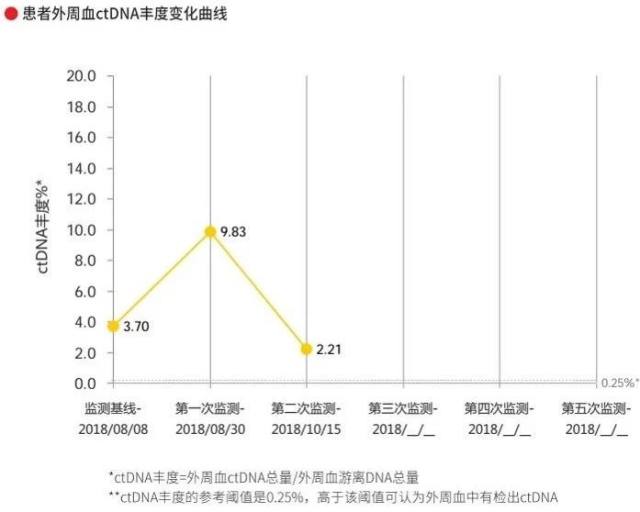
图 15 疗效评估之 ctDNA 丰度变化
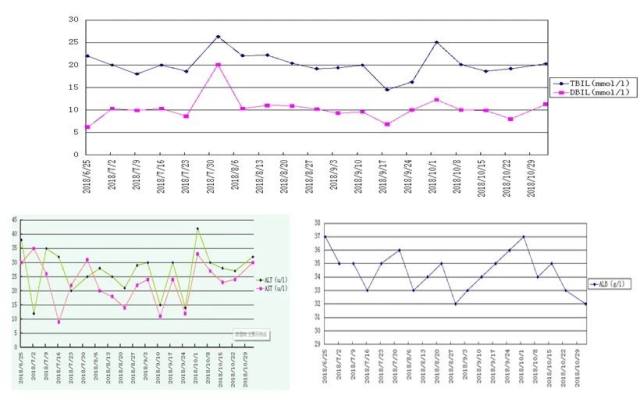
图 16 疗效评估之肝功能变化
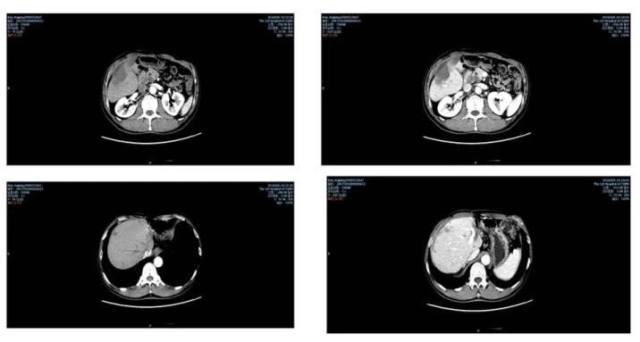
图 17 疗效评估之影像学改变
2018-8-7 复查胸、腹部增强 CT(图 22)提示:肝内多发结节、肿块,考虑转移,另肝右叶两个较大肿块,其内斑片状较高密度影,增强扫描后无强化,提示凝固性坏死可能,较 2018-6-9 日片无明显改变。胰头旁淋巴结肿大,与胰头分界不清,考虑转移可能性大,较前有缩小。肝左叶缺如,肝裂处点片状高密度影,符合术后改变。门静脉增宽,提示高压。肺气肿,双肺下叶轻度支气管扩张。右肺上叶微小结节,随访。右肺上叶前段、中叶内侧段少许纤维化灶。
患者一般情况较好,饮食、睡眠可;未出现 PD-1 抑制剂相关不良反映;患者从输注第二次 PD-1 抑制后出现右侧上腹部隐痛不适,止痛药可缓解。
▊ 总结与思考
抗排异药物是否会影响 PD-1 抑制剂的疗效?
在国外文献报道的 12 名患者中,至少有 8 名患者肿瘤缩小或稳定。其中在 2 名肝移植患者中,接受伊匹单抗治疗后,1 名患者肿瘤缩小,另外 1 名患者在开始治疗后 4 个月疾病才进展。似乎免疫治疗的疗效没有受到抗排异药物太大的影响。
哪些因素会影响 PD-1 类药物的排异反应?
免疫治疗和器官移植的间隔时间长短。时间越长,可能越不容易出现移植排异。
不同肿瘤、移植物和器官的免疫原性。比如,文献报道的 12 个案例中,出现排异反应的都是肾移植患者,这是因为肾小管上皮细胞中大量表达 PD-L1,那么用 PD-1 类抑制剂治疗就更容易发生排异反应。所以,肾移植患者比肝移植患者更容易出现移植排异。
不同的抗排异药物,对 PD-1 类药物的抗肿瘤作用影响不同。文献报道中的两位肝移植患者,1 位患者在治疗过程中使用他克莫司(FK506) 抗移植排异,没有出现排异反应,但是最后肿瘤进展了。另一位患者在治疗前将抗排异药物由他克莫司更换为雷帕霉素+吗替麦考酚酯(MMF),同样没有出现排异反应,但是最后肿瘤缩小了。所以说,雷帕霉素相对他克莫司对免疫治疗的干扰可能更小,是不是这样还有待进一步验证。
肝移植患者到底能不能用 PD-1 抑制剂进行治疗呢?
PD-1 抑制剂对一些肝移植患者来说,是可以使用的,但是必须要平衡抗肿瘤效益和避免移植排异的风险,如果效益大于风险,那么是可以使用的。
▊ 关于领星


图片来源:领星