● 本文仅限医疗卫生专业人士阅读
编者按:2019 年 1 月 12 日,富马酸丙酚替诺福韦,TAF(韦立得 ®)在北京、上海、广州、成都、武汉、西安等城市,六地联动共同举办韦立得 ®区域上市会。本文根据已公布的相关临床数据总结了 TAF 的特点,希望能给医生的临床工作提供一些便利。
TAF 特有的靶向肝脏机制赋予其高效安全的特征
TAF 的体外血浆半衰期达 90 min,显著长于 TDF 的 0.4 min,在血浆中更稳定。TAF 能直接靶向递送至肝脏,使得在较低剂量时即可达到相似的抗病毒活性、全身暴露减少,因此肾脏和骨骼毒性下降 [1]。1b 期研究发现,≤ 25 mg 的 TAF 能达到与 300 mg 的 TDF 相似的病毒抑制,但 TFV 的暴露减少 90% 以上 [2]。对机制的进一步研究 [3] 显示,TAF 能通过多个步骤被肝细胞有效地摄取和活化,使肝细胞内维持高浓度的活性代谢产物替诺福韦双磷酸盐(TFV-DP)。在犬体内的药代动力学研究表明,肝脏能高效摄取 TAF,摄取率约 65%[4]。
TAF 的抗病毒疗效与 TDF 相似
TAF 的全球 III 期临床研究 [5] 和我国 III 期研究 [6, 7] 显示,25 mg 的 TAF 抑制 HBV 复制的作用与 300 mg 富马酸替诺福韦二吡呋酯(TDF)相当,二者均具有卓越的抗病毒作用。
全球研究中,治疗 144 周时,TAF 组和 TDF 组的病毒学应答率(HBV DNA<29 IU/mL)在 HBeAg 阴性人群分别为 87%(TAF)和 85%(TDF),P = 0.71,在 HBeAg 阳性人群分别为 74%(TAF)和 71%(TDF),P = 0.59,如图 1。
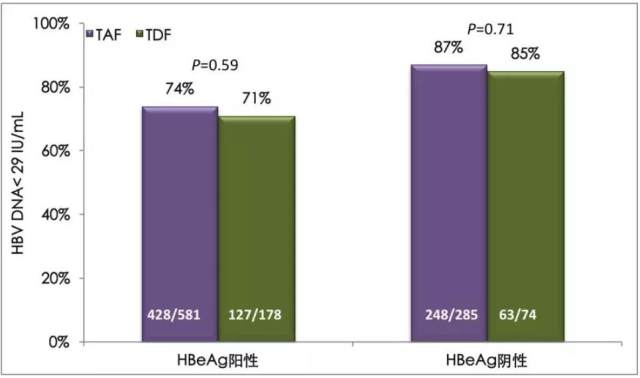
图 1. TAF 对比 TDFIII 期研究 144 周的病毒学应答
TAF 具有更高的生化学应答
TAF 与 TDF 相比,能取得更高的 ALT 复常率(男性 ≤ 35 U/L,女性 ≤ 25 U/L),治疗为 71%(HBeAg 阴性)和 64%(HBeAg 阳性),TDF 组为 59%(HBeAg 阴性)和 53%(HBeAg 阳性),P 值为 0.052(HBeAg 阴性人群)和 0.01(HBeAg 阳性人群)。如图 2。
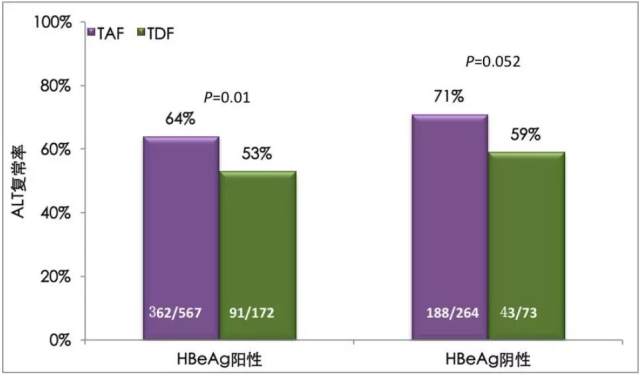
图 2. TAF 对比 TDFIII 期研究 144 周的生化学应答
最近对 ALT 复常与肝癌风险的关系得到了很多热议和关注。例如,AASLD2018 上韩国学者报告 [8],ALT 复常是预测慢乙肝肝癌发展的独立替代性指标。同期来自欧洲的研究提示,慢乙肝治疗 1 年时 ALT 是否恢复正常与 HCC 独立相关 [9]。我国香港学者的研究表明,慢乙肝治疗 1 年时 ALT 是否恢复正常与 HCC 独立相关 [10]。而在 2018 年年底引起热议的发表于 JAMA Oncology 的文章中 [11],TDF 治疗后比恩替卡韦能显著降低更多肝癌风险(推测核苷酸类似物产生的干扰素λ3 样作用可能也是其中一个原因),而分析显示,TDF 治疗的 ALT 复常率更高,并且 ALT 是影响 HCC 发生的因素。上述结果的临床意义值得借鉴和参考,也期待中国大陆的研究数据能够进一步探索阐明。
TAF 治疗 144 周「零」耐药
TAF 全球 III 期临床试验 [5] 中,治疗 144 周未检测到与 TAF 耐药有关的变异,突变病毒的表型分析,TAF 的敏感性未见下降,意味着 TAF 治疗 144 周保持「零」耐药。我国慢乙肝患者治疗 96 周同样未发现耐药。
TAF 的肾脏、骨骼安全性更优
TAF 对比 TDF 的 III 期临床试验 48 周、96 周和 144 周的结果均一致显示,TAF 治疗的肾脏安全性和骨骼代谢的相关参数理优。TAF 治疗对肾脏功能的影响更小,eGFRCG 的下降更少(图 3),近端小管蛋白尿标志物的变化更小。
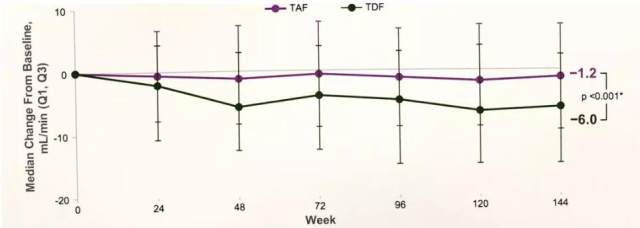
图 3. TAF 对比 TDFIII 期研究 144 周的 eGFR 变化
同样,TAF 治疗对骨密度的影响也更小,治疗 3 年,TAF 组的脊柱和髋关节的 BMD 变化相对轻微(图 4)。
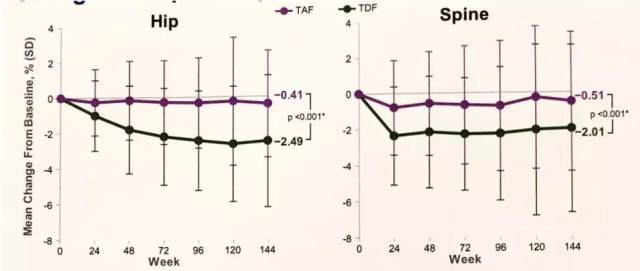
图 4. TAF 对比 TDFIII 期研究 144 周的骨密度变化
TAF 安全性良好,适用人群更广
除具有更优的肾脏和骨骼安全性外,TAF 的整体安全性和耐受性有所提升,绝大部分不良事件为轻~中度 [13]。
因应用 TDF 时曾有过乳酸性酸中毒和伴脂肪变性的严重肝肿大病例报道 [14],TAF 上市之初 FDA 也就这两种情况在 TAF 标签中做出了黑框警告。TAF 上市不到半年,2017 年 4 月,美国 FDA 同意取消了这部分黑框警告的内容 [15],目前在中国已经获批的 TAF 说明书中,没有黑框警告。但说明书中也提到,任何患者的临床或实验室结果如果提示使用 TAF 治疗过程中,如有乳酸性酸中毒或显著的肝毒性(可能包括肝肿大和脂肪变性,即便转氨酶没有显著升高),应当暂停 TAF 治疗。
此外,TAF 用于 HBV 母婴阻断的相关临床研究正在进行中,目前数据尚不充分(少于 300 例),但根据说明书中对于生育、生殖的动物研究数据以及 TDF 的母婴阻断数据,TAF 说明书中建议如有需要,可以考虑在妊娠期间使用 [13]。
TAF 提升的安全性还体现在 [13]:
● 无需针对年龄为 65 岁及以上的患者调整剂量。
● 轻、中、重度肾功能不全患者无需调整剂量。
● 未观察到 TAF 治疗的患者出现近端肾小管病变或范可尼综合征。
● 无需针对肝功能损害患者调整剂量。
● 关于生殖毒性,动物研究未发现 TAF 存在直接或间接有害影响。
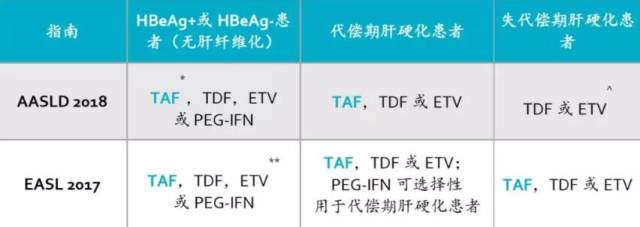
指南推荐
在最新 AASLD[1] 和 EASL 慢乙肝指南 [16] 中,TAF 作为一线口服抗病毒药物得到推荐。并且,伴肾功能不全或骨病或存在肾功能不全或骨病风险的患者应考虑使用 TAF 或 ETV,而不是 TDF。正在使用 TDF 治疗的患者若有潜在的肾脏损害或骨病或有肾损害或骨病风险,应考虑转换至 ETV 或 TAF(如果既往有核苷类似物暴露史,应选择 TAF)。
参考文献
1.Terrault NA, Lok AS, McMahon BJ, et al. Update on Prevention, Diagnosis, and Treatment and of Chronic Hepatitis B: AASLD 2018 Hepatitis B Guidance. Hepatology. 2018, https://doi.org/10.1002/hep.29800
2.Agarwal K, Fung SK, Nguyen TT, et al. Twenty-eight day safety, antiviral activity, and pharmacokinetics of tenofovir alafenamide for treatment of chronic hepatitis B infection. J Hepatol 2014;62:533–540.
3.Murakami E, Wang T, Park YJ, et al. Implications of Efficient Hepatic Delivery by Tenofovir Alafenamide (GS-7340) for Hepatitis B Virus Therapy. Antimicrob Agents Chemoth. 2015;59(6):3563-3569
4.Babusis D, Phan TK, Lee WA, et al. Mechanism for effective lymphoid cell and tissue loading following oral administration of nucleotide prodrug GS-7340. Mol Pharm 2013. 10:459–466.
5.Chan HL, Lim YS, Seto WK, et al. Three Year Efficacy and Safety of Tenofovir Alafenamide (TAF) Compared to Tenofovir Disoproxil Fumarate (TDF) in Hbeag-Negative and Hbeag-Positive Patients with Chronic Hepatitis B. AASLD2018 Poster 381.
6.Hou JL, Zhang LL, Duan ZP, et al. A Phase 3 Study Comparing Tenofovir Alafenamide With Tenofovir Disoproxil Fumarate in Patients From China With HBeAg-Positive, Chronic Hepatitis B: Efficacy and Safety Results at Week 48. APASL2018. HBV-C82
7.Ning Q, Duan ZP, Chen Y, et al. A Phase 3 Study Comparing Tenofovir Alafenamide With Tenofovir Disoproxil Fumarate in Patients From China With HBeAg-Negative, Chronic Hepatitis B: Efficacy and Safety Results at Week 48. APASL2018. O-HBV-12.
8.Choi J, Lim YS, Han SB, et al. Comprehensive Analysis for the Impact of on-Treatment Intermediate Endpoints on Outcomes of Hbeag (+) Chronic Hepatitis B AASLD 2018, Oral 267.
9.Papatheodoridis GV, et al. ALT Levels and Risk of Hepatocellular Carcinoma (HCC) in Caucasian Chronic Hepatitis B (CHB) Patients Under Long-Term Therapy with Entecavir (ETV) or Tenofovir Disoproxil Fumarate (TDF). AASLD 2018, Oral 265.
10.Wong GL, Chan HL, Tse YK, et al. Normal on-treatment ALT during antiviral treatment is associated with a lower risk of hepatic events in patients with chronic hepatitis B. J Hepatol. 2018 Oct;69(4):793-802.
11.Choi J, Kim HJ, Lee J, et al. Risk of Hepatocellular Carcinoma in Patients Treated With Entecavir vs Tenofovir for Chronic Hepatitis B A Korean Nationwide Cohort Study.JAMA ONcology. 2018. Sep 27
12.Chan HL, Marcellin P, Pan CQ, et al. No Resistance to Tenofovir Alafenamide Detected through 144 Weeks of Treatment in Patients with Chronic Hepatitis B. AASLD2018. Poster 386.
13. 富马酸丙酚替诺福韦片(韦立得)产品说明书. 2018 年版
14.Gilead Sciences. Prescribing information: VIREAD® (tenofovir disoproxil fumarate). https://www.gilead.com/~/media/files/pdfs/medicines/liver-disease/viread/viread_pi.pdf?la = en
15.Gilead Sciences. Prescribing information: VEMLIDY® (tenofovir alafenamide). https://www.gilead.com/~/media/files/pdfs/medicines/liver-disease/vemlidy/vemlidy_pi.pdf?la = en
16.European Association for the Study of the Liver. EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection. J Hepatol (2017), http://dx.doi.org/10.1016/j.jhep.2017.03.021