感谢由广东三九脑科医院,MDT 团队提供的精彩案例
病例资料
患者,女,25 岁,2016 年 7 月底因「头痛伴呕吐 4 小时」外院就诊,头颅 MR 提示右侧额叶占位并卒中。
2016-08-11 行手术切除,术后头痛、呕吐缓解。
术后病理:
镜下:送检肿瘤镜下见细胞密度明显增加,细胞弥漫性分布,肿瘤细胞多形性明显,呈梭形/圆形或不规则形,细胞核大,深染,核分裂象约 10 个/10 HPF,间质内可见巨核瘤细胞及多核巨细胞,另见胞浆呈泡沫状的「黄瘤样细胞」和血管周「淋巴袖套」形成,并见微血管增生和坏死。

图 1 镜下切片图
免疫组化:GFAP (+),Olig-2 (+),CD34 (+),Olig-2 (+),CD34 (+),NSE (部分+),Syn (-),P53 (约 5%,+),Ki67 (约 15%+)。
病理诊断:间变性多形黄色星形细胞瘤(WHO III 级)。
2016-12-09,复查头颅 MR 示肿瘤原位进展,行伽马刀治疗。
2017-07-21,患者再次出现头痛,头颅 MR 示右侧额叶肿瘤增大。
2017-08-10,行第 2 次手术,影像大部分切除。术中:肿瘤组织质软,血运丰富,无包膜,大部分界限不清晰,囊实性病变,内侧达岛叶至基底节区,大脑中动脉分支受压受侵犯。
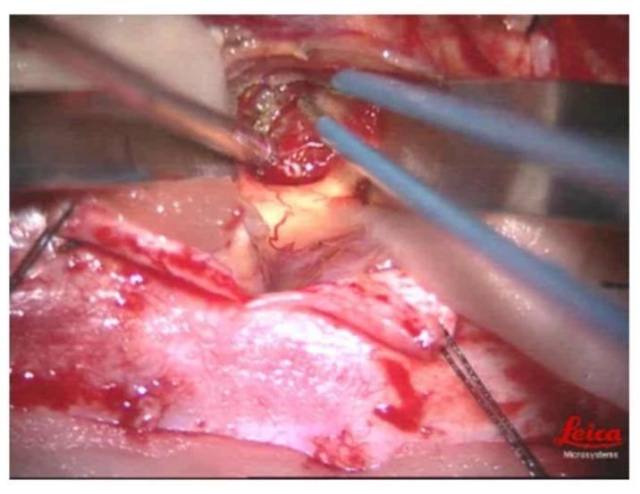
图 2 术中拍摄图
术后行放疗,局部放疗 Dt = 6000cGy/30f,同步替莫唑胺 75 mg/m2 化疗,后续行 5 程替莫唑胺辅助化疗(150 200 mg/m2 5/28d)。
术后病理:
镜下:送检肿瘤由梭形或卵黄圆形肿瘤细胞构成,细胞排列致密,细胞大小不一,部分瘤巨细胞,可见少量细胞黏附性差的上皮样肿瘤细胞,易见核分裂象>10 个/10 HPF,并可见假栅栏状坏死。
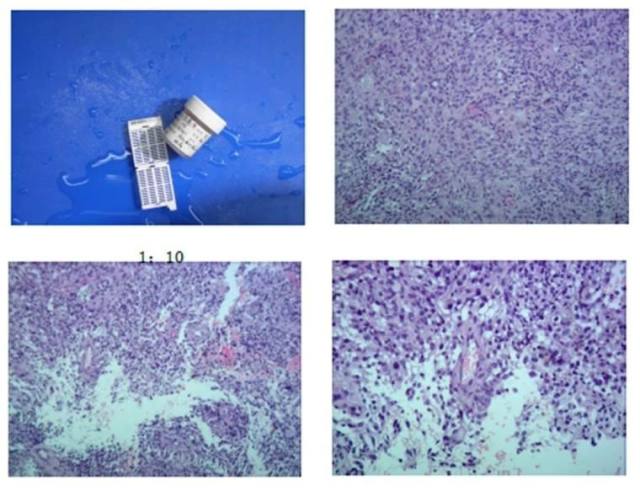
图 3 镜下切片图
免疫组化:GFAP (部分+),Olig-2 (+),EMA (局灶+),Vimentin (+),P53 (-),ATRX (+),MGMT (-),IDH-1 (+/-),Braf (+),Ki67 (30%,+)。
病理诊断:上皮样胶质母细胞瘤(WHO IV 级)。
5 程化疗后,肿瘤再次进展。全外显子测序提示 BRAF V600E 基因突变,BRAF 抑制剂类药物潜在获益。服用 BRAF 抑制剂维莫非尼 1 月,肿瘤强化、水肿范围稍缩小,影像疗效评估稳定。服用药物 2 月后患者自行停药。停药后 3 月,患者死亡。
以下是患者整个疾病进程的头颅 MR。

图 4 患者整个疾病进程的头颅 MR
A)首次术前头颅 MR:右侧额叶占位并卒中;B)首次术后 MR:肿瘤部分切除;C)2 次术前 MR:右侧额叶肿瘤进展,病灶呈囊室性合并卒中;D)2 次术后 MR:病灶大部分切除;E)服用维莫非尼前 MR:右额叶占位,水肿范围明显,中线移位;F)服用维莫非尼 1 月后 MR:强化较前减弱,水肿范围缩小,中线移位减轻。
讨论
该案例是一例年轻的继发于间变性多形性黄色星形细胞瘤的上皮样胶质母细胞瘤,虽然患者自行停药后的结局令人惋惜,但此前三九脑科神经肿瘤 MDT 团队的每一步手术、放疗、药物治疗决策都非常规范,已尽力为患者争取了更多的获益。
在第二次术后,三九脑科神经肿瘤 MDT 团队通过复发肿瘤组织的临床全外显子组基因检测(CWES)结果对患者的复发肿瘤分子病理特点与预后评估做了详尽的分析,结合基因检测结果,参考多篇临床研究的文献报道,对患者采用维莫非尼靶向治疗,稳定了病情。
对于这类没有治疗指南可供参考的罕见肿瘤,基因检测所提供的肿瘤分子病理信息在指导后续治疗策略的制定中就起到了不可忽视的作用。
接下来,让我们来认识一下上皮样胶质母细胞瘤吧。
上皮样胶质母细胞瘤(Ep-GBM)为 WHO 2016 版胶质母细胞瘤分类中的新增亚型,目前报道的病例数尚少,好发于儿童和年轻的成年人,典型者位于大脑表面或间脑实质内,多见于颞叶和额叶。组织学特征为弥漫成片、相对一致的上皮样细胞及不同比例的横纹肌样细胞,核分裂易见,伴微血管增生及坏死。
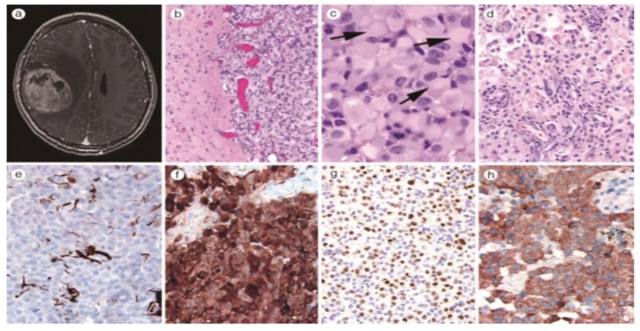
图 5 MRI 和组织切片
Ep-GBM 有其特有的病理学特点 [1]:
a)尽管影像特征没有特异性,但许多病例中肿瘤位置表浅且界清,如 T1WI 像;
b)组织学上,Ep-GBM 与周围脑组织分界尚清,常被误以为转移瘤;
c)肿瘤中以出现体积较大的上皮样细胞为特征,具有丰富的嗜酸性胞质、泡状核染色质及黑色素瘤样大核仁;
d)部分肿瘤细胞显示核偏位及核旁包涵体,常与横纹肌样肿瘤的形态相重叠,部分 Ep-GBM 瘤旁组织内可见较低级别的前驱性病变,局灶区可见多形性黄色星形细胞瘤区域,含有巨怪细胞,缺乏核分裂像,丰富的嗜酸性颗粒小体和黄色瘤样空泡状星形细胞;
e)通常 GFAP 局限阳性或完全阴性;
f)S-100 过表达,其他黑色素瘤标志物阴性;
g)其他神经胶质标志物,如 Olig-2 可阳性;
h)多数病例神经胶质标志物阴性,约半数的 Ep-GBM 存在 BRAF V600E 突变蛋白阳性。
分子特征方面:IDH 多为野生型,50% 以上有 BRAF V600E 突变 [2], 常伴有 ODZ3 半合子缺失。缺乏经典胶母的分子遗传特征:EGFR 扩增及 10 号染色体缺失。多为原发,极少为继发性,常合并 PXA(多形性黄色星形细胞瘤) 成分。有学者认为,上皮样胶质母细胞瘤和间变上皮样多形性黄色星形细胞瘤具有相同的组织学、免疫组化、分子和临床特征,二者密切相关或实为同一类型肿瘤 [3]。
Ep-GBM 在影像学上 CT 检查并无特征性表现,MR 多为大脑半球表面明显强化的实体团块,呈稍长 T1 稍长 T2 信号,增强后呈不规则斑片或明显环状强化。Ep-GBM 易出现卒中,有极强的侵袭性, 易沿软脑膜、脊膜、椎管、引流管等播散 [4–5]。儿童 Ep-GBM 是一种罕见肿瘤,侵袭性生长,具有成年人 Ep-GBM 组织学及遗传学特征 [5]。
有学者 [6] 对 Ep-GBM 病例进行了分子鉴定,采用基于阵列的甲基化和 BRAF、TERT 基因的直接测序分析肿瘤,证明了 Ep-GBM 队列中存在相当大的分子和临床异质性。
甲基化模式、拷贝数改变、突变分析数据结合临床发现,揭示了三种不同的已确立的肿瘤亚型:
(1)具有良好预后的 PXA 样肿瘤,主要发生于儿童和年轻人;
(2)IDHwtGBM 样肿瘤,主要发生于老年人,尽管 BRAF 突变频率较高, 但预后较差;
(3)RTK1 小儿 GBM 样肿瘤,发生于儿童和青少年,预后中等,伴有染色体碎裂和 PDGFRA 扩增。
临床和分子参数的单变量 OS 分析显示:年龄较大,存在任何致癌基因扩增,10q 缺失,以及来自 RTK1 小儿 GBM 或成人 IDHwtGBM 簇的肿瘤与低生存率显著相关。相比之下,具有 BRAF V600E 突变的肿瘤或与典型 PXA 聚集的肿瘤预后较好。
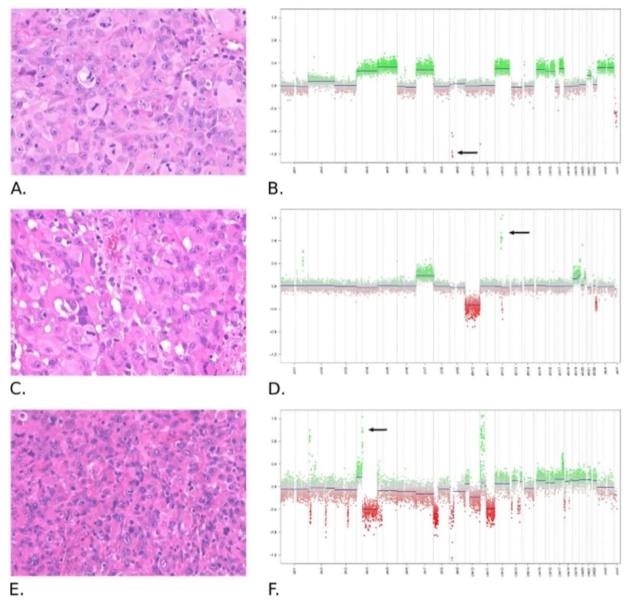
图 6 Ep-GBM 的组织病理学和细胞遗传学模式
Ep-GBM 的组织病理学和细胞遗传学模式:
A、B:来自「PXA 簇」的 Ep-GBM 显示无扩增,大量染色体增加和 CDKN2A 纯合性缺失(箭头)。
C、D:来自「成人 IDHwt 簇」的 Ep-GBM 检测到 CDK4 /MDM2 的扩增(箭头),7 号染色体的获得以及 10 号单倍体。
E、F:来自「RTK1 小儿 GBM 簇」的 Ep-GBM,具有 PDGFRA 的扩增(箭头)和染色体碎裂模式。
组织病理学定义的 Ep-GBM 不代表单一的诊断实体,而是代表至少三种分子和生物学上不同的类别。因此,建议通过全基因组分子谱分析进行分子检测,以进一步对这些罕见病例进行分类。
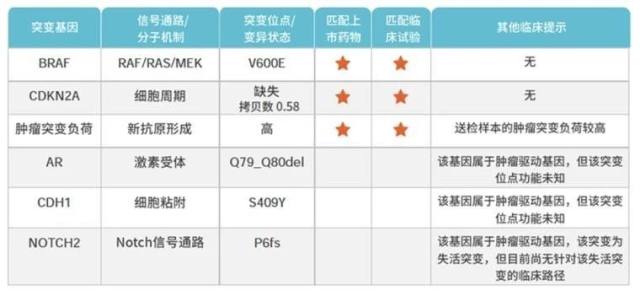
图 7 突变基因相关信息和临床提示
根据基因检测结果,该患者存在 BRAF-V600E 突变、CDKN2A 纯合性缺失(图 7),考虑为来自「PXA 簇」的 Ep-GBM。
Ep-GBM 预后差,手术、放化疗等常规治疗手段效果不佳,但其常伴有 BRAF-V600E 突变,BRAF 抑制剂是一种潜在的治疗药物。有文献报告,BRAF V600E 抑制剂维莫非尼在复发、难治的胶质母细胞瘤有一定疗效 [7–8]。鉴于 Ep-GBM 易出现脑脊液播散,建议治疗前完善脊髓 MRI、脑脊液细胞学检查,全基因组测序对判断预后、指导治疗有一定意义。
参考文献:
[1] Louis DN, Perry A, Reifenberger G, et al. The 2016World Health Organization Classification of Tumors of the Central Nervous System:a summary[J]. Acta Neuropathol, 2016, 131(6): 803 – 820.
[2] Kleinschmidt-DeMasters BK, Aisner DL, Birks DK, et al. Epithelioid GBMs show a high percentage of BRAF V600E mutation[J].Am J Surg Pathol, 2013, 37(5): 685 – 698.
[3] Alexandrescu S, Korshunov A, Lai SH, et al. Epithelioid Glioblastomas and Anaplastic Epithelioid Pleomorphic Xanthoastrocytomas–Same Entity or First Cousins?[J]. Brain Pathol, 2016, 26(2): 215–
223.
[4] Sugimoto K, Ideguchi M, Kimura T, et al. Epithelioid/rhabdoid glioblastoma: a highly aggressive subtype of glioblastoma[J]. Brain Tumor Pathol, 2016, 33(2): 137 – 146.
[5] Broniscer A, Tatevossian RG, Sabin ND, et al. Clinical, radiological, histological and molecular characteristics of paediatric epithelioid glioblastoma[J]. Neuropathol Appl Neurobiol, 2014, 40(3): 327 – 336.
[6] Korshunov A, Chavez L, Sharma T, et al. Epithelioid glioblastomas stratify into established diagnostic subsets upon integrated molecular analysis[J]. Brain Pathol, 2018, 28(5): 656 – 662.
[7] Robinson GW, Orr BA, Gajjar A. Complete clinical regression of a BRAF V600E-mutant pediatric glioblastoma multiforme after BRAF inhibitor therapy[J]. BMC Cancer, 2014, 14: 258.
[8] Kleinschmidt-DeMasters BK, Aisner DL, Foreman NK. BRAF VE1 immunoreactivity patterns in epithelioid glioblastomas positive for BRAF V600E mutation[J]. Am J Surg Pathol, 2015, 39(4): 528 –540.
感谢由广东三九脑科医院,MDT 团队提供的精彩案例
MDT 成员

蔡林波 放疗科
现任:
主任医师、医学硕士、暨南大学硕士生导师
广东三九脑科医院党委书记、副院长
广东三九脑科医院肿瘤综合治疗中心主任
兼任:
中国医师协会脑胶质瘤专业委员会第二届常务委员
中国医师协会脑胶质瘤专业委员会第一届小儿脑胶质瘤专业委员会副主任委员
中国抗癌协会小儿肿瘤专业委员会放疗学组副组长

赖名耀 肿瘤科
现任:
副主任医师、医学硕士、现任肿瘤综合治疗中心 主任助理
二区负责人、儿童神经肿瘤组组长
兼任:
广东省医师协会放射治疗医师分会委员兼秘书
粤港澳大湾区放射治疗医师联盟成员兼职秘书

胡清军 肿瘤科
主治医师,医学硕士
从事神经肿瘤放化疗专业 5 年,擅长各类儿童神经肿瘤的综合治疗,如脑干胶质瘤、生殖细胞瘤、髓母细胞瘤等
其他成员

放疗科:山常国、李娟
肿瘤科:周江芬
神经外科:朱丹、鲁明、林涛
病理科:李智、李海南
影像科:汪文胜、成丽娜
关于领星

图片来源:领星