2018 年 9 月是第 7 个世界阿尔茨海默病(AD)宣传月,今年世界阿尔茨海默病月的主题为「全球每 3 秒就有一例新发痴呆患者」,而 9 月 21 日是第 25 个世界阿尔茨海默病日,每年在全世界的许多国家和地区都要举办这个宣传日活动,提高人们对 AD 的认识和重视,促进尽早发现和科学防治。

图 1. 痴呆的全球负担和流行趋势
我国已逐步进入老龄化社会,目前我国痴呆患者已超过 1000 万,居世界首位,并且以每年增加 30 万以上新发病例快速增长,已成为影响我国经济社会发展的重大公共卫生健康问题和社会问题。
AD 是引起痴呆的主要原因,约占痴呆患者总人数的三分之二以上。本文主要结合国际进展和我们课题组前期工作重点讲述如何进行 AD 的早期诊断和科学防治,以提高大家对 AD 的重视水平及早期诊断和防治能力。
阿尔茨海默病的风险预测
越来越多的证据显示痴呆和其它慢病一样是可以预防的,这就把痴呆临床前期及痴呆高危人群的早期识别提高到了一个前所未有的高度。
阿尔茨海默病风险评估最常见的手段就是阿尔茨海默病预测模型:通过对各种风险/保护性因素、生物学标志物以及神经心理测验结果等多种因素进行综合分析,从而预测未来几年甚至几十年发生阿尔茨海默病的概率。
近期 BMJ 子刊《Journal of Neurology, Neurosurgery, and Psychiatry》在线发表了来我们团队的一篇痴呆风险预测模型的研究,将目前已有的痴呆预测模型分为中年预测模型、老年预测模型、轻度认知功能障碍向痴呆转化预测模型以及针对糖尿病患者的痴呆预测模型四类。详情请点击查看 >> BMJ 子刊:痴呆可以预测?这四大法宝请收好。
其中用于中年人群风险评估的 CAIDE(Cardiovascular Risk Factors, Aging, and Dementia)评分,纳入了年龄、性别、BMI 指数、胆固醇水平、收缩压水平以及体育锻炼强度等因素进行痴呆风险预测。其准确率较高,且其预测准确性经过了其他队列研究的验证。
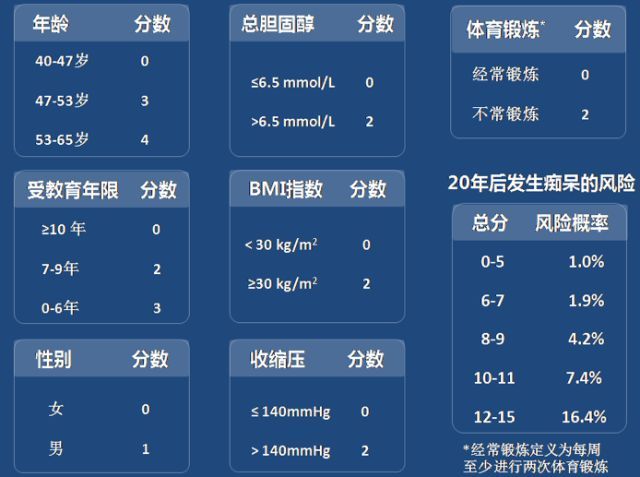
图 2. CAIDE 痴呆风险评分
用于老年人群的 DRS 痴呆风险评分(The Dementia Risk Score)通过对年龄、性别、BMI 指数、相关药物服用情况以及病史进行综合分析,对痴呆风险的预测也有较高的准确性。
随着阿尔茨海默病精准医学和个体化医疗的发展,预期在不久的将来可以依据个体的年龄、性别、教育水平、血管危险因素等一般临床特征,结合基因组遗传信息、体液中的分子标记、血糖、血脂、血压、BMI 等健康指标的检查及神经影像和 PET 等分子影像,构建出痴呆的精准预测模型。
进而对不同阶段、不同危险分层的个体给予不同的个体化精准干预措施,这也是我们课题组目前正在重点研究的工作。
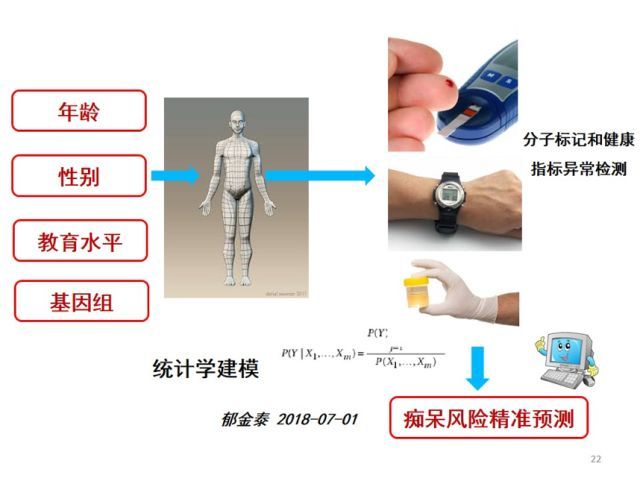
图 3. 痴呆风险精准预测模型
阿尔茨海默病的早期诊断
证据显示,约三分之一的痴呆是可以预防的,痴呆的早期诊断空前重要。而且近年许多 AD 防治药物以及旨在改善 AD 临床症状的新药的研发失败,也使得对 AD 早期诊断地需求越来越迫切。下表总结了到目前为止 AD 诊断标准的演变。
表 1. AD 诊断标准演变
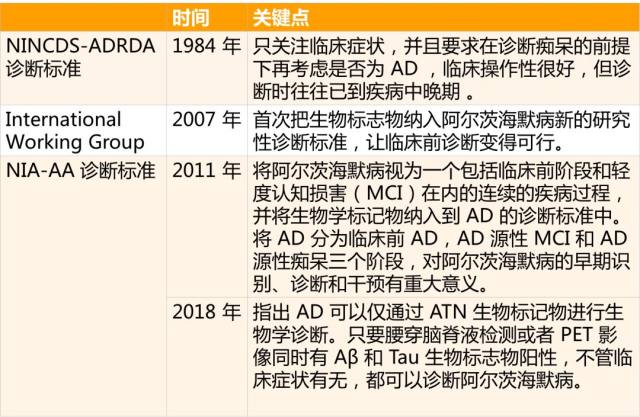
注:NINCDS-ADRDA:美国国立神经病语言障碍卒中研究所和阿尔茨海默病及相关疾病学会;NIA-AA:美国国立老化研究院和阿尔茨海默病协会。
近些年随着分子影像和神经生化技术的迅速发展,阿尔茨海默病的早期精准诊断变得越来越容易和准确。
目前淀粉样蛋白(A)改变已可以通过腰穿脑脊液检测或 Amyloid-PET 准确的检测,磷酸化 Tau(T)改变也可以通过腰穿脑脊液或 Tau-PET 准确检测,反映神经损伤变性 (N) 的标记可以通过腰穿脑脊液检测、FDF-PET 和 MRI 来评估,而这些生物学标记物为 AD 的早期诊断提供重要依据。
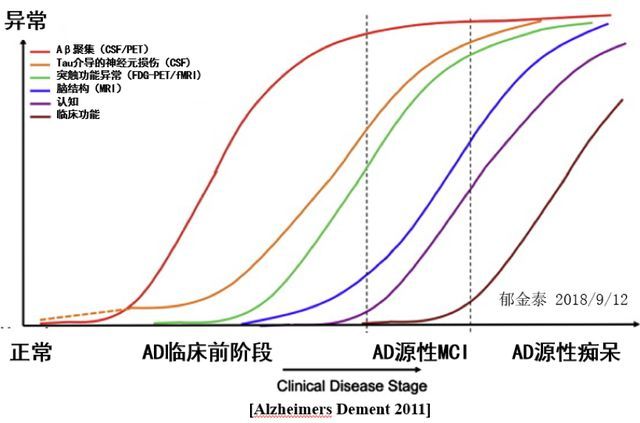
图 4. 阿尔茨海默病临床进程和生物标志物动态演变
阿尔茨海默病的淀粉样蛋白(Amyloid)(脑脊液/PET)改变早在临床症状出现之前 15~20 年就已经开始。随着疾病的进展,陆续出现 tau(脑脊液/PET)、突触功能异常(FDG-PET),海马结构(MRI)等标记物异常,最后才出现相关的临床症状改变。
今年,基于外周血阿尔茨海默病早期诊断标志物研发的突破性进展,极大地提高了其早期诊断的可操作性(Nature, 2018)。
阿尔茨海默病的科学预防
我们前期进行的大型循证分析表明,基于可调控风险因素(尤其是生活方式和血管风险因素)可以有效降低非痴呆老年人群阿尔茨海默病的发生风险。
其中特别需要注意的有 8 种危险因素和 4 种保护因素。它们贯穿了个体的早、中、晚年,为疾病预防提供了全方位靶点谱。
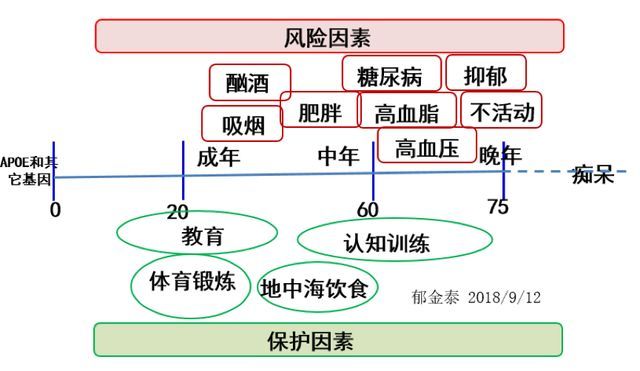
图 5. 阿尔茨海默病主要的可调控风险因素和保护因素
此外,基于阿尔茨海默病临床进程的 4 个阶段(无病理阶段、AD 临床前期、AD 源性 MCI 和 AD 源性痴呆),研究者进一步提出了同其它慢病预防一致的阿尔茨海默病三级预防的预防理念。
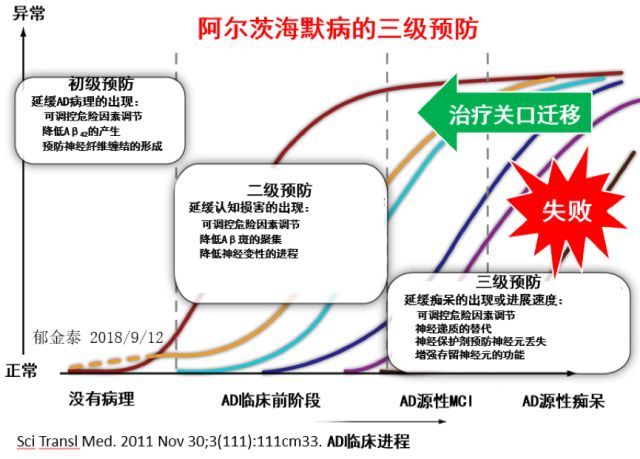
图 6 阿尔茨海默病的三级预防
(1)初级预防:针对最早期无病理阶段进行超早期干预,以调节 AD 病理物质的正常代谢(如减少 Aβ42 产生,预防神经原纤维缠结的形成);
(2)二级预防:针对 AD 临床前阶段(该期 Aβ代谢已经出现异常,但尚未出现认知功能损害)进行早期干预,抑制 Aβ斑块的聚集,降低神经变性的进程;
(3)三级预防:针对 AD 临床期(MCI 期和痴呆期)进行中晚期干预,以延缓痴呆的出现或进展速度。目前证据表明:针对 AD 临床期人群的第三级预防措施收效甚微,这也增加了干预关口前移的必要性和迫切性。
阿尔茨海默病的科学治疗
虽然阿尔茨海默病目前尚无法治愈,但采取某些药物或非药物手段可协助临床医师改善患者症状,因此患者出现早期症状时应积极求医,获得专业的指导。
目前已有 4 种药物获得美国食品药品监督管理局(FDA)批准用于改善临床症状,分别是胆碱酯酶抑制剂:多奈哌齐、卡巴拉汀、加兰他敏和谷氨酸受体拮抗剂:美金刚。
表 2. AD 的治疗
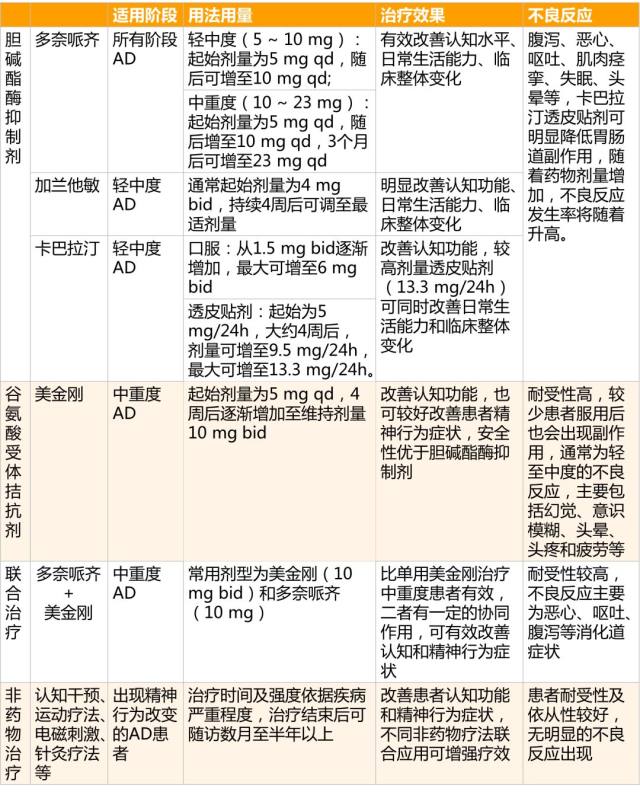
注意:使用药物治疗阿尔茨海默病过程中应及时监测药物疗效及安全性,临床医生应针对不同疾病阶段及症状的患者制定个体化用药方案。
前景展望
近些年来,随着各个国家对痴呆重视程度的逐渐提高,阿尔茨海默病的早期诊断和防治研究突飞猛进。在未来,我们将迎来阿尔茨海默病的精准医疗时代,基于体液生物标志物和分子影像的早期诊断技术将会得到广泛的应用,极大地推动了阿尔茨海默病的早期防治药物和非药物研发、临床试验和临床实践。
基于血液、唾液和尿液等非侵入、易操作生物标记物的研发将为我们提供更多方便可行的早期诊断措施。此外,阿尔茨海默病基因检测芯片技术的临床应用将会给阿尔茨海默病的风险预测带来革命性的突破。
近些年来,诸多失败案例似乎为阿尔茨海默病药物的研发蒙上了阴影。但是伴随着众多阿尔茨海默病防治领域新的进步,阿尔茨海默病的科学防治工作必将逐渐走向柳暗花明。
目前,进入临床试验阶段的阿尔茨海默病药物种类繁多,特别是以 Aducanumab 为代表的 Amyloid 靶向治疗药物和以「甘露寡糖二酸(GV-971)」为代表的多靶点干预国产抗阿尔茨海默病药物的成功研发,很值得大家的期待。
阿尔茨海默病是一个复杂性疾病,因此在疾病的不同阶段,联合多种防治机制(神经递质调控疗法、神经保护治疗、靶向调控治疗、危险因素干预疗法)的「鸡尾酒疗法」有望成为未来主流的 AD 防治模式。
此外,人工智能技术和 AD 诊断、防治的结合也让人备受期待。「路漫漫其修远兮,吾将上下而求索」,人类对疾病的认识和攻克从来都不会是一帆风顺,人类历史上天花、结核等一系列重大疾病的攻克,尤其近几年来肿瘤治疗领域的重大突破,让我们对尽早攻克阿尔茨海默病越来越有信心。
作者:青岛市市立医院神经内科 郁金泰、李洁琼、侯晓禾、徐伟、王作腾、窦凯昕、谭兰

图 7. 青岛市市立医院神经内科谭兰和郁金泰团队
编辑 | 王弘
投稿及合作 | wanghong@dxy.cn
题图来源 | shutterstock
参考文献
1. Hou XH, Feng L, Zhang C, Cao XP, Tan L, Yu JT. Models for predicting risk of dementia: a systematic review. J Neurol Neurosurg Psychiatry. 2018 Jun 28. pii: jnnp-2018-318212. doi: 10.1136/jnnp-2018-318212. [Epub ahead of print]
2. Li JQ, Tan L, Wang HF, Tan MS, Tan L, Xu W, Zhao QF, Wang J, Jiang T, Yu JT. Risk factors for predicting progression from mild cognitive impairment to Alzheimer's disease: a systematic review and meta-analysis of cohort studies. J Neurol Neurosurg Psychiatry. 2016 May;87(5):476-84.
3. Jack CR Jr, Bennett DA, Blennow K, Carrillo MC, Dunn B, Haeberlein SB, Holtzman DM, Jagust W, Jessen F, Karlawish J, Liu E, Molinuevo JL, Montine T, Phelps C, Rankin KP, Rowe CC, Scheltens P, Siemers E, Snyder HM, Sperling R; Contributors. NIA-AA Research Framework: Toward a biological definition of Alzheimer's disease. Alzheimers Dement. 2018 Apr;14(4):535-562.
4. Nakamura A, Kaneko N, Villemagne VL, Kato T, Doecke J, Doré V, Fowler C, Li QX, Martins R, Rowe C, Tomita T, Matsuzaki K, Ishii K, Ishii K, Arahata Y, Iwamoto S, Ito K, Tanaka K, Masters CL, Yanagisawa K. High performance plasma amyloid-β biomarkers for Alzheimer's disease. Nature. 2018 Feb 8;554(7691):249-254.
5. Xu W, Tan L, Wang HF, Jiang T, Tan MS, Tan L, Zhao QF, Li JQ, Wang J, Yu JT. Meta-analysis of modifiable risk factors for Alzheimer's disease. J Neurol Neurosurg Psychiatry. 2015 Dec;86(12):1299-306.
6. Wang J, Tan L, Yu JT. Prevention Trials in Alzheimer's Disease: Current Status and Future Perspectives. J Alzheimers Dis. 2016;50(4):927-45.
7. Wang J, Yu JT, Wang HF, Meng XF, Wang C, Tan CC, Tan L. Pharmacological treatment of neuropsychiatric symptoms in Alzheimer's disease: a systematic review and meta-analysis. J Neurol Neurosurg Psychiatry. 2015 Jan;86(1):101-9.
8. Tan CC, Yu JT, Wang HF, Tan MS, Meng XF, Wang C, Jiang T, Zhu XC, Tan L. Efficacy and safety of donepezil, galantamine, rivastigmine, and memantine for the treatment of Alzheimer's disease: a systematic review and meta-analysis. J Alzheimers Dis. 2014;41(2):615-31.
文章转载自:神经时间