2018 年 7 月,FDA 共批准新药 16 余种,现总结如下,并将新实体分子药物进行简单介绍。
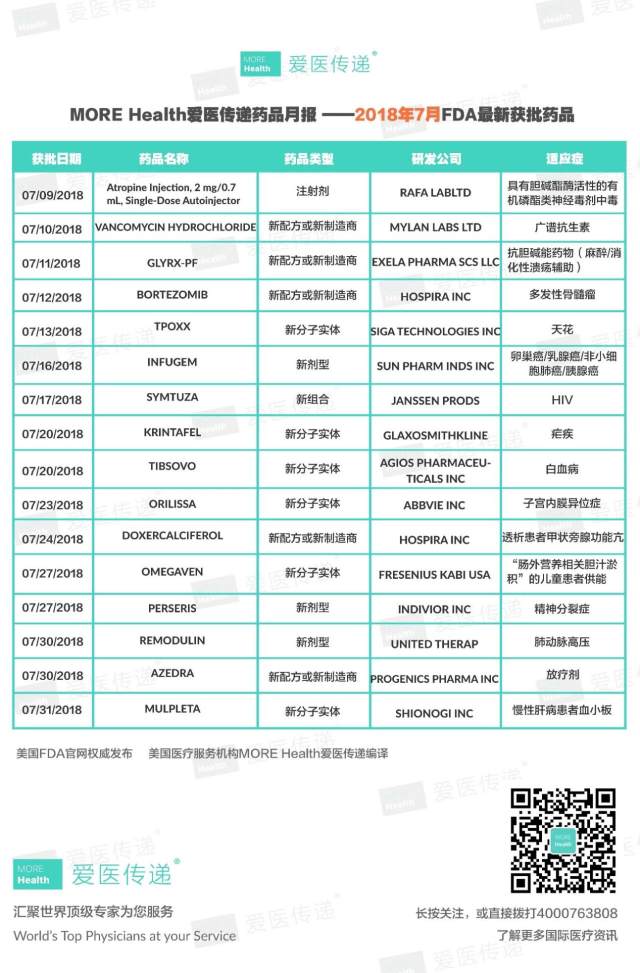
新实体分子药物
TPOXX
SIGA 生物技术公司的 TPOXX(tecovirimat)于今年 7 月获批,这也使其成首个治疗天花的药物。
天花是一种传染性疾病,有时甚至可以致命,世界卫生组织虽然在 1980 年已宣布消除天花这种疾病,但实际上,天花并没有完全消失,而是保存在一些国家的实验室,可能被作为一种生物武器使用。在消除天花之前,引起天花的天花病毒主要通过人与人之间的直接接触传播。症状通常在感染后的 10-14 天开始发作,包括发烧、无力、头痛及背痛。最初皮疹由小的,粉红色肿块组成,然后在最终结痂和结疤之前,这些肿块会发展成充满脓疮的溃疡。天花的并发症可能包括脑炎(大脑炎症)、角膜溃疡及失明。
TPOXX 的有效性是基于一项动物实验研究,实验动物均感染了与导致天花密切相关的病毒,检测指标为研究结束时的生存期。结果显示,与对照组相比,TPOXX 治疗组生存期显著延长。更进一步地,TPOXX 的安全性在 359 名未感染天花的健康志愿者身上得到评价。然而该药物也存在一定的副作用,主要是头痛、恶心及腹部疼痛。
KRINTAFEL
葛兰素史克(GSK)与非营利组织「抗疟药品事业会」(MMV)近日联合宣布,FDA 批准 Krintafel(tafenoquine,他非诺喹)上市,用于正在接受适当抗疟药物治疗急性间日疟原虫(P.vivax)感染的 16 岁及以上疟疾患者,根治(预防复发)由间日疟原虫(P.vivax)导致的疟疾。
此次批准,使 Krintafel 成为过去 60 多年来治疗间日疟原虫疟疾的首个新药,该药能够有效预防间日疟复发,对于该疾病的患者来说,该药物的出现无疑是一个重要的里程碑。
间日疟原虫能在肝脏中休眠,会导致病情的反复复发,因此该病在临床治疗过程中非常具有挑战性。伯氨喹的治疗依从性差,导致比临床对照组还要高的复发率。在疟疾肆虐的国家,复发性疟疾是一个非常沉重的疾病负担。
该药物的成功获批,是基于一项全面的全球性临床开发项目的数据。主要的疗效和安全性证据来自 2 个随机双盲 III 期临床研究 DETECTIVE Part 1 和 Part2(TAF112582)以及 GATHER(TAF116564)。数据显示,研究达到了主要终点:为期 6 个月随访期间,与对照组相比,他非诺喹治疗组有统计学上显著更高比例的患者保持无复发(60% vs 26%,复发风险 OR = 0.24,p<0.0015)。此外,与对照组相比,14 天疗程伯氨喹治疗组也有统计学上显著更高比例的患者保持无复发(64% vs 26%,复发风险 OR = 0.20,p<0.001)。安全性方面,不良事件发生率他非诺喹组、伯氨喹组、氯喹组分别为 63%、59%、65%,严重不良事件发生率分别为 8%、5%、3%。
TIBSOVO
首款 IDH1 抑制剂 Tibsovo 获美国 FDA 批准用于治疗 IDH1 基因缺陷患者的复发或难治性急性髓性白血病(AML)。
临床研究表明 Tibsovo 能够提供强有力的持久缓解,并可以帮助患者实现和保持不依赖输注。对携带 IDH 突变的 AML 患者而言,IDH 抑制剂代表了一类新的非细胞毒靶向疗法。
在 174 名患有 IDH1 基因缺陷的 AML 患者中临床研究了替布索沃的有效性。该药物最常见的副作用包括疲劳,白细胞增多,关节疼痛,腹泻,呼吸短促,手臂和腿部肿胀,以及口腔溃疡。
ORILISSA
十年首批!FDA 批准 ORILISSA 用于子宫内膜异位症患者。
子宫内膜异位是美国女性常见的妇科疾病之一,多发生于生育年龄的女性,临床正常有痛经、月经异常、不孕和性交疼痛。该疾病的治疗主要包括手术和药物治疗两种。常用药物有口服避孕药、非甾体类抗炎药(NSAIDs)、阿片类药物和激素疗法等,但是这些药物仅对部分患者有效,且有显著的副作用。而手术亦不适用于所有患者。一直以来,很少有专门针对子宫内膜异位症的治疗。
ORILISSA 是一种非肽小分子促性腺激素释放激素受体对抗剂,它通过与下丘脑垂体中的激素受体结合而抑制内生的激素信号传导。导致对促黄体素(LH)和促卵泡激素(FSH)的剂量依赖性抑制,导致卵巢性激素、雌二醇和孕酮的血液浓度下降。这种药物通过减少雌激素的产生而发挥作用,从而显著减少子宫内膜异位症引起的中度至重度疼痛。
在迄今为止最大规模的子宫内膜异位症的 3 期研究项目中,研究者评估了近 1700 名中度至重度疼痛的子宫内膜异位症患者。其中,约 45% 的女性接受了低剂量的治疗(每日一次 150 mg),75% 的女性服用了高剂量的药物(每日两次 200 mg),20% 的女性服用安慰剂。结果显示,与安慰剂相比,ORILISSA 显著减少了三种最常见的子宫内膜异位症:每日经痛、非经性骨盆疼痛和性疼痛。临床试验数据还表明,在第 3 个月时,与安慰剂相比,高剂量组女性的性交疼痛显著减少。
这种药物也有一些副作用,如骨质疏松、头疼、潮热等。
OMEGAVEN
FDA 批准 Omegaven 上市,为早产儿提供营养。对于许多早产儿或患有严重疾病的新生儿来说,他们往往需要通过肠外营养途径来获取能量。其主要方式是通过静脉直接输入营养,绕过了常规的进食与消化步骤。尽管这种手段对于病儿来说往往能拯救生命,但长期使用肠外营养途径,会导致肝脏内发生胆汁淤积,「肠外营养相关胆汁淤积」(PNAC)的名字也由此而来。
Omegaven 由鱼油组成,且主要内容物为 omega-3 脂肪酸。在动物实验中,研究人员们发现静脉注射鱼油能缓解胆汁淤积的病情。在两项公开标签、单中心的临床试验中,这款疗法的治疗潜力得到了验证。这两项试验分别招募了 2 岁及 5 岁以下的儿童,并使用 Omegaven 对他们进行治疗。而对照组则为历史数据,他们曾接受了基于豆油的脂类乳剂治疗。研究表明,从儿童的体重增长情况来看,Omegaven 与标准疗法的效果类似。而从直接胆红素(DBil)水平来看,患儿的水平从开始治疗时的 2.0 mg/dL,下降到了 0.60 mg/dL(中位数),显示了良好的疗效。
MULPLETA
FDA 批准 Mulpleta 治疗慢性肝病患者的血小板减少症。这些患者将计划接受医疗或牙科手术。此次批准基于两项随机,双盲,安慰剂对照试验(L-PLUS 1 和 L-PLUS 2,NCT02389621),涉及 312 名患有慢性肝病和严重血小板减少症的患者,他们正在接受侵入性手术并且血小板计数较少超过 50 x 109 / L. 患者按 1:1 随机分组接受 3 mg lusutrombopag 或安慰剂,每日一次,持续 7 天。在 L-PLUS 1 中,接受 lusutrombop 的 78% 的患者(38/49)在初次侵入性治疗前不需要输注血小板,而接受安慰剂的患者为 13%(6/48)(治疗差异为 95%CI:49%),79%; p<0.0001)。在 L-PLUS 2 中,65%(70/108)接受 lusutrombopag 治疗的患者在手术前 7 天通过初次侵入性手术或卒中后随机出血的急救治疗不需要血小板输注,而 29%(31/107))接受安慰剂(治疗差异为 95%CI:25%,49%; p <0.0001)。
≥ 3% 的患者最常见的不良反应是头痛。推荐的 lusutrombopag 剂量是每天口服 3 毫克,有或没有食物,持续 7 天。