
结直肠癌是最常见的恶性肿瘤之一,目前在我国发病率呈明显上升趋势。近年来,随着治疗手段的改进、新的药物的使用及分子基因指导下的精准个体化治疗的长足进步,肠癌的整体预后获得改善,但是仍不令人满意。
主要原因是在确诊时肿瘤多是中晚期,部分已发生肝脏转移,20%~40%的患者由于局部病变范围广或已发现远处转移而无法达到根治性切除。获得根治性手术切除的患者也只有70%~80%存活期5年;根治切除术后肝、肺转移仍较多见,特别是Dukes′C期患者。
因此,如何合理处理好初诊的IV期肠癌患者以及术后复查发现的肠外转移灶,对肠癌的预后和长期生存至关重要。
多学科综合治疗(MDT)模式在很多大的中心逐渐开展,其对于优化治疗方案改善个体患者预后方面越来越受到重视和推崇,但即便在MDT团队内部,涉及到具体病例治疗方案时,也会存在一定分歧,争论时有发生,但基本在NCCN和ESMO框架内辩论。有辩论,说明还有很多未知的空间值得我们去探索和实践。
本文就肠癌肝转移局部治疗方案选择上的一些分歧和争论作一文献复习和分析,仅代表一家之言,供同行分享和讨论。
一、结直肠癌肝转移的流行病学
肝脏是结直肠癌最主要的转移部位,发生率高达15%~20%。
Adam等报道:结直肠癌患者在其患病后的余生中,50%~60%会发生肝转移。
结直肠癌肝脏转移是一个十分复杂的生物学过程,机制尚不完全明了,微转移是可能的原因之一。
从解剖学的角度看,引流结直肠的静脉血流均汇入门静脉进入肝脏,肝窦是胃肠道血液回流的部位,对血流的廓清率高,是肿瘤细胞最容易着床的脏器;结直肠癌最易侵入静脉,发生率可高达20%~30%;癌细胞一旦脱落进入血循环,很容易在肝脏形成转移灶。
肝脏是恶性肿瘤最常见的转移器官,据国外尸解资料报道:恶性肿瘤患者40%有肝转移,而结直肠癌患者肝转移率高达60%~71%。结直肠癌肝转移分为同时性肝转移和异时性肝转移。
前者是指发现结直肠癌的同时发现肝转移,原发灶与肝转移灶发现的间隔<6个月;结肠癌术后肝转移,原发灶与肝转移发现间隔>6个月者为异时性肝转移,异时性肝转移约30%~40%发生在所谓的根治性切除术后,80%发生在术后3年内。
在所有各种原发癌肿肝转移患者人群,结直肠癌肝转移有其特殊性,即很多患者直至死亡,肝脏仍是唯一转移器官,据文献报道,最高比例可达所有肠癌肝转移患者的38%。
因此,肝转移是结直肠癌治疗失败、影响预后和长期生存的主要原因。
二、结直肠癌肝转移局部治疗
2016年7月,ESMO官方杂志《肿瘤学年鉴》发布“转移性结直肠癌(mCRC)共识指南”,将mCRC疾病分为两大类:oligometastatic disease (OMD,寡转移性疾病)和metastatic disease(转移性疾病),指南中对OMD的定义一般指转移部位≤2个、总体转移数目≤5个的疾病状态。
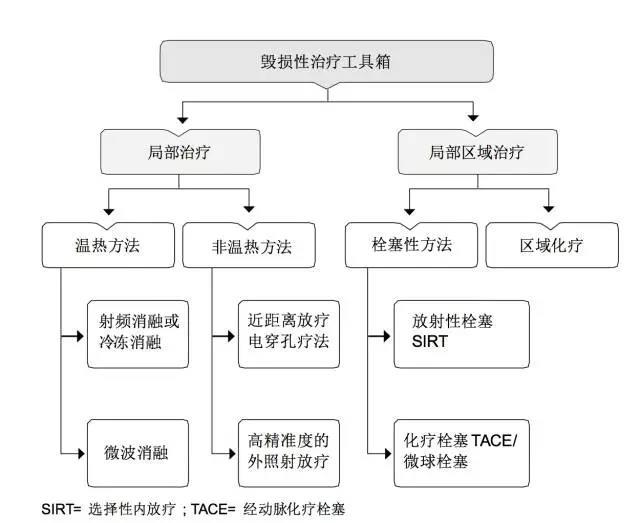
针对OMD的治疗目标是达到治愈意向的无瘤状态(no evidence of disease, NED),在有效的全身治疗基础上更要考虑局部治疗,并将外科手术也放在局部治疗手段中,充分肯定了局部治疗的重要性,并提出了毁损性治疗工具箱,包括局部治疗和局部区域性治疗。
在这两大块治疗手段中,除了高精准度的外照射治疗,剩下的所有治疗手段都需要介入专科的医师来完成或协助完成,可见介入放射学专科在肠癌肝转移局部治疗中占有重要的地位。
在局部治疗手段中,热消融尤其是射频消融占据着重要的地位,以下将重点就肝转移的射频消融进行阐述,并与局部治疗的标准推荐外科切除进行回顾性比较分析,希望能对大家在肠癌肝转移局部治疗选择上有所启发。
1、肠癌肝转移的射频消融治疗
射频消融最早是在上世纪90年代初用于肝脏肿瘤的消融,随着不断的工艺改进和技术革新,射频消融的有效性也获得不断提升,到90年代末和2000年后的头几年,射频消融技术获得介入放射专家的广泛认可,但肿瘤学界及外科学界仍抱持着怀疑态度,这可从早期发表的一些文章中窥出端倪。
但最近几年,随着越来越多的数据积累,对这一技术在肝脏肿瘤包括肠癌肝转移方面的应用,明显有了很大的改变,很多适合外科切除的病灶也被推荐行射频消融治疗,也正因如此,才会有2016年的转移性结直肠癌处理ESMO共识指南的毁损性治疗工具箱的提出和应用。
经过近30年的临床应用和总结,对于射频消融技术治疗的有效性和局限性也有了很好的理解。但对于转移性结直肠癌病人,何时更合理的引入消融以及用于何种适应症仍存在争议,仍缺乏RCT的研究结果对射频消融进行准确的应用推荐。
尽管如此,在2013年,欧洲放射学杂志发表了全球领域有影响力的31位介入放射学专家关于肠癌肝转移的消融治疗共识,对肠癌肝转移的消融适应症和细节问题进行了详尽的阐述,个人觉得这个共识具有广泛的代表性和很强的操作指导性。
从这个专家共识中,我们可以总结到以下几点:
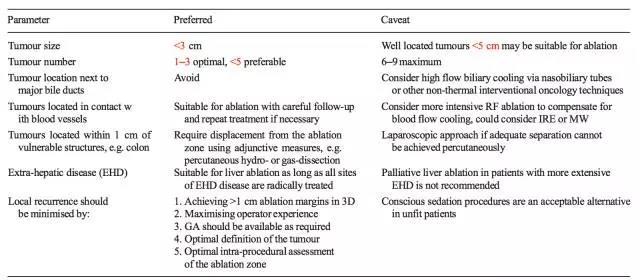
1、肠癌肝转移最佳的消融适应症是小于3cm以及数目小于3个,5个以下的寡转移也可以进行消融,对于一些位置好的病灶,5cm以下也可以进行消融。个人理解的位置好,应该是病灶不靠近重要的血管和脏器,包括空腔脏器,这样能达到相对安全的消融边界;
2、避免消融靠近主要胆管的病灶,如果进行消融,应考虑经鼻胆管的降温灌流措施以保护胆管或改用非热消融技术(纳米刀);
3、靠近较大的血管(直径≥3mm)的消融,应密切随访复查,必要时重复消融;更高的消融功率有望对抗血液流动的降温效应,在这一点上微波可能较射频有优势,因微波升温更快,热凝更加高效;也可以考虑纳米刀消融;
4、靠近重要易损伤的器官或结构(≤1cm)如结肠等,应考虑注入液体或气体进行推移隔离,必要时行腹腔镜下消融。
相较外科切除手术,消融部位的高局部复发率是射频消融技术的一大劣势,针对如何降低消融部位的复发,专家组也提出了5点推荐意见。
1、达到1cm以上的消融边界;
2、操作者应具有丰富的消融经验(欧洲建议操作者至少有100例次的消融积累);
3、在全麻下进行,提高患者舒适性和依从性;
4、选择好消融适应证;
5、消融术中的对消融效果进行及时评估,必要时重复消融以达到影像学上的“R0”消融。以下是我中心的成功消融病例,基本都是按照2013专家共识来操作和执行的
病例1 :75岁女性病人,乙状结肠中分化腺癌同时性肝转移(T3N0M1a,IVa期),乙状结肠癌根治术后1周行肝孤立转移灶射频消融治疗。
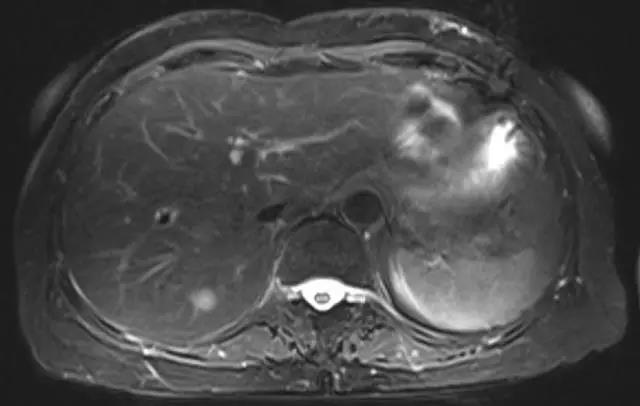
图1. 射频治疗前,肝S7段孤立转移病灶,大小约9mm
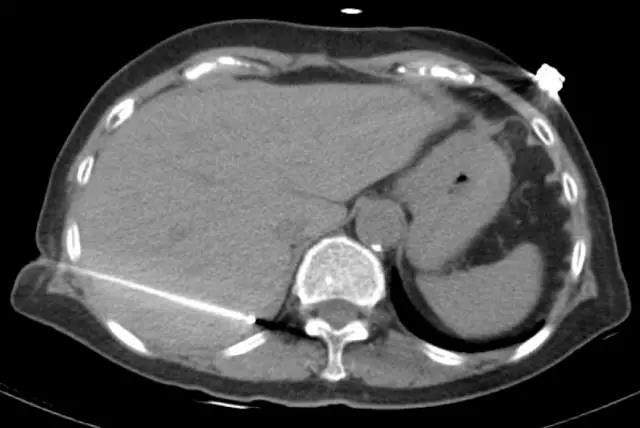
图2. CT引导下经皮经肝穿刺行射频消融治疗
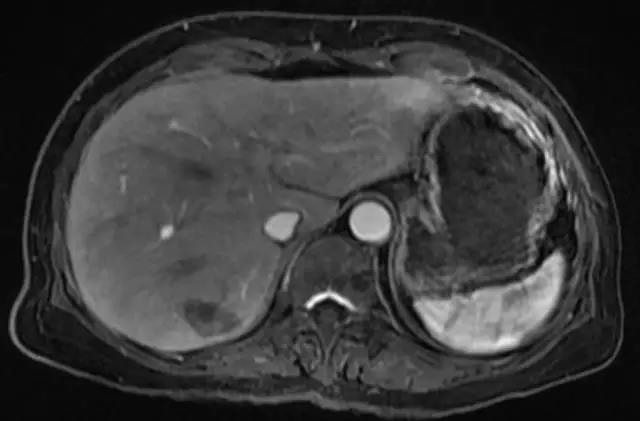
图 3. 射频消融治疗后4周复查,病灶完全坏死
病例2:直肠癌术后肝脏S8孤立转移
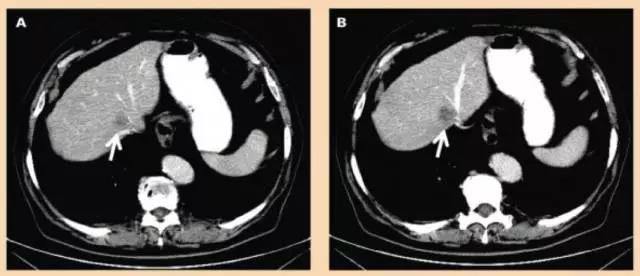
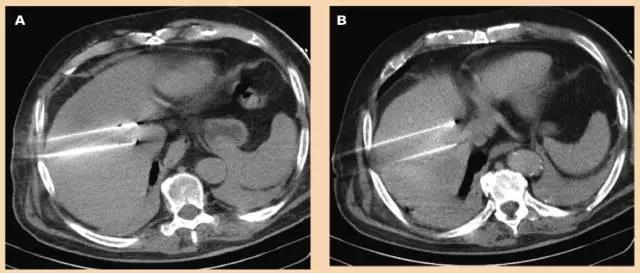
图2 CT引导下经皮经肝行病灶不可逆电穿孔消融治疗,共用了4支消融电极
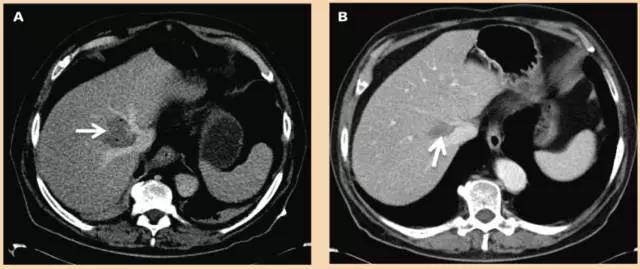
2、结直肠癌肝转移的外科治疗
目前为止,无论是NCCN指南还是ESMO指南,手术切除仍被认为是治疗转移性肝癌最有效的方法,只要条件许可,主张争取手术切除。根据发现肝转移的时间不同,处理原则有所不同。目前关于肠癌肝转移手术切除疗效评判最广为接受和应用的还是MSKCC的Professor Fong于1999年提出的CRS评分系统,即转移瘤数目、转移瘤大小、转移瘤出现的时间、原发瘤区域淋巴结是否转移以及血癌胚抗原(CEA)水平。
Memon报道的meta分析资料显示,结直肠癌肝转移手术后5年、10年生存率和手术死亡率分别是16%~49%、17%~33%和0~9%。
手术切缘同时存在肝外病变是预后差的重要相关因素,而肿瘤距切缘太近是术后切缘阳性和存活期短的关键因素。
一般认为,对结直肠癌肝转移患者,如果并发症发生率和手术死亡率高,太复杂的手术也是不必要的。
但是随着手术技术的提高和相关学科的发展和进步,既往认为不适宜的手术变得安全、手术适应症扩大,例如肝脏中央区靠近肝门的转移、手术后5年生存率为45%;伴有肝外病变者术后5年生存率为29%。而术前化疗可以使15%的患者“降期”,提高了手术切除率。结直肠癌肝转移在未治疗组,其自然生存期为16个月;肝转移灶切除后中位生存期可达20~40个月,5年生存率达25%~48%,无瘤生存率为12%~19%。因此,对结直肠癌术后出现肝转移者应积极给予治疗。
对于转移瘤初始评判为潜在可切除患者,经过转化治疗后仍有相当部分患者可转化为可切除病例,特别是随着药物研发及肿瘤分子生物学研究的进展,更多的患者经合适的评估及精准治疗,最终会在MDT联合会诊下获得外科治愈的机会。
三、手术切除和射频消融治疗在可切除结直肠癌肝转移治疗上的现实选择差异
前面所讲的关于肠癌肝转移外科手术和局部消融治疗是目前国际范围内的专家共识,肝切除是一种被广泛接受的治疗选择,NCCN指南甚至把其作为唯一可治愈的手段加以定位,依据这个共识,局部消融治疗只能作为外科切除术的替补手段。
但是我们知道,部分优选的小肝癌的射频消融已被越来越多的国际分期和治疗指南所推荐,包括很多大宗病例的回顾性甚至前瞻性临床研究的结论显示5年生存率和外科切除相当。
我们做个假设,直径小于3cm的肠癌肝转移灶,其位置符合可以达到“根治”消融的原发性小肝癌的要求,这种病人是否一定也是首选外科切除呢?而且,把肠癌肝转移灶和小肝癌放在一起比较,同样接受外科手术切除后,理论上来讲,肠癌肝转移病人术后肝内再次出现新病灶的机率要高,特别是CRS评分高、复发风险高预后差的病人。
因此,在这种病例选择治疗方法时,争论会在所难免,消融有其自身的优势,因为消融后即使出现复发,仍可再次消融处理复发灶,而且创伤比较小,术后患者恢复快。但很多时候我们会跟着指南走,推荐去外科切除。这就要回到指南的权威性问题上来,指南的权威性来自循证医学证据,指南的更新也是因为更多的大型的全球多中心前瞻性随机对照研究结果(RCT)的发布所引起。
射频消融之所以能成为早期小肝癌的可选择的根治性治疗手段,也得益于权威前瞻性随机对照研究结果的支持。但是,在优选的符合根治性消融要求的肠癌肝转移治疗方面,是选择外科手术还是射频消融,迄今为止,没有强有力的RCT证据,都是根据多个回顾性研究结果的荟萃分析来制定指南或达成专家共识的。
我们也分析了制定指南所采用的所有文献,接受射频的治疗组基本上也是外科筛选后的,这在2005年前的文献报道中更是如此,因此存在着基线的不对等,其研究结果的权威性也是要打折扣的。
正如NCCN结直肠癌诊疗指南专家委员会所指出的那样,肝转移瘤单纯手术切除疗效优于RFA的原因到底是由于患者选择的偏倚还是RFA的技术局限,或者是两个因素的共同作用,目前尚不清楚。
因此,关于对待消融治疗在肠癌肝转移治疗方面的定位,我们尚缺一个公正的更有说服力的数据,期待开展RCT的研究。即便符合根治性消融要求的肝转移病人比例比较低,这样的一个研究设计筛选出这部分病例也是有重要意义的,至少告诉病人我还可以怎么选择,也是能达到彻底消灭病灶获得长期生存的。
另外,对于不考虑外科手术切除且初始判断为可“R0”消融的肠癌肝转移患者,何时进行消融也是个有争议的话题,是在化疗前直接消融还是先行新辅助化疗再消融?2012年1项分析了3个随机对照研究的meta分析以及发表于2015年的另一项包括10个临床研究的meta分析的结果表明外科术前的新辅助化疗及术后辅助化疗可改善PFS或DFS,但没有改善OS。这些研究结果是否适合于射频消融,不得而知。
2014年发表在BMC Cancer上的一篇文章探讨了这个问题,作者认为符合以下四个特征的患者最容易从射频联合化疗中获益:
1、病灶数目不超过3个;
2、最大转移灶直径在3cm以下;
3、CEA水平低于100ng/ml;
4、化疗过程中第一次疗效评估即达到 PR情况下进行消融。
这些研究结论对于我们在MDT讨论时制定治疗策略提供重要参考。消融后达到NED状态的患者是否还要继续化疗,目前没有明确的推荐意向,通常由MDT专家组讨论决定。
综上所述,肠癌肝转移由于转移的广泛程度及转移灶大小、位置,有无合并多器官转移及病人年龄、其他慢性合并症情况的不同,其治疗策略也大相径庭。
与外科百年历史相比,消融技术的应用还不到30年,有待积累更多的研究数据来告诉我们,如何选择合适的治疗方法来处理肝转移灶具有重大的临床意义。正如腔镜技术刚一出现应用在肠癌根治术上一样,在遭受诸多质疑中一路前行,今天已获得了广泛认可和应用。对于肝脏寡转移病灶,特别是射频可以达到“R0”消融的<3cm小病灶,消融是否可以和外科切除手术一样成为一线选择,也只能期待RCT的研究告诉我们答案。在没有获得确定答案之前,整个治疗决策还是在MDT框架下来制定,患者利益至上是制定一切方案的出发点。