2018 年 4 月,FDA 共批准新实体/分子药物 5 个(不包含仿制药和暂批药物),具体信息如下表所示,并对部分新药进行介绍。
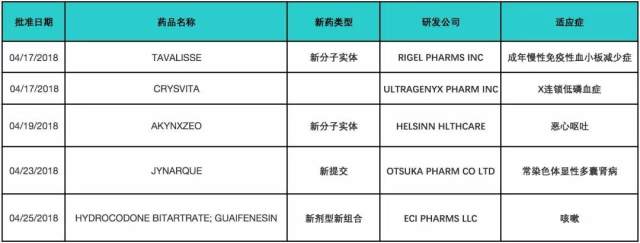
TAVALISSE
美国时间 4 月 17 日,Rigel 制药宣布,美国 FDA 已批准新药 TAVALISSE™ 上市,用于治疗既往接受过治疗但疗效不佳的成年慢性免疫性血小板减少症。
原发免疫性血小板减少症(ITP),以往称特发性血小板减少性紫癜,是一种获得性自身免疫性疾病。是临床所见血小板计数减少引起最常见出血性疾病。
目前公认绝大多数 ITP 是由于免疫介导的自身抗体致敏的血小板被单核巨噬细胞系统过度破坏所致。也有新的观点认为是免疫介导损伤巨核细胞或抑制巨核细胞释放血小板,造成患者血小板生成不足。
ITP 的常见症状包括过度瘀伤、出血和疲劳。患有慢性 ITP 的人可能会增加严重出血事件的风险,这可能导致严重的医学并发症甚至死亡。目前治疗 ITP 的方法包括类固醇、血小板生成促进剂和脾切除术。然而,并不是所有的病人都对现有疗法有足够的治疗反应。因此,对于 ITP 患者来说,仍有需要额外治疗方案的很大医疗需求。
TAVALISSE 是一种口服的脾脏酪氨酸激酶 (SYK) 抑制剂,通过阻止血小板的破坏来应对疾病的潜在自身免疫原因,为成年慢性 ITP 患者提供了一个重要的新的治疗方案。
TAVALISSE 的批准依赖于 FIT 临床研究项目的数据,FIT 包含两项随机安慰剂对照的临床 3 期研究 047 和 048、一项开标扩展试验 049 以及最初的概念验证试验。新药上市申请包括了 163 例 ITP 患者的数据,并得到了一项安全数据集的支持,该数据集包含 4600 多名涉及其它适应症的已接受 TAVALISSE 评估的受试者。该药物的正式上市时间预计在今年 5 月下旬。
CRYSVITA
美国时间 2018.04.17 日,FDA 批准 Crysvita 上市,用于治疗 1 岁及以上儿童和成年人的 X 连锁低磷血症(XLH),该药物也是此项适应症的首款获批药物,此前曾获得突破性疗法认定与孤儿药资格。
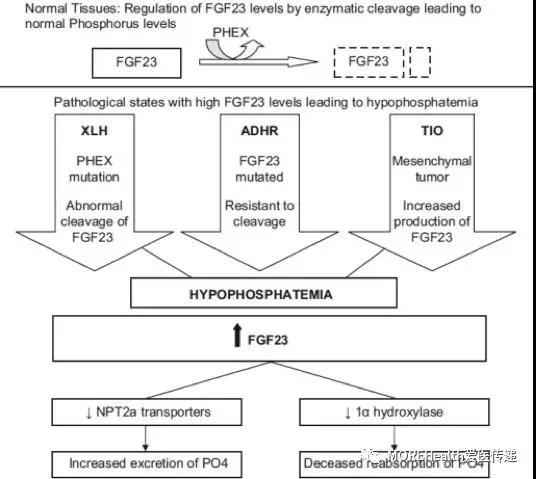
X 连锁低磷血症是一种严重的罕见遗传性软骨病,会造成血液中磷含量低,影响儿童与青少年骨骼生长与发育,导致患者终生的骨矿化。X 连锁低磷血症的临床表现为腿部弯曲、身材矮小、骨痛和严重的牙痛等。有些 XLH 患者还会出现持续不适或并发症,如关节疼痛、活动能力受损、牙脓肿和听力下降。目前尚无针对该疾病有效的治疗策略。
Crysvita 是一个生物大分子药物,其核心成分是成纤维细胞生长因子 23(FGF23)的抗体,FGF23 是一种可导致磷酸盐随尿液排出并抑制肾脏活性维生素 D 产生的激素。
Crysvita 可以通过特异性结合 FGF23,其磷水平正常化,从而改善骨矿化,以及儿童的软骨病和成人的骨折。该药物的获批是基于 4 项临床试验中的安全性和疗效数据。在一项安慰剂对照临床试验中,94% 的每月接受一次 Crysvita 的成年人能达到正常的磷水平,而安慰剂组患者只有 8% 能达到这一水平。在儿童中,每两周接受一次 Crysvita 的患者中有 94% 到 100% 能达到正常的磷水平。在儿童和成人中,接受 Crysvita 疗法的患者的 X 光(与 XLH 相关)结果有所改善。
该药物的不良反应主要包括背痛、头痛、不宁腿综合征、维生素 D 减少、头晕和便秘等,儿童患者最常见的不良反应是头痛、注射部位反应、呕吐、维生素 D 减少和发热。
总的来说 Crysvita 的获批无疑是 XLH 治疗领域的巨大突破,给广大 XLH 患者带来福音。
AKYNZEO
2018 年 4 月 19 日,FDA 批准 Akynzeo 新剂型注射剂,由促性腺激素与帕洛诺司琼两个有效成分组成,用于缓解恶性肿瘤患者化疗引起的恶心和呕吐症状。该药物最早于 2014 获批,是一种由两款药物(帕洛诺司琼和奈妥吡坦)组成的固定剂量胶囊复方药物。
Akynzeo 可帮助缓解患者可能经历的作为一种癌症化疗副作用的恶心及呕吐,」其有效性基于两项由 1720 名接受癌症化疗受试者参与的临床试验。受试者被随机配给 Akynzeo 或口服帕洛诺司琼。第一项试验结果显示,急性期、延迟期及化疗整体阶段分别有 98.5%、90.4% 和 89.6% 的 Akynzeo 治疗受试者未发生呕吐或需急救药物的恶心。相比之下,口服帕洛诺司琼治疗受试者在急性期、延迟期及化疗整体阶段分别有 89.7%、80.1% 和 76.5% 的受试者未发生呕吐或需急救药物的恶心。第二项试验显示有类似的结果。Akynzeo 的常见副作用有头痛、虚弱 (无力)、疲劳、消化不良(食滞)和便秘。
Jynarque
美国时间 2018.04.23 日,FDA 批准日本药企大冢制药 (Otsuka Pharma) 的新药 Jynarque(tolvaptan,托伐普坦) 上市,用于治疗常染色体显性多囊肾病 (ADPKD) 成人患者,以延缓肾功能的下降。
ADPKD 是最常见的多囊肾病类型,也是导致终末期肾病 (肾衰竭) 的第四大原因,其特征是随时间推移肾脏内出现大量的充满液体的囊肿,逐渐撑大肾脏体积,损害肾脏正常功能,导致大多数患者发生肾功能衰竭。ADPKD 可显著影响患者生活质量,并与可能致死的心血管并发症相关。
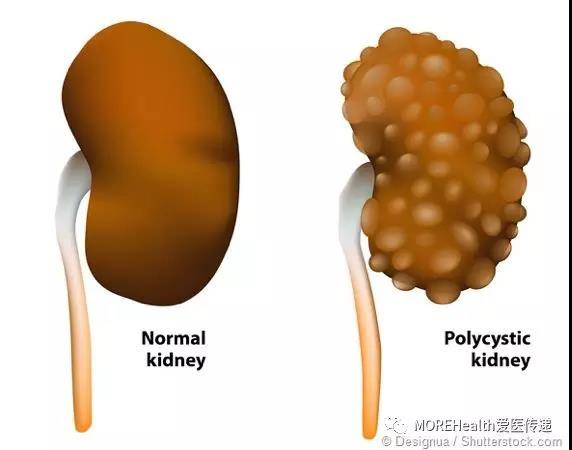
Jynarque 是全球获批的首个 ADPKD 治疗药物。其药理机制为:该药物是一种血管加压素 V2 受体拮抗剂,能够只促进水的排泄而不会影响其他电解质如钠离子的排泄。在 ADPKD 患者中,血管加压素水平高于正常人群。高水平的血管加压素能促进囊肿的生长,从而使肾脏肿胀体积增大。
该产品通过阻断血管加压素的作用,减缓肾囊肿的生长速度。
该药物的获批是基于 2 个关键性安慰剂对照 III 期临床研究 (REPRISE,TEMPO3:4) 的数据。1370 例患者参与该试验,主要终点是评估肾小球滤过率 (eGFR,反映肾功能损害程度) 从治疗前的基线水平至治疗后评估的变化。
数据显示,治疗 12 个月后,tolvaptan 治疗组 eGFR 相对基线的降低幅度显著小于安慰剂组 (-2.3 毫升/分钟/1.73 平米/年 v.s.-3.6 毫升/分钟/1.73 平米/年,差异:1.27 毫升/分钟/1.73 平米/年,p<0.001),达到了主要终点。另一项研究共入组 1495 例患者,数据显示,在较早期阶段的 ADPKD 患者中,与安慰剂相比,Jynarque 使 eGFR 的下降速率降低了 1.0 毫升/分钟/1.73 平米/年 (95%CI:0.6-1.4);在为期 2 年的扩展期研究中,2 个治疗组均给予 Jynarque 治疗,数据显示,Jynarque 在对照期第 3 年所获得的 eGFR 差异在接下来 2 年 (第 4、第 5 年) 均得以维持。
中国患者如何合法购药?
中国患者可通过 MORE Health 爱医传递合法购买美国上市处方药品并在中美专家指导下使用。
服务流程
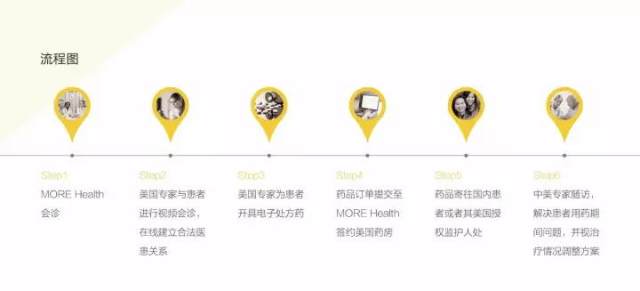
1. 患者可以与美国专家面对面的进行视频会诊,在视频期间,美国专家为患者详细解释诊疗方案,患者可自由提问;
2. 在视频问诊结束后,美国专家可在主观认可的基础上与患者远程建立合法医患关系;
3. 在此基础上,美国专家可为中国患者开具电子处方,并通过 MORE Health 美国药房进行国际处方药品递送;
4. 同时,中美专家会对患者进行随访,解决患者用药期间问题,并视治疗情况调整方案。