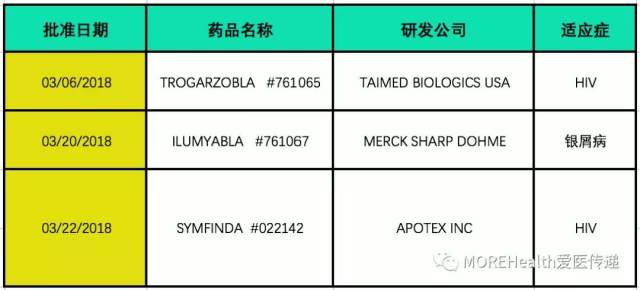
2018 年 3 月,FDA 共批准新实体/分子药物 3 个(不包含仿制药和暂批药物),具体信息如下表所示,并对部分新药进行介绍。
Trogarzo
美国时间 3 月 6 日,FDA 批准了中裕新药(TaiMed)与合作公司 Theratechnologies 研制的近十年来第一个新作用机制的艾滋病毒药物。该药物的最大特点是唯一一款不需要每日给药的抗 HIV 药物。
Trogarzo,是一种静脉滴注的人源化免疫球蛋白 G4 单克隆抗体,它与 CD4+ T 细胞受体的第二个胞外区域结合,阻止 HIV 病毒入侵,这种药物的出现可以让那些对目前治疗方案已经耐受的患者有了新的选择。
Trogarzo 已获得美国 FDA 颁发的突破性疗法认定、优先审评资格、快速通道资格、以及孤儿药资格。特别值得一提的是,该药物将由位于上海的药明生物公司生产,FDA 也凭借此药物完成了首个中国制造工厂的检查和批准,为商业推广奠定了基础。该药物的投入使用标志着治疗开启了新的时代,长效注射药物已实现!
ILUMYA
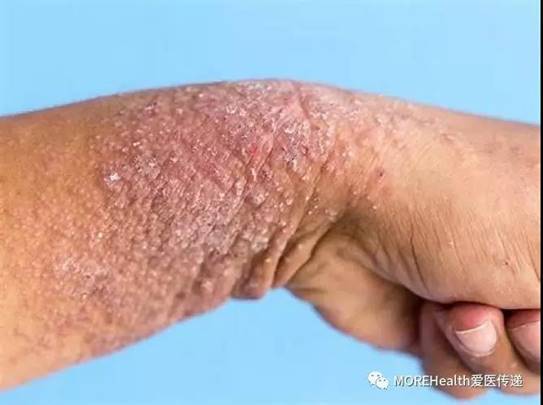
美国时间 3 月 20 日,FDA 批准其新药 ILUMYA 上市,治疗适合接受全身治疗或光疗的中度至重度斑块型银屑病成人患者。
银屑病是皮肤上出现的慢性免疫性疾病,可加速皮肤细胞的生长周期,导致皮肤出现厚厚的鳞屑区域。斑块型银屑病作为最常见的银屑病的一种形式,影响了大约 80% 至 90% 的银屑病患者。
ILUMYA 可以选择性结合 IL-23 的 p19 亚基,并抑制其与 IL-23 受体作用,从而抑制促炎细胞因子和趋化因子的释放。
该药物的成功获批基于一项 3 期临床项目 reSURFACE 的数据支持。926 名成人患者接受 ILUMYA(N = 616)或安慰剂(N = 310)治疗。该研究的第一部分将患者随机分成三个或四个治疗组,分别接受 ILUMYA 100 mg、ILUMYA 200 mg、安慰剂和依那西普(etanercept,仅限 reSURFACE 2)治疗。12 周后,将安慰剂组的患者重新随机分配接受 ILUMYA 100 mg 和 ILUMYA 200 mg 治疗,进入研究的第二部分。
结果表明,施用 ILUMYA 100 mg 能取得显著的临床改善,这一改善是通过两次用药后第 12 周至少 75% 的皮肤清除率(银屑病面积敏感指数或 PASI 75)和医师全面评估(PGA)评分为「清除」或「最小」来测量的。
SYMFI
3 月 22 日,FDA 批准 Mylan 公司的新 HIV 疗法——每日一次单片剂方案 Symfi™,用于治疗 HIV-1 感染者,此次推出的新疗法,能以较低成本治疗 HIV 感染,以具有竞争力的价格优势推向市场,旨在解决 HIV 病毒治疗费用高昂的问题。
Symfi™是包括依非韦伦(efavirenz,600 mg)、拉米夫定(lamivudine,300 mg)与富马酸替诺福韦二吡呋酯(tenofovir disoproxil fumarate,300 mg)的药物组合,是每日一次的单片剂方案,用于治疗体重至少 40 公斤的成人和儿童 HIV-1 感染者。

中国患者如何合法购药?
中国患者可通过 MORE Health 爱医传递合法购买美国上市处方药品并在中美专家指导下使用。
服务流程
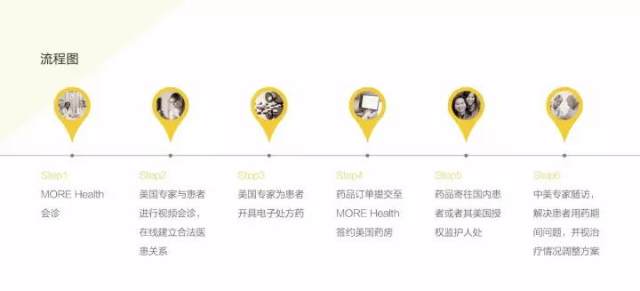
1. 患者可以与美国专家面对面的进行视频会诊,在视频期间,美国专家为患者详细解释诊疗方案,患者可自由提问;
2. 在视频问诊结束后,美国专家可在主观认可的基础上与患者远程建立合法医患关系;
3. 在此基础上,美国专家可为中国患者开具电子处方,并通过 MORE Health 美国药房进行国际处方药品递送;
4. 同时,中美专家会对患者进行随访,解决患者用药期间问题,并视治疗情况调整方案。
特别提示: 任何诊疗方案的实施及药品的使用都务必在医生指导下进行。
注:MORE Health 爱医传递 FDA 最新获批药品月报所介绍的药品为当月上市的全新获批药品,不包含已获批药品新增适应症以及用法调整等。