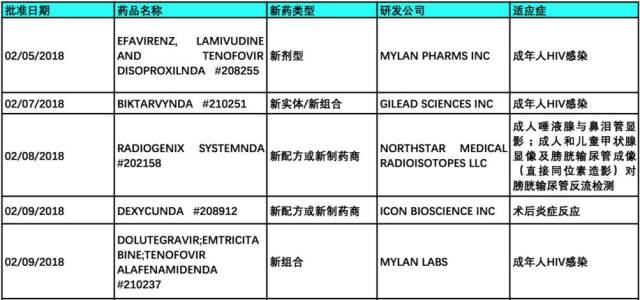
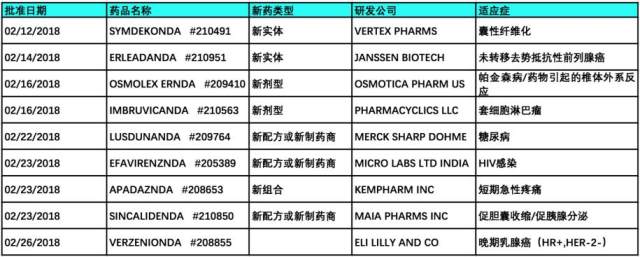
2018 年 2 月,FDA 共批准新实体/分子药物 14 个(不包含仿制药和暂批药物),具体信息如下表所示,并对部分新药进行介绍。
BIKTARVY
2 月 7 日,Biktarvy 获得了 FDA 批准,作为每日一次的单片片剂疗法,用于治疗 HIV-1 感染。
Biktarvy 是一款全新的无助推(unboosted)整合酶链转移抑制剂(INSTI),由 bictegravir(50 mg) 和 emtricitabine(200 mg) 以及 tenofovir alafenamide(25 mg) 三种成分组成。
这款新药的疗效与安全性在 4 项正在进行的 3 期临床试验中得到了验证。在其中一项临床试验中,629 名患者以 1:1 的比例分为两组,分别接受 Biktarvy 与现有治疗方案 abacavir/dolutegravir/lamivudine(600/50/300 mg)的治疗。
48 周后,两组分别有 92.4% 和 93.0% 的患者达到了 HIV-1 RNA 小于每毫升 50c 的主要终点。表明了 Biktarvy 的有效性与非劣效性。

SYMDEKO
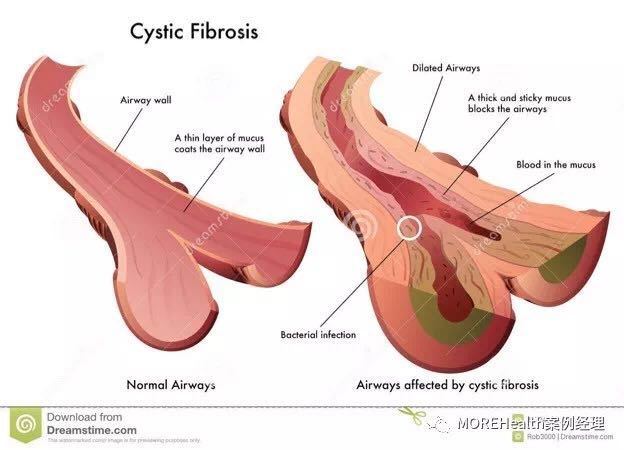
2 月 12 日,FDA 批准 SYMDEKO 上市,用于治疗 12 岁及以上的囊性纤维化(cystic fibrosis,CF)患者。
这些患者的囊性纤维化跨膜传导调节因子(cystic fibrosis transmembrane conductance regulator,CFTR)基因携带两个 F508del 突变拷贝或者至少携带一个对 tezacaftor/ivacaftor 药物有反应的突变。SYMDEKO 是 Vertex 公司获得 FDA 批准的第 3 种针对囊性纤维化根本病因的治疗药物。囊性纤维化是一种罕见的会缩短寿命的遗传疾病,影响了北美、欧洲和澳大利亚约 75000 名患者,由基因突变导致的 CFTR 蛋白缺陷或缺失引起。
儿童必须遗传到两个有缺陷的 CFTR 基因——分别来自父母,才会患囊性纤维化。囊性纤维化患者的中位寿命在 20 岁左右。所以,他们急需一款药物来阻止疾病的进展,挽救生命。据悉,欧洲药品管理局(EMA)已经确认了该药物的营销授权申请(MAA)。公司预计在 2018 年下半年获得欧盟批准。
Erleada
2 月 14 日,FDA 批准强生 Erleada (apalutamide) 上市,用于治疗非转移性(前列腺癌细胞未扩散)去势抵抗(激素治疗后疾病仍进展)的前列腺癌。
Erleada 获得过 FDA 的优先审评资格,是 FDA 批准的首个治疗非转移性去势抵抗前列腺癌的药物,也是首个凭借无转移生存期(metastasis-free survival,MFS)的临床终点获批上市的肿瘤新药。Erleada 属于第二代高选择性雄激素受体(AR)拮抗剂,与雄激素受体的亲和力是第一代 AR 拮抗剂的 5 倍以上。临床试验证实,患者随机给予 Erleada 或安慰剂,并接受内分泌治疗,包括接受促性腺激素释放激素(GnRH)类似物,或者手术去势(切除双侧睾丸)以降低体内雄激素水平。
结果显示,新药治疗组无转移生存期相比安慰剂组显著延长(40.5 vs 16.2 个月)。前列腺癌是一种雄激素依赖的肿瘤,雄激素可以刺激前列腺癌细胞的生长和疾病进展。美国国立癌症研究所数据显示,前列腺癌是美国第二大常见的癌症类型,2017 年有 161360 例新确诊前列腺癌病例,26730 例死亡病例。前列腺癌患者中大约 10%~20% 属于去势抵抗类型,其中 16% 在确诊为去势抵抗时没有发生转移。该药物的获批上市将具有广阔的应用前景。
APADAZ
2 月 23 日,美国 FDA 批准其 Apadaz 的新药申请(NDA)。Apadaz 适用于治疗短期(不超过 14 天)急性重度疼痛(需要用阿片类止痛药并且没有适当的替代疗法)。
Apadaz 是 KemPharm 公司研发的前体药物 benzhydrocodone 和对乙酰氨基酚(acetaminophen,APAP)的立即释放(IR)组合,是 FDA 批准的首款 Hydrocodone/Acetaminophen 的前体药物。Apadaz 的特殊之处在于其含有一种化学惰性或无活性的前药。当摄入时,胃肠道中的酶从前体药物(benzhydrocodone)裂解配体并释放母体药物(hydrocodone,氢可酮),从而发挥其治疗效果。