Cell Research︱ 揭秘 m6A RNA 修饰如何调控精子发生
9 月 15 日,Cell Research 在线发表了中国科学院生物化学与细胞生物学研究所童明汉研究组的研究成果 「Mettl3/Mettl14-mediated mRNA N6-methyladenosine modulates murine spermatogenesis」。该研究绘制了小鼠不同发育阶段生精细胞的 m6A RNA 修饰图谱,揭示了 m6A RNA 修饰通过调控精子发生过程中关键基因的转录后翻译,从而控制精子发生的分子机制。
文中 Stra8-GFPCre 小鼠由上海南方模式生物构建。
为了研究 m6A RNA 修饰在精子发生不同时期的作用,作者在不同发育阶段的精细胞中敲除了 m6A RNA 甲基转移酶基因(Mettl3 和/或 Mettl14)。
那要如何实现这样时间和组织特异性敲除呢?
作者运用条件性基因敲除小鼠模型,利用不同发育阶段的精细胞 marker gene promoter 驱动的 Cre 工具鼠(精子发生早期就开始表达的 Vasa 基因、以及精子发育后期表达的 Stra8 基因),分别在早期及后期生精细胞中,特异性敲除 m6A RNA 甲基转移酶基因(Mettl3 和/或 Mettl14)。
研究背景
精子发生 是一个高度复杂和特化的细胞发育过程,包括精原细胞增殖、精母细胞减数分裂和精子形成三个阶段。
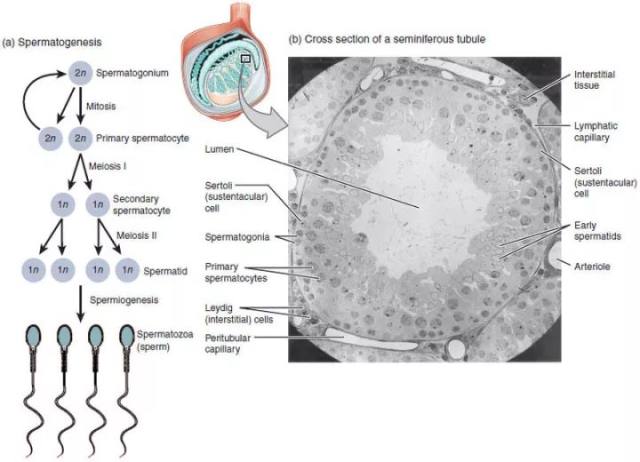
图 1. The process of spermatogenesis as the cells progress from primary spermatocytes, to secondary spermatocytes, to spermatids, to Sperm. (图片来自 OpenStax College - Anatomy & Physiology, Connexions Web site. http://cnx.org/content/col11496/1.6/, Jun 19, 2013.)
精子发生过程中的基因表达在转录水平、转录后水平及翻译水平上受到精密的调控,从而确保精子发生不同阶段功能特异基因的准确表达。例如,在长形精子阶段,细胞转录停止;其功能所需的 mRNA 在精母细胞或圆形精子阶段就已经转录生成,而一直处于翻译抑制状态,直到长形精子阶段再被翻译激活。因此,转录后调控及翻译调控在这一过程中发挥着尤为重要作用。
m6A(N6-甲基腺嘌呤,N6-methyladenosine)是最常见、最丰富的真核生物 mRNA 转录后修饰形式之一。参与调节 RNA-蛋白相互作用,RNA 二级结构稳定性,RNA 剪接,翻译调控及 RNA 分子稳定性调控等等。
它是在 RNA 分子的 A 碱基第六位的 N 元素上加上一个甲基基团的修饰方式。该修饰是一个动态可逆的过程,由「书写器」甲基转移酶复合体(METTL3,METTL14,WTAP 组成)、「擦除器」去甲基酶(FTO 和 ALKBH5)以及相应的「阅读器」(YTHDF 或 YTHDC 等)协同调控。m6A 的生物学功能已备受关注,并成为生命科学热门研究领域之一。
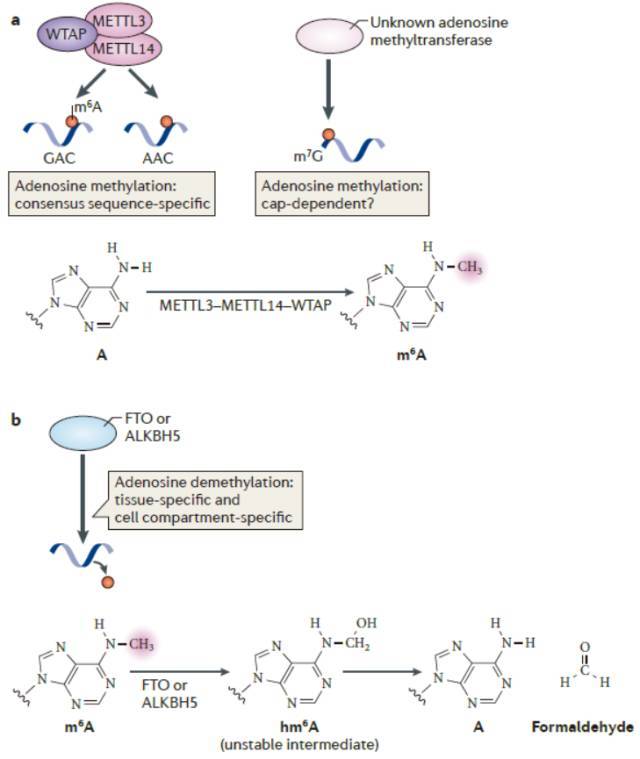
图 2. m6A「书写器」与「擦除器「(图片来自 Nat Rev Mol Cell Biol, 2014. 15(5): p. 313-26.)
小鼠模型
Mettl3 flox 小鼠: 两个同向 loxp 位点分别位于 m6A 「书写器」 Mettl3 基因 intron3 和 intron4 中,flox exon4。
Mettl14 flox 小鼠: 两个同向 loxp 位点分别位于 m6A 「书写器」 Mettl14 基因 intron1 和 intron2 中,flox exon2。
Vasa-Cre 工具鼠:也叫 Ddx4-Cre,生殖细胞特异性 Cre ,在胚胎期第 15 天-第 18 天开始表达 Cre,可在早期生精细胞(gonocyte)中敲除 floxed 基因。
Stra8-GFPCre 工具鼠: 利用 Crispr-Cas9 技术,将 2A-GFPCre 融合 cDNA 插入到小鼠 Stra8 基因终止密码子前,获得既表达内源 Stra8 又表达 GFPCre 的工具鼠品系。可在后期生精细胞——A1 型精原细胞(type A1 spermatogonia,减数分裂之前)表达 Cre。该品系由上海南方模式生物构建。
Mettl3-vKO: Mettl3f/ΔVasa-Cre,由 Mettl3 flox 小鼠与 Vasa-Cre 交配后获得在早期生精细胞中 Mettl3 基因敲除实验组小鼠。
Mettl14-vKO: Mettl14f/ΔVasa-Cre
Mettls-vKO: Mettl3f/ΔMettl14f/ΔVasa-Cre,由 Mettl3 flox 、Mettl14 flox 双基因纯合子小鼠与 Mettl3 flox 杂合 、Mettl14 flox 杂合且 Vasa-Cre 阳性小鼠 或 Mettl3 flox 杂合 、Mettl14 flox 纯合且 Vasa-Cre 阳性小鼠交配后获得在早期生精细胞中 Mettl3 与 Mettl14 双基因敲除实验组小鼠。
Mettl3-sKO: Mettl3f/ΔStra8-GFPCre,由 Mettl3 flox 小鼠与 Stra8-GFPCre 交配后获得在 A1 型精原细胞中 Mettl3 基因敲除实验组小鼠。
Mettl14-sKO: Mettl14f/ΔStra8-GFPCre
Mettls-sKO:Mettl3f/ΔMettl14f/ΔStra8-GFPCre,交配方式同 Mettls-vKO。
研究结果
在早期生精细胞(gonocyte)内,只要敲除 Mettl3 或 Mettl14,均可导致精原干细胞丢失。
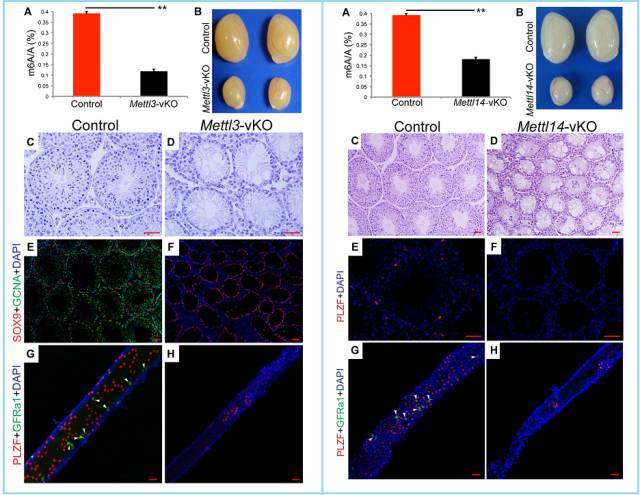
图 3. 早期生殖细胞特异性敲除 Mettl3-vKO(左图)或 Mettl14-vKO(右图)。
(A) UPLC-MS/MS (超高效液相色谱串联质谱法) 分析 Mettl3 或 Mettl14 敲除后未分化精原细胞中 m6A 修饰的比例显著降低。 (B) Mettl3 或 Mettl14 敲除后小鼠睾丸形态改变。 (C-D) H-E 切片染色,观察 6 周龄小鼠睾丸形态。 (E-F) 6 周龄小鼠睾丸切片免疫荧光染色,绿色为生殖细胞 marker GCNA,红色为支持细胞 marker SOX9,蓝色为细胞核 DAPI。(G-H) 4 周龄小鼠细精管切片免疫荧光染色,绿色为早期未分化精原细胞 marker GFRa1,红色为分化精原细胞 marker PLZF,蓝色为细胞核 DAPI;白色箭头指示 GFRa1 阳性细胞,表示 As 精原细胞,黄色箭头指示 PLZF 阳性细胞,表示 Ap 精原细胞。
在相对后期生精细胞(type A1 spermatogonia)内,只有同时敲除 Mettl3 和 Mettl14,才能够导致精子形成障碍。
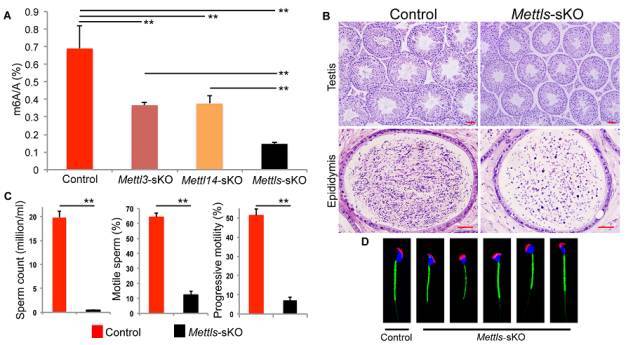
图 4. 后期生精细胞中 Mettl3 和 Mettl14 双基因敲除 (Mettls-sKO) 的表型。
(A) UPLC-MS/MS 分析 m6A 比例:单敲除 Mettl3-sKO 或 Mettl14-sKO 后,线期精母细胞中 m6A 水平降低大约 55%-65%;而 Mettls-sKO 两个基因同时敲除后 m6A 水平进一步显著下降至 20% 以下。(B) 双基因敲除后,睾丸与附睾形态改变:精子数量显著减少。(C) 双基因敲除后,2 月龄小鼠附睾尾部精子数量仅为对照组的 2%。计算机辅助精子分析(Computer Assisted Sperm Analysis, CASA)显示双基因敲除后精子活力也严重受损。(D) 荧光染色表明超过 80% 的附睾尾部精子头部发生异常。 花生植物凝血素(PNA,红色)显示顶体,MitoTracker 线粒体绿色荧光染料(绿色)显示线粒体,DAPI(蓝色)显示细胞核。
应用 m6A-seq 绘制了精子发生不同发育阶段的生精细胞 m6A RNA 修饰动态变化图谱,提示 m6A RNA 修饰水平影响转录本表达水平。
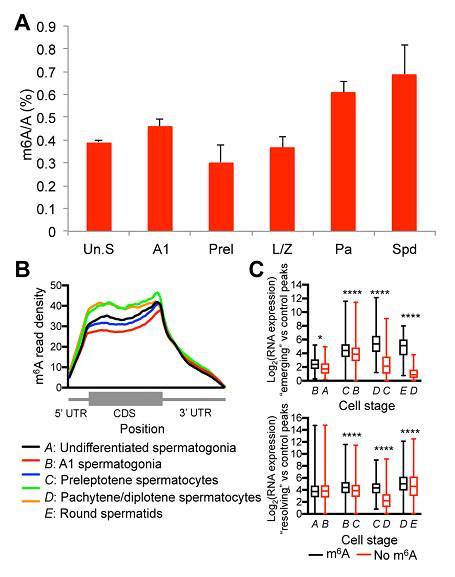
图 5. 精子发生过程中 m6A 的动态变化。
(A) 精原细胞在 6 个不同发育阶段中 m6A 的定量分析。Un.S:未分化精原细胞;A1:A1 型精原细胞;Prel:前细线期精母细胞;L/Z:细线/偶线期精母细胞;Pa:粗线/双线期精母细胞;Spd:圆形精细胞。(B) m6A-seq 分析不同发育阶段的 m6A 读取密度。(C) 不同发育阶段中当 m6A 水平上升时(上图)以及下降时(下图)甲基化基因(黑)RNA 表达水平均高于未甲基化(红)基因。
失活 m6A 甲基转移酶后,其介导的 m6A RNA 修饰水平显著降低,导致调控精原干细胞命运决定和精子形成的相关基因转录后翻译效率显著变化。
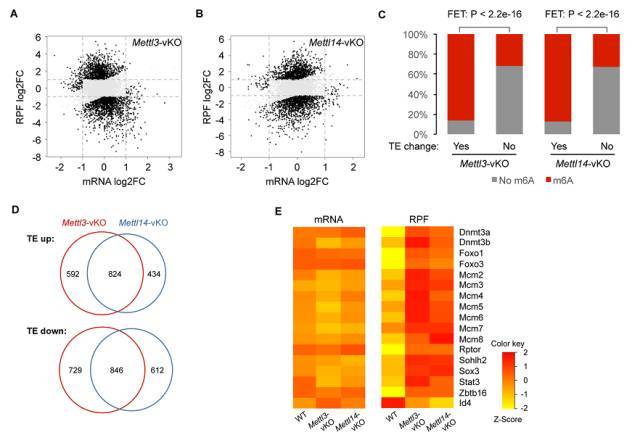
图 6. RNA-Seq 以及 Ribosome profiling 技术分析发现 Mettl3-vKO 和 Mettl14-vKO 单基因敲除小鼠 THY1+ SSC/前体细胞 mRNA 翻译失调。
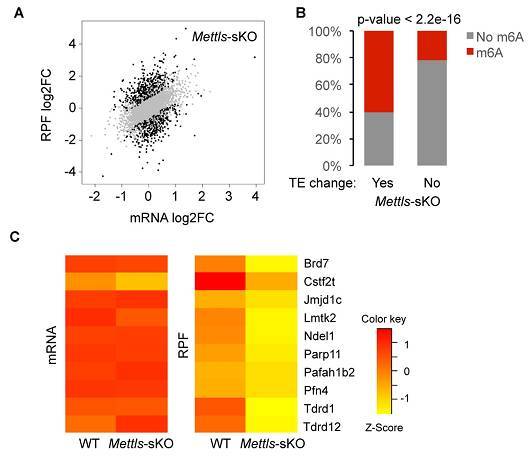
图 7. Mettl3 和 Mettl14 双基因敲除小鼠(Mettls-sKO)精子细胞 mRNA 翻译失调。