Nature Medicine ︱更精准的谱系示踪技术来啦!
11 月 13 日,Nature Medicine 在线发表了中国科学院生物化学与细胞生物学研究所周斌研究组的科研成果「Enhancing the precision of genetic lineage tracing using dual recombinases 」。该研究将 Dre-rox 重组系统引入到传统的基于 Cre-loxP 重组系统的遗传谱系示踪技术中,有效地规避了由于 Cre 表达的不特异性而导致的非特异性(「异位」)同源重组,实现了更为精准的遗传谱系示踪,为发育、干细胞及再生等领域的深入研究奠定了可靠的技术基础。
上海南方模式生物作为共同作者单位,为该研究构建了 10 种小鼠模型:IR1, IR2, NR1, NR2, CAG-DreER, Tnni3-Dre, Tnnt2-Dre, Alb-CreER, CK19-Dre 和 Alb-DreER。
新的谱系示踪技术
DeaLT(Dual-recombinase-activated lineage tracing)
该技术将 Dre-rox 重组系统与传统的 Cre-loxP 重组系统结合起来,Dre-rox 介导的重组反应在可能引起 Cre 异位表达的细胞中将 Cre 重组酶的识别位点 loxP 切除掉,从而有效地阻止了 Cre-loxP 的异位重组,增加了 Cre-loxP 介导的谱系示踪结果的准确性。
该系统的两种策略
DeaLT-IR:DeaLT-IR 策略的报告基因小鼠上包含的两个 loxP 位点和两个 rox 位点以交错形式存在(loxP-rox-loxP-rox), 例如:
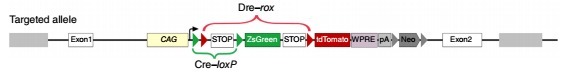
该策略适合组成性 Dre 与诱导性 Cre(CreER)相结合。
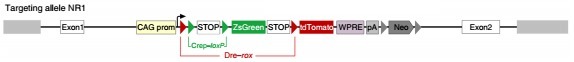
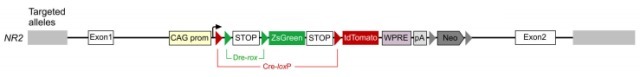
DeaLT-NR:DeaLT-NR 策略报告基因小鼠上的 loxP 位点和 rox 位点以嵌合的形式存在(rox-loxP-loxP-rox),例如:
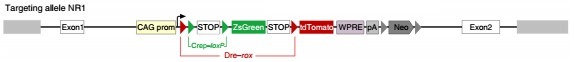
该策略适合诱导性 Dre(DerER)和诱导性 Cre(CerER)相结合。
研究背景
遗传谱系示踪技术(Genetic lineage tracing)
是一种利用 Cre-LoxP 位点特异性重组系统对细胞命运进行追踪展示的方法,用于揭示特定类型细胞在发育、疾病和再生中自我更新、分化和转分化的现象。
在含有 Cre 的转基因小鼠中,Cre 由于在特性基因的启动子驱动下,表达在特定的细胞类群中,当 Cre 小鼠与 Rosa26 位点含有 loxP 的报告基因小鼠交配时,Cre 通过识别 loxP 位点,将两个 loxP 位点之间的终止序列切除,从而使含有 Cre 的细胞类群表达出报告基因。
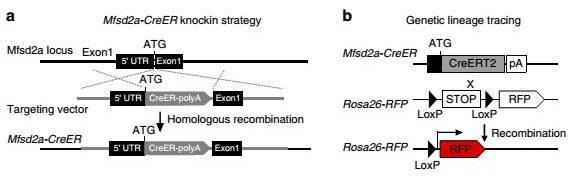
图 1. 谱系示踪一般策略。(a) knock-in strategy for Mfsd2a-CreER allele using CRISPR/Cas9 by homologous recombination and (b) genetic lineage tracing strategy for Mfsd2a+ hepatocytes by Cre-LoxP recombination in Mfsd2a+ hepatocytes. 图片来自 Nat Commun 2016;7:13369
由于这种切除是 DNA 水平上的,所以是永久且不可逆的,因此,所有表达 Cre 的细胞类群及其后代(无论是否表达 Cre)都将永久的被报告基因蛋白标记上,因此,利用该细胞追踪技术可以解析特定细胞的起源和命运。
尽管基于 Cre-loxP 系统的遗传谱系示踪技术是研究发育、疾病、再生等过程细胞命运可塑性的强大利器,但是它本身也存在着技术瓶颈。该技术的准确性主要依赖于 Cre 表达的特异性,如果有微量的 Cre 表达在了非靶向细胞中即为所谓的异位表达,那么谱系示踪结果的可靠性将大大降低,而这也成为了近年来很多科学问题出现争议的主要原因之一。
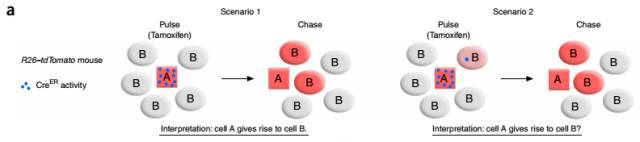
图 2. 异位表达对谱系示踪的影响。左图(情况 1):Cell A 表达诱导性 CreER,给予 tamoxifen 药物诱导(「Pulse」阶段),使 tdTomato 荧光蛋白在 Cell A 中表达;一段时间后的「Chase」阶段,追踪到 Cell B 也表达 tdTomato 荧光蛋白;说明 Cell B(本身没有 CreER 表达)是由 Cell A 分化而来。不过,一旦 Cell B 中本身有 CreER 的痕量表达,也会导致 Cre-loxP 重组的发生,而直接将 Cell B 标记上荧光蛋白,如右图(情况 2)所示,从而干扰对 Cell A 命运及 Cell B 起源的追踪。
两个争议问题:
1. c-Kit+ 心脏干细胞能否分化成心肌细胞?
2015 年,周斌课题组就利用 Kit-CreER 小鼠(由上海南方模式生物构建)与 Rosa-LSL-RFP 报告基因小鼠结合,对 c-Kit+细胞进行遗传谱系示踪。
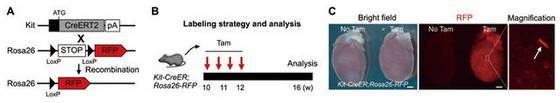
图 3. c-Kit-CreER 谱系示踪示意图。图片来自 Cell Research 2016: 26, 119–130
研究发现,大部分的 c-Kit+ 细胞为非心肌细胞(比如内皮细胞),不过仍有少量心肌细胞具有 c-Kit 表达。所以,用传统的示踪技术利用 c-Kit-CreER 无法准确回答成体 c-Kit+ 干细胞是否能够分化形成心肌细胞的问题。
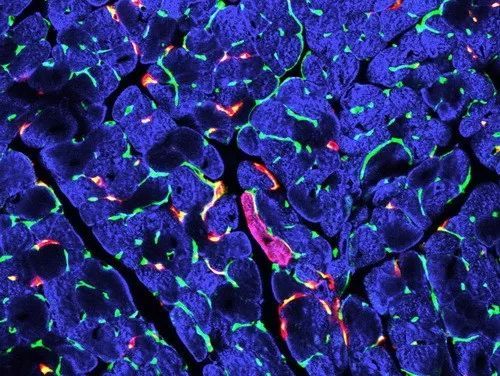
图 4. Kit-CreER(RFP)标记极少量的心肌细胞和部分内皮细胞:红色(RFP)指示 c-Kit+ 细胞,蓝色指示心肌细胞,绿色指示内皮细胞。图片来自 Cell Research 2016: 26, 119–130
2、Sox9+ 胆管上皮细胞能否转分化成肝实质细胞?
造成该争议的主要原因是 Sox9 除了主要在胆管上皮细胞(BECs)表达外,还少量的表达在胆管周围的肝细胞中。而传统的谱系示踪技术利用 Sox9-CreER 同时标记了胆管上皮细胞和胆管周围的一部分肝细胞,因此很难判断损伤后 Sox9-CreER 标记的新生成的肝细胞到底来自于哪一类细胞。
主要小鼠模型
双报告基因小鼠
IR(interleaved reporter):在 Rosa26 位点定点插入 ZsGreen/tdTomato 双荧光蛋白报告基因,其中包含以交错形式存在的两个 loxP 位点和两个 rox 位点(loxP-rox-loxP-rox)。
IR1
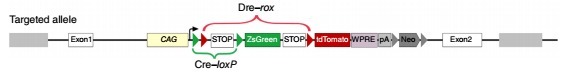
IR2-4
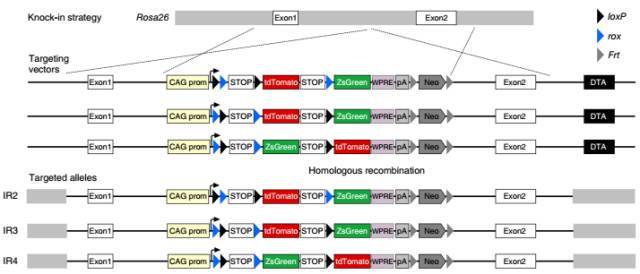
NR(nested reporter):在 Rosa26 位点定点插入 ZsGreen/tdTomato 双荧光蛋白报告基因,其中包含以嵌合的形式存在的两个 loxP 位点和两个 rox 位点(rox-loxP-loxP-rox)。
NR1
NR2
重组酶工具鼠
CAG-Dre:广泛表达的组成性 Dre
ACTB-Cre:广泛表达的组成性 Cre
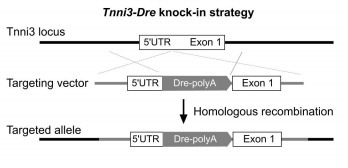
Tnni3-Dre:心肌细胞组成性 Dre
Kit-CreER:非心肌细胞诱导性 Cre(主要在内皮细胞表达,在少量心肌细胞中也有表达)
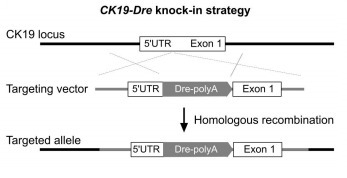
Krt19-Dre:胆管上皮细胞组成性 Dre,在一些肝实质细胞中也有 Cre 表达,也叫 CK19-Dre
Alb-CreER:肝实质细胞诱导性 Cre
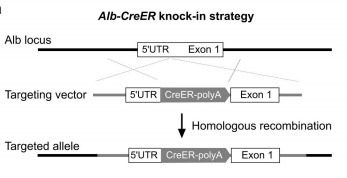
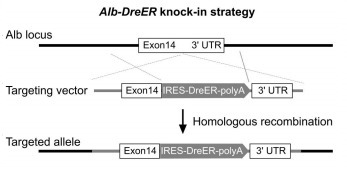
Alb-DreER:肝实质细胞诱导性 Dre
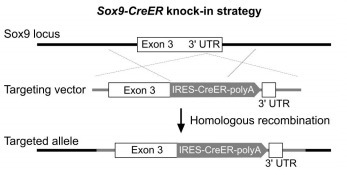
Sox9-CreER:胆管上皮细胞诱导性 Cre,在一些门静脉周围的肝细胞中也有 Cre 表达
研究结果
建立 DeaLT-IR 双报告基因系统。
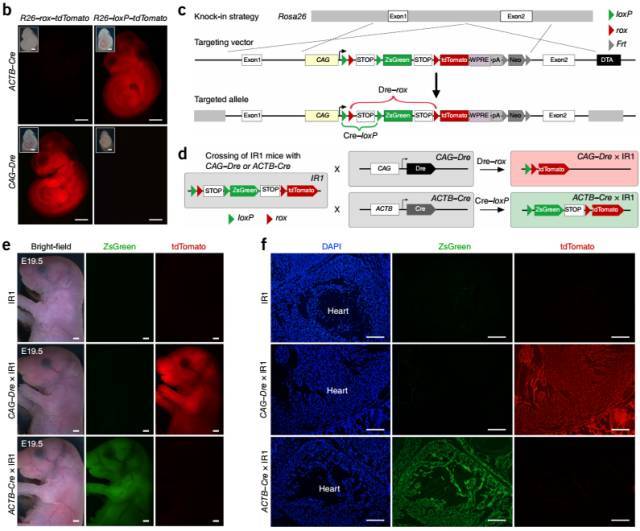
图 5. IR1 小鼠构建及验证结果。(b)ACTB-Cre 和 CAG-Dre 分别与 Rosa26-loxP-STOP-loxP-tdTomato 或 Rosa26-rox-STOP-rox-tdTomato 交配,子代 E9.5 天荧光检测重组酶活性。(c)IR1 构建策略示意图。(d-f)IR1 分别与 ACTB-Cre 或 CAG-Dre 交配后子代荧光表达结果示意图(d);E19.5 天胚胎荧光检测结果(e); E19.5 天心脏切片自发荧光检测(f)。
利用 DeaLT-IR 双报告基因系统(Tnni3-Dre × Kit-CreER × IR1 mice),有效阻断了心肌细胞中 c-Kit-CreER 介导的重组反应,实现非心肌细胞中 c-Kit+ 干细胞特异性的遗传谱系示踪。结果发现,c-Kit+ 干细胞在成体心脏生理稳态和损伤修复过程中均不会分化形成心肌细胞,主要是通过血管新生参与心脏修复。
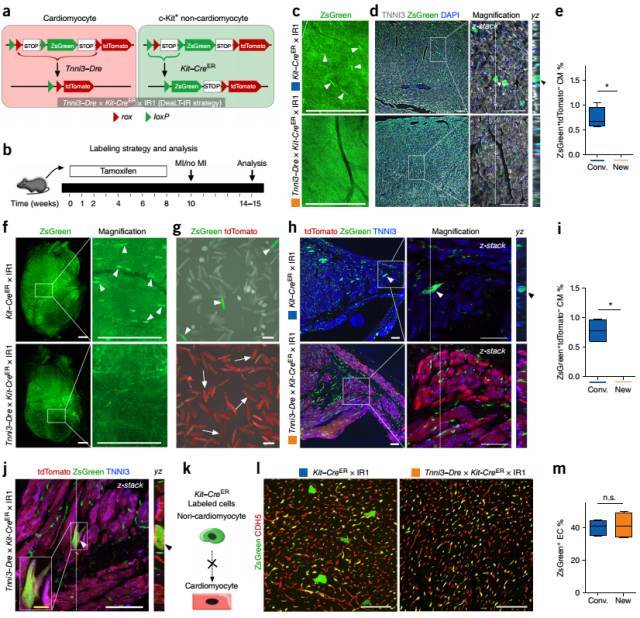
图 6. DeaLT-IR 系统揭示 c-Kit+ 非心肌细胞不会向心肌细胞分化。 (a)Tnni3-Dre × Kit-CreER × IR1 小鼠中 Tnni3-Dre 在心肌细胞中先切除一个 loxP 位点和 ZsGreen,如此一来 tamoxifen 只能诱导非心肌细胞中 Kit-CreER 的重组,从而标记 c-Kit+ 的非心肌细胞。(b)给予 tamoxifen 诱导荧光标记与检测及心肌梗死造模时间轴。(c-e)在未损伤的心脏中,Kit-CreER×IR1 小鼠除了大量 ZsGreen 绿色荧光蛋白标记的内皮细胞以外,还可观察到一些绿色荧光标记的心肌细胞;而利用 DeaLT-IR 系统,则没有心肌细胞被 ZsGreen 绿色荧光标记。说明 c-Kit+ 非心肌细胞并未生成新的心肌细胞。(f-k)相似的,冠状动脉结扎导致心肌梗死模型 4 周后,在受损的心脏中,Kit-CreER×IR1 的常规示踪策略可观察到一些绿色荧光标记的心肌细胞;而 DeaLT-IR 系统中则没有心肌细胞被 ZsGreen 绿色荧光标记。说明 c-Kit+ 非心肌细胞在心脏受损情况下同样未形成新的心肌细胞。(l-m)而内皮细胞在常规示踪方法及新的示踪系统中均可被标记。
DeaLT-IR 系统也可追踪细胞转化。比如清楚地展现肝损伤后肝细胞能够转分化形成胆管上皮细胞的过程。
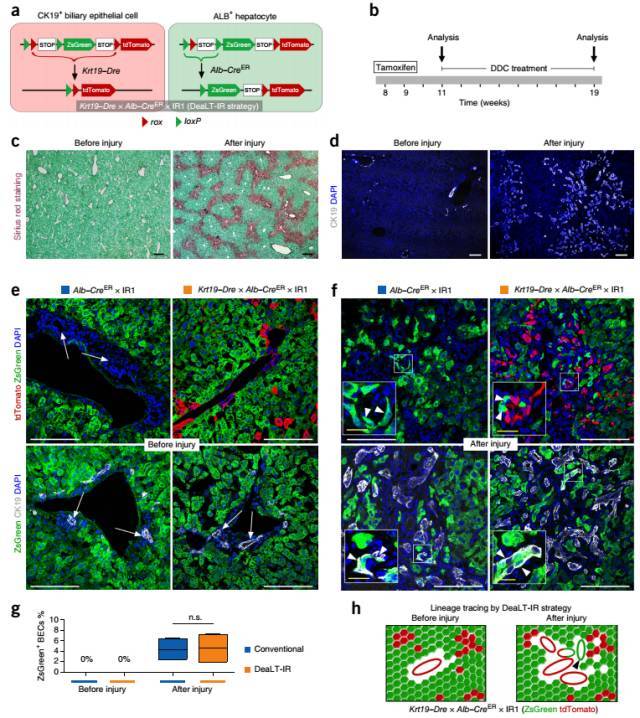
图 7. 利用肝细胞向胆管细胞转化过程进一步验证 DeaLT-IR 系统。(a)在 Krt19-Dre×Alb-CreER×IR1 小鼠中,CK19+ 胆管上皮细胞(BECs)表达 tdTomato 红色荧光蛋白,而 肝实质细胞则被 ZsGreen 绿色荧光蛋白标记。(b-d)DDC 诱导肝损伤后,大量纤维组织形成,并发生导管反应。(e-g)DDC 诱导前,Alb-CreER 使大多数肝实质细胞被标记绿色荧光,但并没有标记胆管上皮细胞。DDC 诱导肝损伤后,有一部分 CK19+ BECs 表达 ZsGreen 绿色荧光蛋白。传统示踪方法与新系统均得到同样的结果。(h)肝实质细胞向导管上皮细胞转化的示意图。
建立 DeaLT-NR 双报告基因系统。
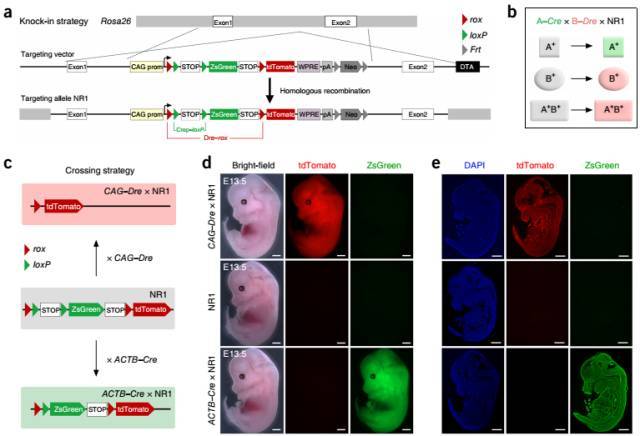
图 8. NR1 小鼠构建及验证结果。(a)NR1 小鼠构建策略示意图。(b)DeaLT-NR 系统(A-Cre×B-Dre×NR1)原理示意图。A+ 细胞被标记上绿色荧光,B+ 细胞被红色荧光标记,A+B+ 细胞标记红色荧光。(c)CAG-Dre 和 ACTB-Cre 分别与 NR1 小鼠交配示意图。(d-e)E13.5 天,CAG-Dre 和 ACTB-Cre 分别与 NR1 小鼠交配子代荧光表达检测。
利用 DeaLT-NR 双报告基因系统(Alb-DreER × Sox9-CreER × NR1 mice),有效阻断了 Sox9-CreER 在肝细胞中的重组反应,实现了 Sox9+ 胆管上皮细胞中特异性的遗传谱系示踪,结果发现在肝脏生理稳态和损伤修复过程中 Sox9+ 胆管上皮细胞并不会转分化形成肝细胞。
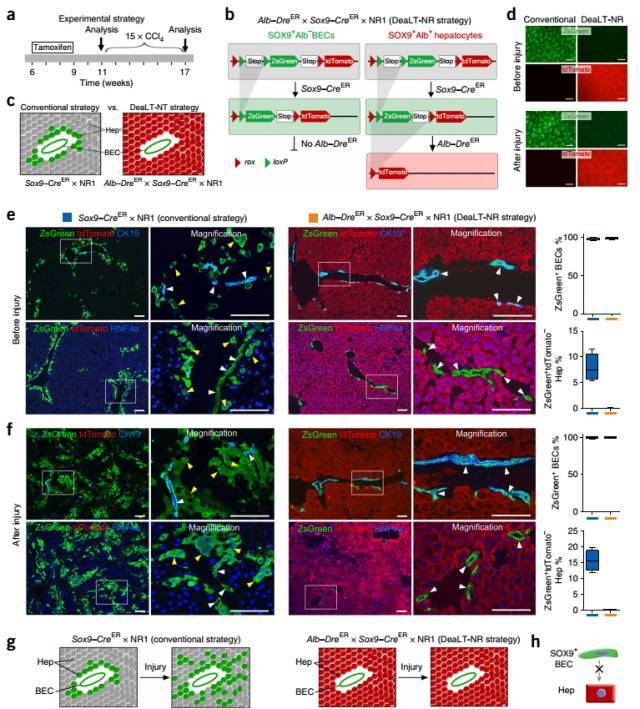
图 9. DeaLT-NR 系统揭示肝脏损伤后 Sox9+ 胆管上皮细胞向胆管细胞而非肝实质细胞分化。(a)DeaLT-NR 系统标记、CCl4 肝损伤造模及检测时间轴。(b-c)Alb-DreER×Sox9-CreER×NR1 小鼠中 Cre 及 Dre 介导的重组效果示意图。在 DeaLT-NR 系统中 Sox9+ BECs 被标记为绿色(ZsGreen),而 Sox9+ 门静脉周围肝细胞则被标记为红色(tdTomato)。(d-f)利用 DeaLT-NR 系统,可以排除由于 Sox9 在 HNF4a+ 门静脉周围肝细胞中少量表达导致的绿色荧光标记;并且在 CCl4 诱导慢性肝损伤后,没有观察到绿色荧光细胞数量的增加。(g-h)示意图说明传统示踪方法中观察到的肝损伤后绿色荧光标记细胞的增加其实是少量 Sox9+ 门静脉周围肝细胞的增加;而非 Sox9+ 胆管上皮细胞向肝实质细胞的转分化。
DeaLT 系统可以严格控制潜在的非靶向细胞表达 Cre 介导的异位谱系追踪,为更准确地解析细胞起源和命运提供了有效的手段。
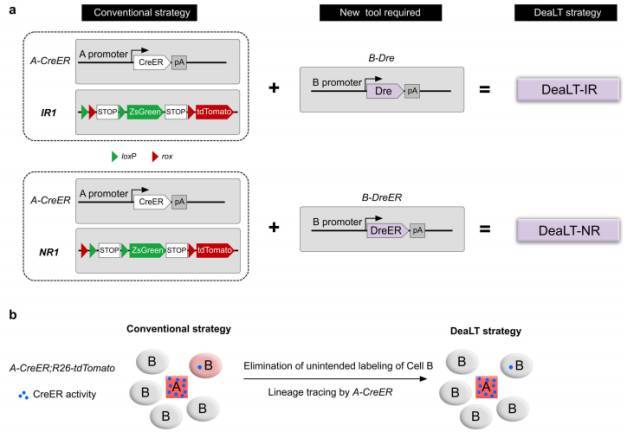
图 10. DeaLT 系统解决异位谱系示踪难题。(a)将 Dre-rox 系统引入到常规的 Cre-loxP 介导的谱系示踪系统中,增加了系统的精准性,严格控制了 Cre 的异位表达。(b)DeaLT 系统准确性示意图。

更多周斌研究员课题组的谱系示踪研究成果