心内膜细胞的血管潜能
1 月 26 日,Circulation Research 在线发表了中国科学院生物化学与细胞生物学研究所周斌研究组的科研成果「Genetic Fate Mapping Defines the Vascular Potential of Endocardial Cells in the Adult Heart」的文章,揭示了成年人心脏中心内膜细胞再生冠状动脉血管的潜能。
本研究中 Npr3-CreER 小鼠由上海南方模式生物构建。
Highlight
根据以往的研究认为:
在胎儿和新生儿阶段,心内膜细胞产生冠状血管。
在成年人的心脏中,预先存在的冠状内皮细胞主要在心脏损伤后介导新血管的形成。
有报道指出,成人心内膜细胞是心肌梗塞后冠状血管的重要来源。
研究中建立了可特异性标记成年心脏心内膜的 Npr3-CreER 基因敲入小鼠。利用该小鼠,研究发现成年心脏中的心内膜细胞在心脏稳态或受伤后对冠状血管的贡献极少;成年心内膜细胞,当陷入损伤心肌时,表现出血管特性的潜能。
小鼠模型
Npr3-CreER 小鼠:利用经典 ES 细胞打靶技术,将诱导型 CreER 插入到小鼠 Npr3 基因的 C 端。该品系由上海南方模式生物构建。可特异性标记成年心脏中的心内膜细胞,而非冠状血管。
R26-tdTomato 小鼠:在小鼠 Rosa26 位点定点插入条件性表达的 tdTomato 报告基因。与 Npr3-CreER 交配后,可在 Tamoxifen 诱导后在心内膜细胞中跟踪红色荧光蛋白的表达,从而达到细胞命运示踪的目的。
Apln-CreER 小鼠:特异性标记血管内皮细胞。
Wt1-CreER 小鼠:特异性标记心外膜细胞。
研究结果
Npr3-CreER 标记心内膜细胞而不是冠状血管。
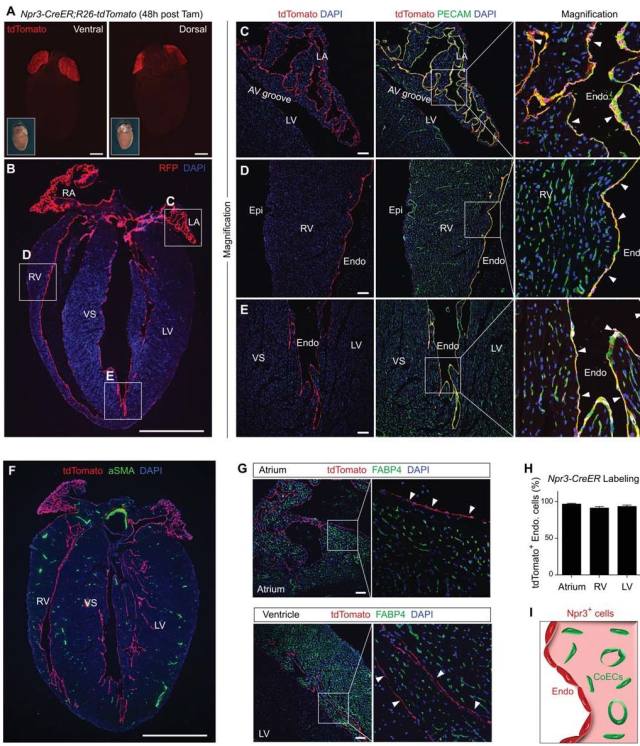
图 1. 给成年 Npr3-CreER; R26-tdTomato 小鼠注射 Tamoxifen 诱导后 48 小时,取心脏组织进行分析发现在右心房和左心房检测到强烈的 tdTomato 荧光信号(红色)(图 1A-B)。这些 tdTomato 阳性细胞位于心室壁的最内层,指示心内膜;以及部分位于心室壁的最外层,指示部分心外膜细胞亚群(图 1B)。内皮细胞标记物 PECAM(绿色)的免疫染色证实 tdTomato 阳性细胞确实是心内膜内皮细胞(图 1C-E)。一些 tdTomato 阳性细胞位于心室壁内而不是心肌壁表面(图 1B)。 tdTomato 和α平滑肌肌动蛋白(aSMA)的免疫染色显示这些 tdTomato 阳性管样结构不是冠状动脉(图 1F)。 此外,冠状血管内皮细胞标志物 FABP4(绿色)染色发现心肌内这些 tdTomato 阳性管状结构并不是 FABP4 阳性的冠状血管(图 1 G)。量化心内膜细胞中 tdTomato 阳性细胞的百分比发现 Npr3-CreER 在心房,右心室和左心室(> 90%)有效标记心内膜细胞(图 1 H)。这些数据表明 Npr3-CreER 在成年心脏中可以特异性和有效地标记心内膜细胞(Endo)而非冠状动脉或心脏血管内皮细胞(图 1I)。 Npr3-CreER 介导的心内膜细胞示踪将有助于解决如果心内膜细胞在体内平衡期间或损伤后在成年心脏中生成血管内皮细胞。
内环境稳定的情况下,成年心内膜细胞保持其心内膜的细胞命运。
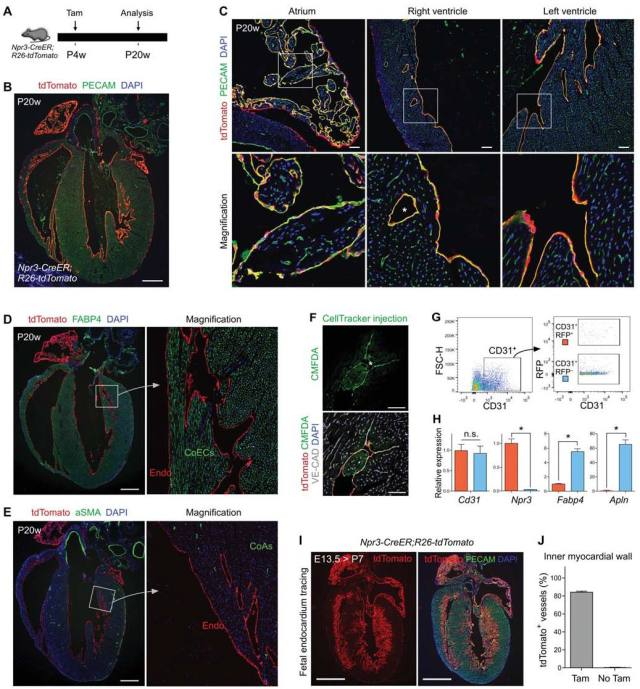
图 2. Npr3-CreER; R26-tdTomato 小鼠 4 周龄时进行 Tamoxifen 诱导,并在 20 周龄时对心脏组织进行采样分析(图 2A)。20 周龄时 tdTomato 表达富集在最内层,并且在心脏最外层的细胞中也有 tdTomato 荧光表达,分别指示心内膜细胞和心外膜细胞亚群(图 2B)。 这些 tdTomato 阳性细胞表达内皮细胞标记物 PECAM(绿色),衬在心脏的最内层,表明了心内膜细胞的特性(图 2C)。 在年轻的成年心脏(20 周龄)中,还在心室壁的心肌内检测到几个 tdTomato 阳性管状结构(星号,图 2C)。FABP4 和 tdTomato 的免疫染色显示 tdTomato 阳性管状结构并不表达 FABP4(绿色)(图 2D),表明它们不是血管内皮细胞。 此外,管状结构通常直径较大,由于缺乏 SMA 阳性平滑肌细胞,因此这些管状结构不是冠状动脉(CoA)(图 2E)。与年轻小鼠一样,62 周龄的老年小鼠中心内膜细胞也不产生新的血管。此外,将荧光素染料 CMFDA 注入到 Npr3-CreER; R26-tdTomato 小鼠的心室中,并在位于小梁凹槽之间的 tdTomato 阳性心内膜细胞(被 Npr3-CreER 标记)中检测到 CMFDA(图 2F)。接下来,通过流式细胞术分离来自 Npr3-CreER; R26-tdTomato 心脏的 tdTomato 阳性和 tdTomato 阴性内皮细胞并进行 qRT-PCR,检测心内膜和血管内皮细胞的基因表达(图 2 G)。与 tdTomato 阴性的 EC 相比,Npr3 在 tdTomato 阳性 EC 中高度富集,Fabp4 和 Apln 的表达水平显着降低(图 2 H)。由于 Npr3-CreER 标记的心内膜在成年阶段对冠状血管的新生没有贡献,使用 Npr3-CreER 标记胎儿心内膜作为示踪系统的阳性对照。在胚胎期 13.5 天对 Npr3-CreER; R26-tdTomato 小鼠进行 Tamoxifen 诱导,并收集出生后心脏进行分析(图 2I)。与之前的研究一致,在胎儿阶段,心内膜细胞主要参与心肌内壁的冠状血管生成(图 2I-J)。
心脏损伤后,成年心内膜细胞极少生成冠状动脉血管。
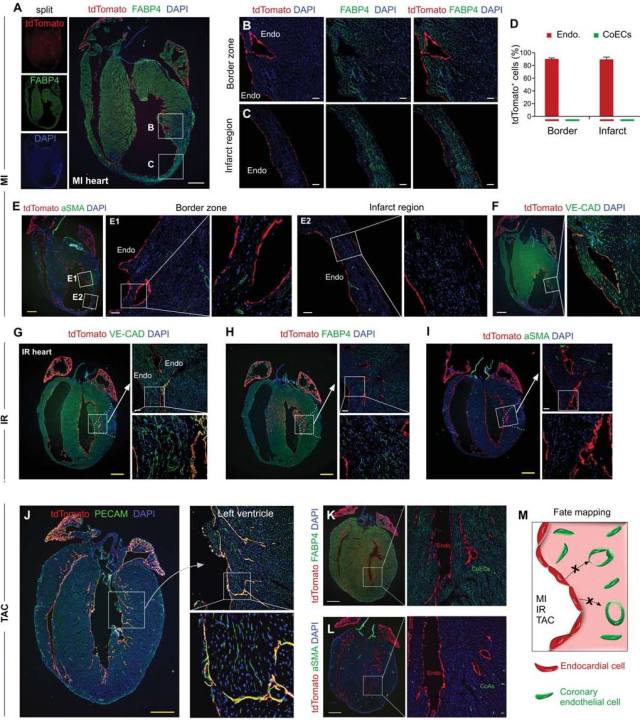
图 3. 对 Npr3-CreER;R26-tdTomato 小鼠在第 6-8 周分别进行中度和重度心肌梗塞(MI)造模,并在 MI 后 2-4 周对心脏组织进行分析。 在中度心肌梗死模型中,整体心脏切片染色显示 tdTomato 阳性细胞主要局限于 MI 心脏的最内层(图 3A)。tdTomato 和 FABP4 的免疫染色在 MI 心脏的边界和梗塞区域没有发现带有 tdTomato 标记的 FABP4 阳性心脏血管内皮细胞(图 3B-D)。对 MI 心脏中的 tdTomato 阳性管状结构进行 aSMA 染色,发现它们不是 aSMA 阳性冠状动脉,排除了管状结构成为冠状动脉的可能性(图 3E-F)。此外,在心肌梗塞再灌注(IR)模型中,结果显示 tdTomato 阳性细胞主要位于心脏最内层,维持心内膜细胞命运(图 3 G)。 这些 tdTomato 阳性的细胞不分化成 FABP4 阳性的心脏血管内皮细胞(图 3 H),也不分化成αSMA 阳性的冠状动脉内皮细胞(图 3I)。 这些数据表明,心肌梗塞后心内膜细胞对冠状动脉血管生成的贡献很少,而对 IR 后的冠脉血管则没有贡献。通过对 Npr3-CreER;R26-tdTomato 小鼠在第 8 周进行横向主动脉缩窄(TAC)造模,PECAM 和 tdTomato 免疫荧光染色显示 tdTomato 阳性细胞主要位于心肌的最内层,行使内皮细胞命运(图 3J)。同样用 FABP4 或 aSMA 荧光染色证实 tdTomato 阳性细胞并不是 CoECs,与冠状动脉无关(图 3K-L)。
重新定位或陷入心肌损伤的成年心内膜细胞极少有助于新血管形成。
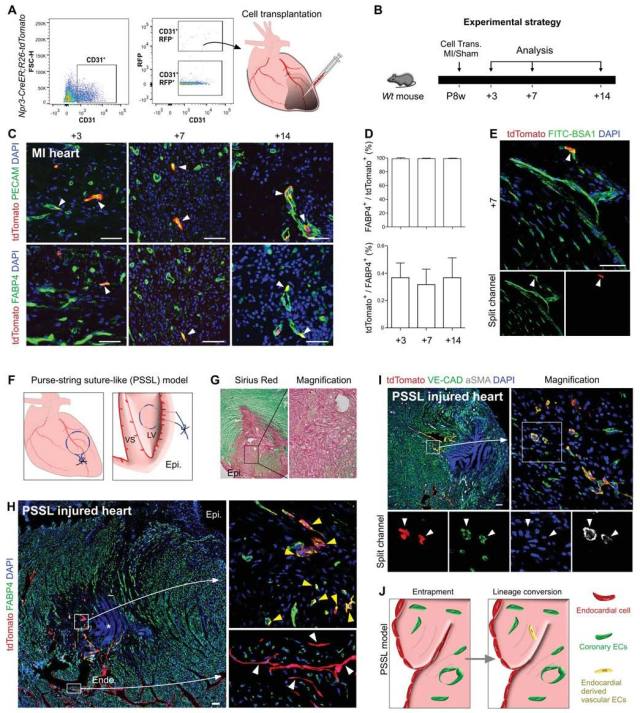
图 4. 分离成年心内膜细胞并移植到 MI 心脏的心肌中(图 4A)。分别在移植后的第 3 天,第 7 天和第 14 天采集心脏样本,分析它们在 MI 心肌中的细胞命运(图 4B)。 通过 tdTomato,PECAM 或 FABP4 的免疫荧光染色发现,内膜衍生细胞获得了部分血管内皮细胞特性(例如 FABP4 的表达)和毛细血管形态(图 4C)。量化 tdTomato 阳性心脏血管内皮细胞的百分比显示,存在于梗塞心肌中的大多数 tdTomato 阳性细胞表达 FABP4。 然而,它们对损伤诱导的血管生成的贡献是极小的,因为只有大约 0.3-0.4% 的受损心肌中血管内皮细胞是心内膜来源的(图 4D)。通过静脉注射 FITC 标记的 BS1 凝集素(绿色)来标记与小鼠血循环相关的内皮细胞,结果发现 tdTomato 阳性毛细血管内皮细胞是 BS1 凝集素阳性(图 4E)。这些数据表明,心内膜细胞可能有助于冠状血管内皮细胞,但其对损伤诱导的新血管形成的贡献是极小的。为了进一步检测成年心内膜细胞是否具有在体内产生冠状血管的潜能,对小鼠进行荷包缝合线模型(PSSL)造模(图 4F)。通过天狼星红染色,证实扭曲的心肌区域严重损伤(图 4 G)。 tdTomato 和 FABP4 荧光染色显示心肌梗死区有相当数量的心内膜来源细胞(tdTomato 阳性)是 FABP4 阳性冠状血管内皮细胞(图 4 H),表明被困的心内膜细胞在 PSSL 损伤后获得了一些血管细胞特性的潜能。相反,非损伤区心内膜细胞不分化成冠状血管(图 4 H)。有趣的是,有一小部分 tdTomato 阳性内皮细胞是位于损伤区域边界的冠状动脉(图 4I),提示成年心内膜细胞可能具有重建部分冠状动脉的潜力。尽管如此,但与大多数地区的绝大多数未标记的冠状血管相比,心内膜衍生的血管细胞(tdTomato 阳性细胞)的贡献仍是微小到可忽略不计的(图 4 H-I)。