Sema3a-CreERT2 小鼠用于特异靶向心脏 Purkinje 纤维
上个月,中国科学院生物化学与细胞生物学研究所周斌研究组又有新科研成果发表在 Scientific Reports 上啦,题为「Genetic targeting of Purkinje fibres by Sema3a-CreERT2 」,提供了一种新的遗传学工具——Sema3a-CreERT2 工具鼠——用于研究调节浦肯野纤维功能的分子机制。
本研究中 Sema3a-CreERT2 工具鼠由上海南方模式生物构建。
研究背景
心脏传导系统(cardiac conduction system )是由位于心壁内,由特有的功能高度分化的心肌细胞构成,其功能是产生电冲动并传导到心脏各部,使心房肌和心室肌按一定节律性收缩。心脏收缩从右心房窦房结(SA 结)开始。然后,电活动在房室结(AV 结)处延迟,随后通过房室束(His 束及束支)快速传导并迅速地传播到整个心室壁。心脏传导系统功能异常就可能导致心律失常。
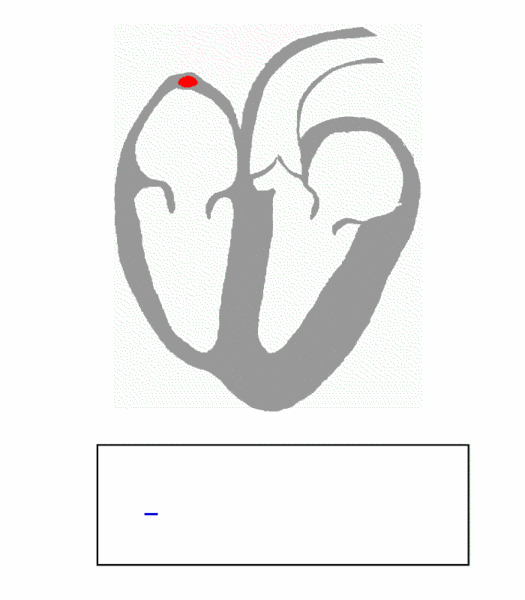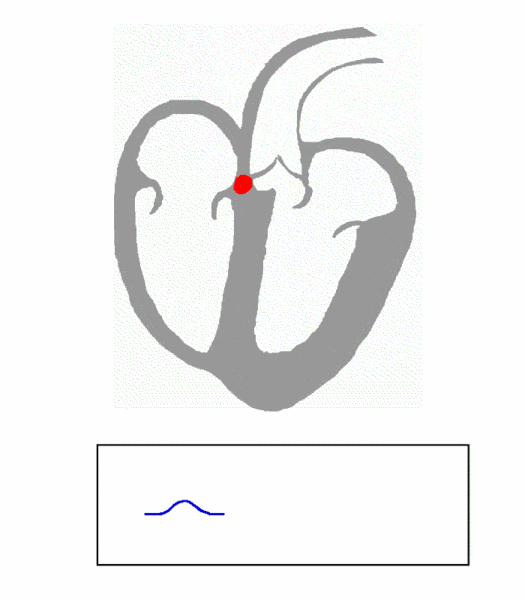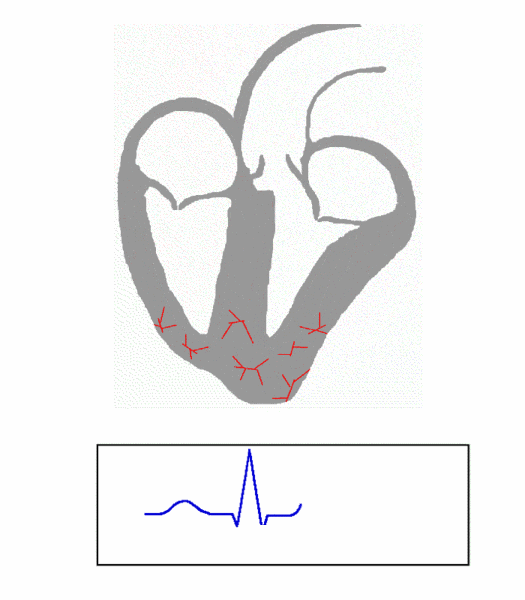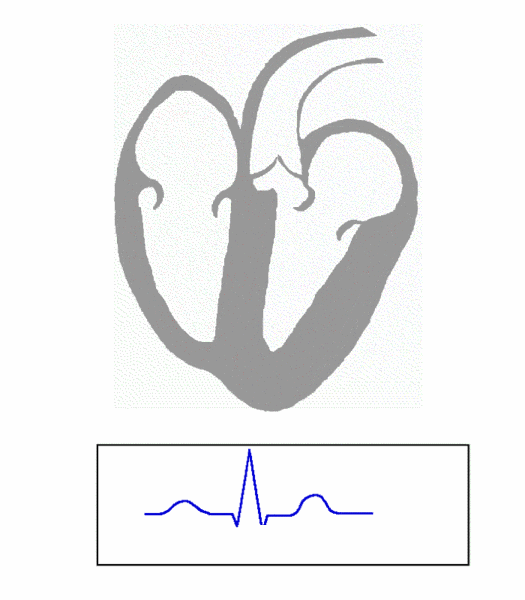
图 1. Principle of ECG formation, fast
(图片来源:https://en.wikipedia.org/wiki/File:ECG_Principle_fast.gif)
本文的主角,浦肯野纤维(Purkinje fiber),是构成房室束及其分支的主要细胞,又称束细胞。浦肯野纤维细胞间连接及其离子通道机制是保证心脏电冲动正常传导的基础,当细胞间连接及跨膜离子流发生变化时,浦肯野纤维系统电生理发生改变,从而导致心律失常。因此,了解调节浦肯野纤维发育、形成、以及维持正常功能的分子机制就将为心律失常的病理生理过程提供解释与证据。
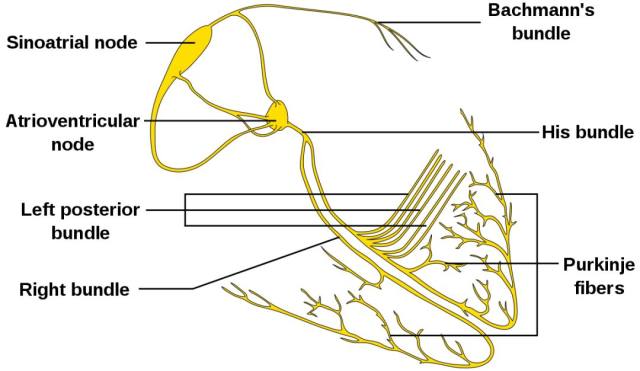
图 2. Isolated heart conduction system showing Purkinje fibers
(图片来源:https://en.wikipedia.org/wiki/Purkinje_fibers#/media/File:ConductionsystemoftheheartwithouttheHeart-en.svg)
先前的研究中,有一些 Cre 或 CreERT2 工具鼠被用来标记心脏传导系统。比如:
用 Hcn4-CreERT2 来标记传导系统,包括窦房结、部分房室结、His 束、束支和浦肯野纤维。不过,除传导系统以外,Hcn4-CreERT2 还会把发育中的心脏的部分内皮细胞也标记上。
Cntn2-Cre 也是心脏传导系统的另一种遗传工具,它特异性靶向 SA 结、AV 结,左束支和右束支以及浦肯野纤维。
Cx40-CreERT2 靶向心房和 VCS 心肌细胞,以及冠状动脉内皮细胞。
可惜的是,缺乏特异性靶向浦肯野纤维(而不靶向其它细胞)的专一性工具,对于专门研究浦肯野纤维的功能还是不够的。
小鼠模型
Sema3a-CreERT2 小鼠
由于已知 Sema3a 基因敲除纯合子小鼠具有感觉和交感神经元异常、胚胎骨和软骨结构异常、心脏缺陷和出生后死亡的严重不良表型,故利用经典 ES 细胞打靶技术,将诱导型 CreERT2 插入到小鼠 Sema3a 基因的起始密码子位置,构建 Sema3a-CreERT2 小鼠模型。该品系由上海南方模式生物构建。
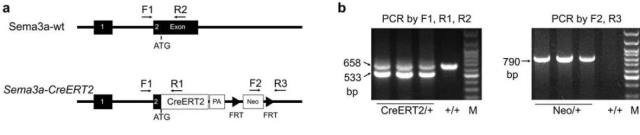
图 3. Sema3a-CreERT2 构建策略于基因型鉴定结果。
R26-tdTomato 小鼠:在小鼠 Rosa26 位点定点插入条件性表达的 tdTomato 报告基因。
研究结果
构建 Sema3a-CreERT2 小鼠模型。
Sema3a 是从无脊椎动物到脊椎动物都保守的信号素家族的成员。研究表明 Sema3a 在神经系统发育中具有重要作用。 Sema3a 可能是一种化学抑制剂,可以抑制轴突的生长,尤其是外周神经轴突,从而维持正常的神经元形态模式。 Sema3a 的过度表达会导致神经疾病,如精神分裂症;而 Sema3a 缺陷又导致异常的神经元系统。此外,Sema3a 还在免疫调节和癌症发展中起到生理作用。最近的一项研究表明 Sema3a 可以通过调节交感神经支配的模式来保持正常的心律。虽然有研究发现 Sema3a 在 Purkinje 纤维和小梁心肌细胞亚组中表达,但 Sema3a 在心脏传导系统中的谱系追踪却至今没有报道。
利用经典 ES 细胞打靶技术,将诱导型 CreERT2 插入到小鼠 Sema3a 基因的起始密码子位置,构建 Sema3a-CreERT2 小鼠模型。用雌激素受体(ESR)抗体染色作为 Sema3a 的替代物,检测 Sema3a 在 Sema3a-CreERT2 小鼠组织中的表达。 在 E12.5,E14.5 和 E19.5 胚胎心脏切片中对 ESR(代替 Sema3a)和 TNNI3(心肌细胞 Marker)共染色。免疫染色结果显示 ESR/Sema3a 主要在小梁心肌表达,但在 E12.5 和 E14.5 天的胚胎心脏致密层中也检测到少量的表达。在 E19.5 天,ESR/Sema3a 在位于心室腔侧的心内膜下小梁心肌细胞中表达。在致密心肌的心肌细胞或冠状动脉中未检测到 ESR/Sema3a。总之,这些数据与早前对 Sema3a 表达的研究一致,证明了 Sema3a-CreERT2 小鼠构建成功。
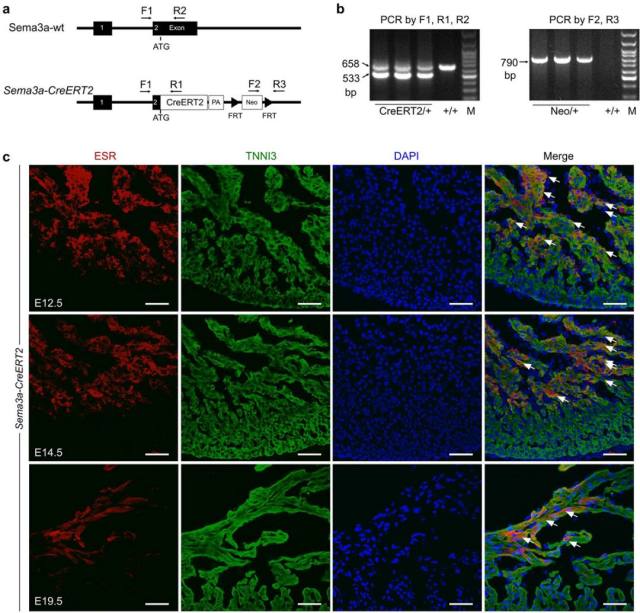
图 4.(a-b)Sema3a-CreERT2 构建策略于基因型鉴定结果。(c)在 E12.5,E14.5 和 E19.5 天 Sema3a-CreERT2 小鼠心脏雌激素受体(ESR)免疫荧光染色,指示 Sema3a 的表达。 箭头指示 Sema3a+心肌细胞。
Sema3a-CreERT2 在成年小鼠心脏中标记浦肯野纤维。
根据 Sema3a-CreERT2 小鼠的 ESR 染色分析,Sema3a 主要在小梁心肌细胞中表达,而不是在致密层中。由于浦肯野纤维主要集中在心室壁的最内层,接下来就需要确定 Sema3a-CreERT2 是否可以特异性靶向成年小鼠心脏中的浦肯野纤维。通过 Sema3a-CreERT2 与 R26-tdTomato 小鼠交配获得 Sema3a-CreERT2; R26-tdTomato 双阳性小鼠。 只有在他莫昔芬存在时,CreERT2 才会从细胞质易位到细胞核中进行 Cre-loxP 重组,这就可以使 Sema3a +细胞及其后代中永久标记上 tdTomato 红色荧光(RFP)(图 5b)。
对 8-12 周龄的小鼠给予他莫昔芬诱导,并在他莫昔芬处理 48 小时后收集心脏组织样本,发现在心房心肌细胞有稀疏的 RFP+细胞(图 5c-d)。为了确定 Sema3a 是否在 SA 结和 AV 结中表达,对 HCN4 和 RFP 进行共染色,发现 Sema3a 在 SA 结中不表达并且在 AV 节点中有少量表达(图 5e-f)。Cx40 在研究中被用来作为心室传导系统(VCS)marker,因此我们生成了 Sema3a CreERT2; R26-tdTomato; Cx40 GFP 三阳性小鼠来检测浦肯野纤维中 Sema3a 的表达。发现 RFP 与 GFP+细胞共同定位于心室壁的心内膜下层,而致密心肌中的 GFP+冠状动脉则未检测到 RFP 信号(图 5 g)。心脏整体荧光结果显示 Cx40 在心房中表现出总体表达,而几乎未检测到 Sema3a。 Cx40 也在 His(HB)束中,在左束支和右束支以及浦肯野纤维中表达,这与之前的报道一致。与 Cx40(GFP 信号)相比,Sema3a(RFP 信号)很大程度上只存在浦肯野纤维中,并且在 His 束或束支中也没有检测到(图 5 h-i)。 Z-stack 共聚焦证实 Sema3a(RFP 信号)在心室心肌心内膜下的 Cx40 阳性浦肯野纤维中表达(图 5j)。这些数据表明,Sema3a-CreERT2 能够特异性靶向成年小鼠心脏中的心室浦肯野纤维。
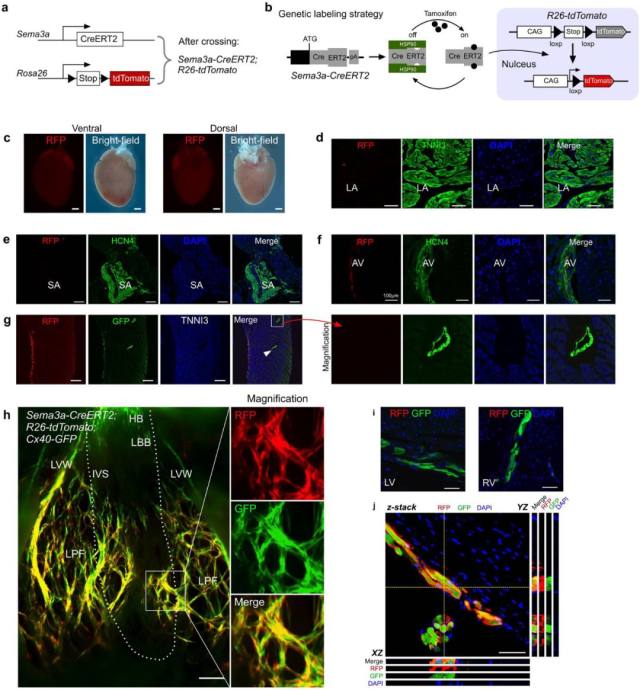
图 5. 成年小鼠心脏中 Sema3a 表达谱。(a)Sema3a-CreERT2; R26-tdTomato 小鼠交配示意图。(b)通过他莫昔芬诱导标记 Sema3a+细胞示意图。(c)Sema3a-CreERT2; R26-tdTomato 小鼠心脏整体红色荧光 RFP 表达示意图。(d)Sema3a-CreERT2; R26-tdTomato 小鼠 RFP 和 TNNI3 免疫荧光染色显示心房中 RFP+细胞稀少。(e)在 SA 结中未检测到 Sema3a+细胞。(f)Sema3a 在 AV 结中的表达。(g)Sema3a-CreERT2; R26-tdTomato 小鼠中 RFP,GFP 和 TNNI3 的免疫染色显示 CX40+冠状动脉(箭头所示)呈 RFP 阴性。(h)Sema3a-CreERT2; R26-tdTomato; Cx40-GFP 小鼠心脏的整体荧光视图。虚线表示 IVS 和 LVW 之间的界限。(i)对 Sema3a-CreERT2; R26-tdTomato; Cx40-GFP 小鼠心脏 LBB 或 RBB 中未检测到 Sema3a,而 Cx40-GFP 为阳性。(j) Z-stack 共聚焦显示 Sema3a 在浦肯野纤维中表达。
利用 Sema3a-CreERT2 对浦肯野纤维进行谱系追踪。
由于 Sema3a 在胚胎时期比在成年后具有更广泛地表达,那么问题来了,Sema3a+心肌细胞是什么时候开始向浦肯野纤维的命运发展的呢?
将他莫昔芬注射到 E12.5,E14.5 或 E18.5 天的 Sema3a-CreERT2; R26-tdTomato; Cx40-GFP 三阳性小鼠中,并在 P7 或 P21 天对小鼠心脏进行分析。谱系示踪数据显示 E12.5 开始诱导标记的 Sema3a+细胞在 P7 和 P21 时产生了 Cx40 阳性的浦肯野纤维(少数)和 Cx40 阴性的工作心肌细胞(大部分)(图 6a-b)。 E14.5 的 Sema3a+细胞更局限于心室心肌的心内膜层,并在 P7 和 P21 时产生 Cx40 阳性的浦肯野纤维和 Cx40 阴性的工作心肌细胞(图 6c-d)。E18.5 开始诱导标记的 Sema3a+细胞在 P7 和 P21 天的心室心内膜下表面产生了几乎所有的 Cx40 阳性的浦肯野纤维,而 Cx40 阴性的工作心肌细胞则很少(图 6e-f)。这些数据表明,Sema3a+心肌细胞在围产期阶段(例如 E18.5 天)开始了其心室传导系统特化的命运(图 6 g)。

图 6. Sema3a+心肌细胞在心脏发育过程中的传导系统特化。(a-f)在 E12.5(a,b),E14.5(c,d)和 E18.5(e,f)对 Sema3a-CreERT2;R26-tdTomato; Cx40-GFP 三阳性小鼠给予他莫昔芬诱导。 每组在 P7 和 P21 收集心脏。Z-stack 共聚焦显示 Sema3a 与 Cx40 荧光表达情况。(g)示意图分别表示发育中和成年心脏中的 Sema3a +细胞(红色)和 Cx40 +细胞(绿色)。
Sema3a+心肌细胞的定量。
Sema3a+心肌细胞在心脏中到底占多大比例呢?通过将他莫昔芬注射到成年小鼠中体内诱导 Sema3a+标记,在他莫昔芬处理 48 小时后对心脏进行分析。 RFP 和 TNNI3 免疫荧光染色显示在心室心肌的心内膜下表面的 RFP+心肌细胞(图 7a)。对心脏切片中 RFP+心肌细胞比例进行定量分析,结果 1.02±0.13% 心肌细胞被 Sema3a-CreERT2 标记上红色荧光,而在他莫昔芬未处理的情况下几乎没有心肌细胞被标记上(图 7c)。将心肌细胞分离出来进行定量(图 7b,d)也得到了一致的结果。

图 7. 成年心脏中 Sema3a+心肌细胞数量的定量分析。(a)成年心脏中 RFP 和 TNNI3 的免疫荧光染色。 IVS,室间隔; RVW,右心室壁。(b)来自成年 Sema3a CreERT2; R26-tdtomato 小鼠的分离后心肌细胞。(c)定量心脏 RFP+心肌细胞的百分比。(d)定量分离后的 RFP+心肌细胞百分比。
Sema3a-CreERT2 作为一种全新的遗传工具小鼠,它特异性靶向成年小鼠心脏中的浦肯野纤维。它较 Hcn4-CreERT2(靶向窦房结、房室结、His 束、束支和浦肯野纤维)和 Cntn2-Cre(靶向 SA 结,AV 结和 His-Purkinje 系统) 对浦肯野纤维更具有针对性。与 Cx40-CreERT2 工具相比,Sema3a-CreERT2 也不会标记冠状动脉内皮细胞或心房心肌细胞。
对浦肯野纤维的谱系示踪结果表明,Sema3a+细胞在早期胚胎阶段主要向小梁心肌细胞发育,而在围产期期间,Sema3a+心肌细胞呈现特化为浦肯野纤维的命运。

文章来源南模生物,更多技术资料详见:http://c.biomart.cn/modelorg/animal