2 月 16 日(正月初一),Cancer Cell 发表了军事医学研究院生物工程研究所叶棋浓课题组的最新科研成果「Transcriptional Regulation of the Warburg Effect in Cancer by SIX1」,首次将 miR-548a-3p/SIX1 轴与 Warburg 效应和肿瘤生长联系起来,并阐明了相关作用机制。
本研究中 SIX1 基因敲除小鼠模型由上海南方模式生物构建。
Highlight
• SIX1 是新的 Warburg 效应的关键转录因子
• SIX1 通过 HBO1 和 AIB1 增强 Warburg 效应
• SIX1 糖酵解功能直接被 microRNA548a-3p 抑制
• miR-548a-3p / Six1 轴调节 Warburg 效应和肿瘤生长
研究背景
1956 年,德国生理学家 Warburg 发现了肿瘤细胞的一种异常代谢 [1]。
正常细胞中,葡萄糖会维持一个平衡状态,在缺氧状态时,葡萄糖会转变为丙酮酸进而转变为乳酸,当氧含量正常时,丙酮酸会进入线粒体,参与三羧酸循环并产生大量能量。
而在癌细胞或其他高度增殖的细胞类型中,即使在常氧环境下,也不利用线粒体氧化磷酸化产能,而是利用有氧糖酵解,在胞质中酵解形成大量乳酸,这就是「Warburg 效应」。
以有氧糖酵解的形式在肿瘤发生发展过程中起着重要作用,通过这种异常能量代谢,肿瘤细胞可以逃避正常的细胞凋亡程序,进行增殖和迁徙,因此 Warburg 效应是癌症的一个重要标志,人们正在致力于研发针对 Warburg 效应的抗肿瘤药物。
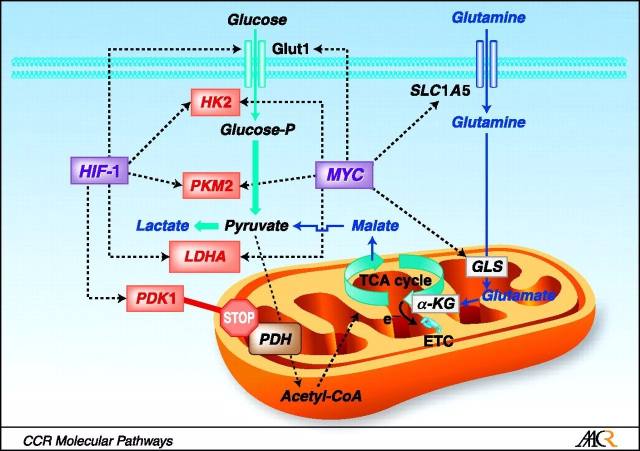
图 1. Myc 和 HIF-1 调节葡萄糖代谢并刺激 Warburg 效应 [2]。
已经发现转录因子 HIF-1a 和 c-Myc 是 Warburg 效应的关键调节因子。Myc 和 HIF-1 调节(上图虚线表示)参与葡萄糖代谢的基因(葡萄糖转运蛋白 Glut1,HK2,PKM2,LDHA 和 PDK1),有利于葡萄糖转化为乳酸(糖酵解)。Myc 也通过调节转运蛋白(SLC1A5)和谷氨酰胺酶(GLS)来刺激谷氨酰胺代谢。谷氨酰胺通过脱氨基作用变成α-酮戊二酸(α-KG),从而进入三羧酸循环,分解代谢成苹果酸,被转运到细胞质并转化为丙酮酸,然后转化为乳酸盐(谷氨酰胺分解)。 PDH,丙酮酸脱氢酶。
不过,目前只有为数不多的几个转录因子被报道参与了 Warburg 效应的调控,因此,人们对 Warburg 效应的转录调控机制仍知之甚少。
研究成果
• SIX1 是 Warburg 效应的关键转录因子
对 SIX1 稳定敲低(KD)的乳腺癌细胞系 ZR75-1 及对照细胞系进行转录组测序(RNA-seq)分析以及 Realtime RT-PCR 验证,发现 SIX1 敲低后一系列糖酵解通路相关基因的表达发生了改变;类似的,SIX1 敲除(KO)乳腺癌细胞系 ZR75-1 和 SIX1 KD 肝癌细胞系 HepG2 中糖酵解关键基因(GLUT1、HK2、PFKL、ALDOA、GAPDH、PGK1、ENO1、PKM2、LDHA)均显著下调;重新表达 SIX1 可以拯救这些变化。同样,在体内实验中,Six1 KO 小鼠的成纤维细胞(MEFs)、胚胎、肝脏、小肠、肺组织中也检测到相似结果(图 2)。提示了 SIX1 是调节糖酵解基因表达的关键因子。
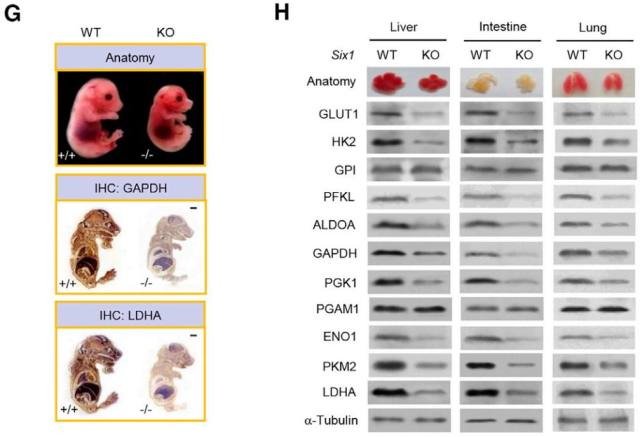
图 2. Six1 KO 小鼠胚胎及相关组织中糖酵解基因表达变化

Six1 KO 小鼠由上海南方模式生物利用 CRISPR/Cas9 技术构建
• SIX1 通过结合 SIX1 响应元件促进糖酵解基因表达
早前研究提示 SIX1 的 DNA 结合位点具有 TCAG/TG 特征序列,而且 SIX1 直接与 6 个糖酵解基因(PFKL, ALDOA, PGK1, ENO1, PKM2 和 LDHA)的启动子结合。因此,为研究 SIX1 如何调控糖酵解基因的转录,利用荧光素酶报告基因系统,将受调控的糖酵解基因启动子区域约 3 kb 的范围内含有 SIX1 结合位点的序列作为启动子,观察 SIX1 是否激活荧光素酶的表达(图 3A)。利用染色质免疫共沉淀(ChIP)也进一步证实了 SIX1 调控糖酵解基因的转录是通过结合于它们的启动子来实现的(图 3B)。

图 3. SIX1 通过结合于带有 SIX1 响应元件的启动子来促进糖酵解基因表达
• SIX1 促进糖酵解基因转录主要是通过 HBO1 和 AIB1 介导的组蛋白乙酰化
基因转录调控需要转录因子与组蛋白修饰酶的相互作用,而组蛋白乙酰化通常与转录激活相关。利用免疫共沉淀(CoIP)结合质谱法,筛选出两个与 SIX1 相互作用的组蛋白乙酰转移酶——HBO1 与 AIB1。利用 HBO1 和 AIB1 KO、KD 细胞系发现,HBO1 KO 或 KD 细胞系中 HK2, ALDOA, PGK1, ENO1 和 LDHA 基因表达下调;AIB1 KO 或 KD 细胞系中 GLUT1, PFKL, ENO1, PKM2, 和 LDHA 表达下调。重要的是,HBO1/AIB1 KO 或 KD 后,SIX1 对糖酵解基因的激活能力显著降低或消失了。说明 SIX1 调控糖酵解基因的表达需通过与 HBO1 和 AIB1 的相互作用实现(图 4A-D)。
那么 SIX1 是如何通过 HBO1 和 AIB1 调控糖酵解基因的呢。通过 ChIP 实验发现,SIX1 促进糖酵解基因的转录是通过 HBO1 介导的 H4K5 乙酰化和 AIB1 介导的 H3K4 乙酰化实现的(图 4 H)。
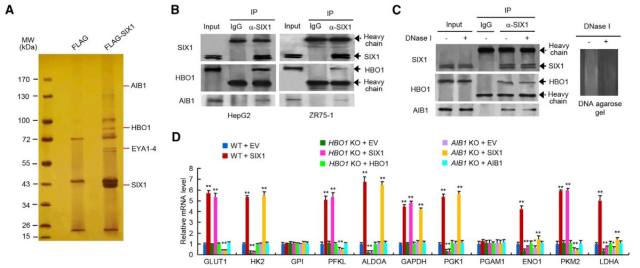
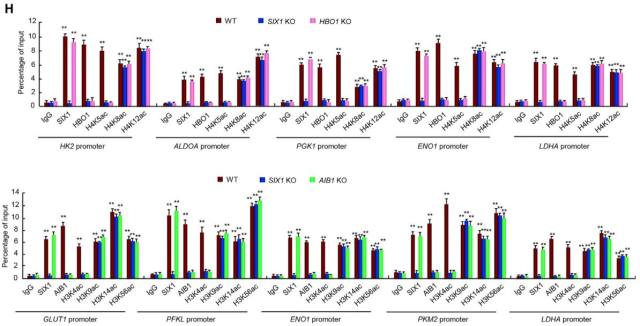
图 4. SIX1 促进糖酵解基因转录主要是通过 HBO1 和 AIB1 介导的组蛋白乙酰化
• SIX1 被 miR-548a-3p 抑制,从而下调糖酵解基因表达
接下来要寻找上游调控 SIX1 的 microRNAs。通过靶点预测,筛选到若干潜在的 SIX1 靶向 miRNAs,其中只有 miR-548a-3p 能够直接特异地抑制 SIX1 蛋白表达,并且降低受 SIX1 调控的糖酵解基因的表达。如果敲除 SIX1 基因,则 miR-548a-3p 对糖酵解基因的抑制作用也随之消失。说明 miR-548a-3p 通过 SIX 抑制糖酵解基因的表达(图 5)。
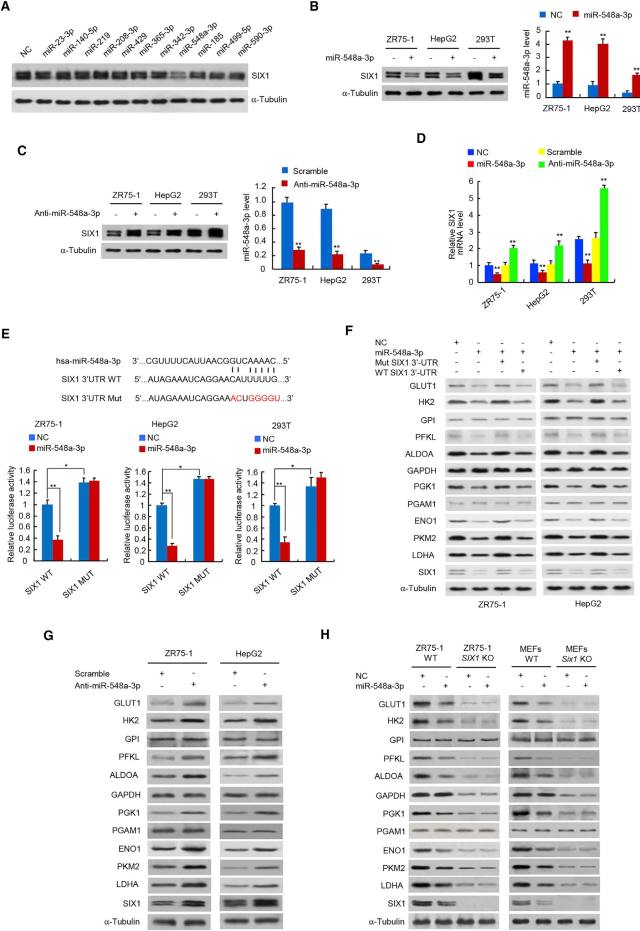
图 5. miR-548a-3p 通过 SIX 抑制糖酵解基因的表达
• 体外实验表明 miR-548a-3p/SIX1 轴调节有氧糖酵解,影响肿瘤细胞扩增
miR-548a-3p mimics 降低了肿瘤细胞的葡萄糖摄取、丙酮酸、乳酸及 ATP 水平、细胞外酸化率(ECAR)以及细胞有氧呼吸消耗速率(OCR)。SIX1 敲除后,细胞的这些糖酵解表型变化消失,说明 miR-548a-3p 通过 SIX1 基因行使抑制糖酵解表型的功能。HBO1/AIB1 KO 或 KD 后,SIX1 对这些糖酵解表型的调节功能受到严重影响,说明 SIX1 需要依靠 HBO1 和 AIB1 来发挥调节作用。(图 6A-L)
miR-548a-3p mimics 抑制了肿瘤细胞的增殖。糖酵解抑制剂(2-DG 和 3-BP)抑制了肿瘤细胞的增殖,降低了 anti-miR-548a-3p 和 SIX1 对肿瘤细胞增殖的促进作用。(图 6M-O)
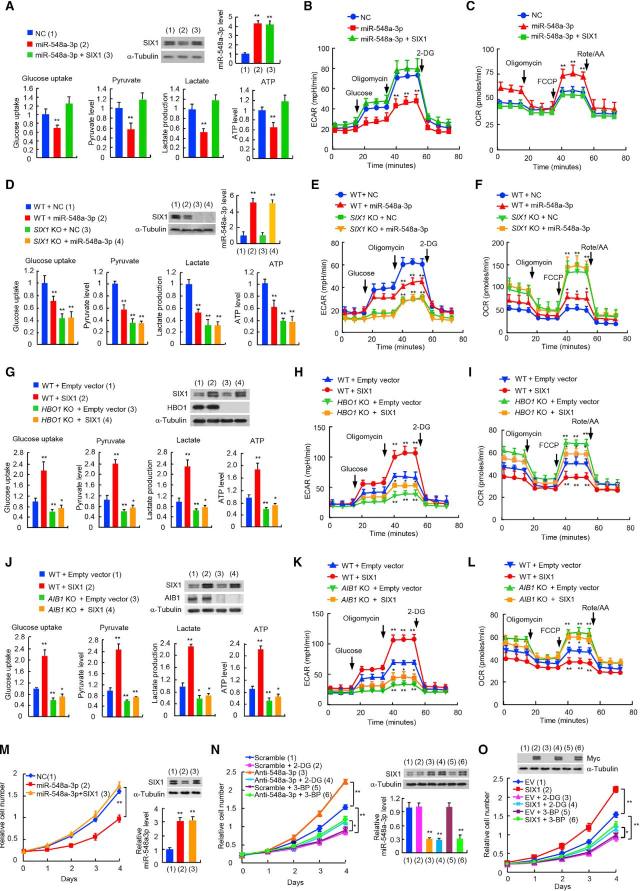
图 6. 体外实验表明 miR-548a-3p/SIX1 轴调节有氧糖酵解,影响肿瘤细胞扩增
• miR-548a-3p/SIX1 轴在体内同样调控有氧糖酵解及肿瘤细胞扩增
在裸鼠异种移植瘤模型中,利用 18FDG 标记的小动物 PET 技术检测肿瘤的糖摄取能力,发现 miR-548a-3p 通过 SIX1 调节糖摄取,而 SIX1 通过 HBO1 和 AIB1 发挥作用(图 7A-E)。通过糖酵解抑制剂 2-DG 或敲低 LDHA 糖酵解酶抑制糖酵解过程后,肿瘤生长和乳酸水平都显著受到抑制。更重要的是,糖酵解抑制剂 2-DG 或敲低 LDHA 糖酵解酶消除了 anti-miR-548a-3p 和 SIX1 对肿瘤生长及乳酸水平的刺激作用,说明 miR-548a-3p/SIX1 轴介导的糖酵解对于肿瘤细胞的生长非常关键(图 7F-I)。
在 Six1 基因敲除小鼠胚胎中糖摄取及乳酸水平均显著下降(图 7J)。而糖摄取增加的乳腺癌患者肿瘤样本中的 miR-548a-3p 表达下调,SIX1 表达上调(图 7K)。
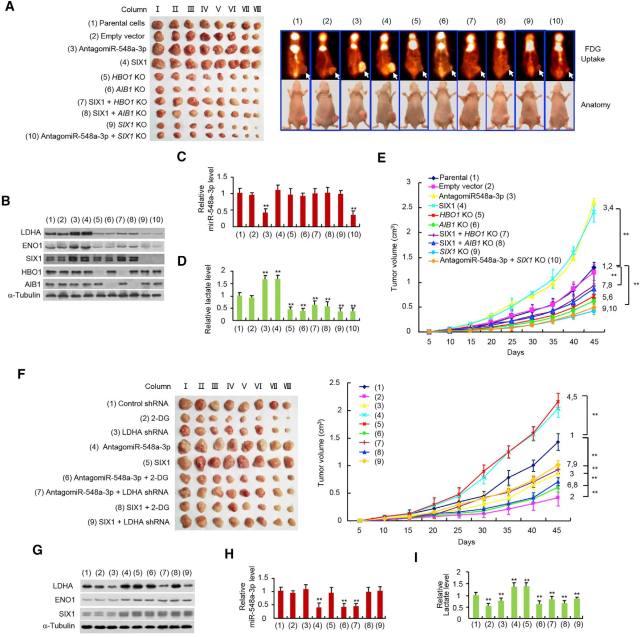
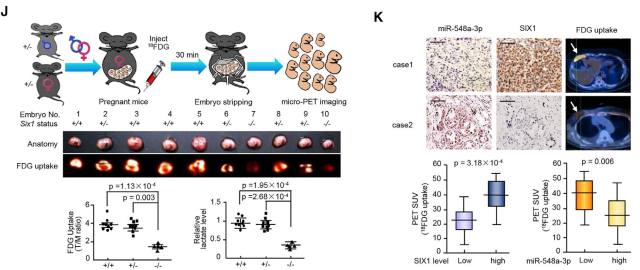
图 7. miR-548a-3p/SIX1 轴在体内同样调控有氧糖酵解及肿瘤细胞扩增
• 临床肿瘤相关 SIX1 基因突变会促进糖酵解基因表达、有氧糖酵解以及肿瘤生长
临床研究发现,在肿瘤中存在 SIX1 基因的 Q177R 突变。为研究该突变与糖酵解基因表达的关系,在 SIX1 基因敲除的肿瘤细胞系以及 Six1 基因敲除小鼠的 MEF 细胞中检测糖酵解基因的表达情况,发现相关糖酵解基因(HK2, GAPDH, PKM2 和 LDHA) 表达上调。利用 ChIP 实验证明 SIX1(Q177R)突变后,其被招募到 HK2 和 LDHA 基因启动子上的信号较野生型 SIX1 更强,对启动子的激活能力更强。(图 8A-E)
SIX1(Q177R)突变体在体外实验中增加了糖摄取、丙酮酸水平、乳酸产生以及 ATP 水平。SIX1 敲除的肿瘤细胞在导入 SIX1(Q177R)突变体后,与导入野生型 SIX1 相比,生长更为旺盛。SIX1(Q177R)突变后,HK2 和 LDHA 的表达水平也更高。(图 8F-J)
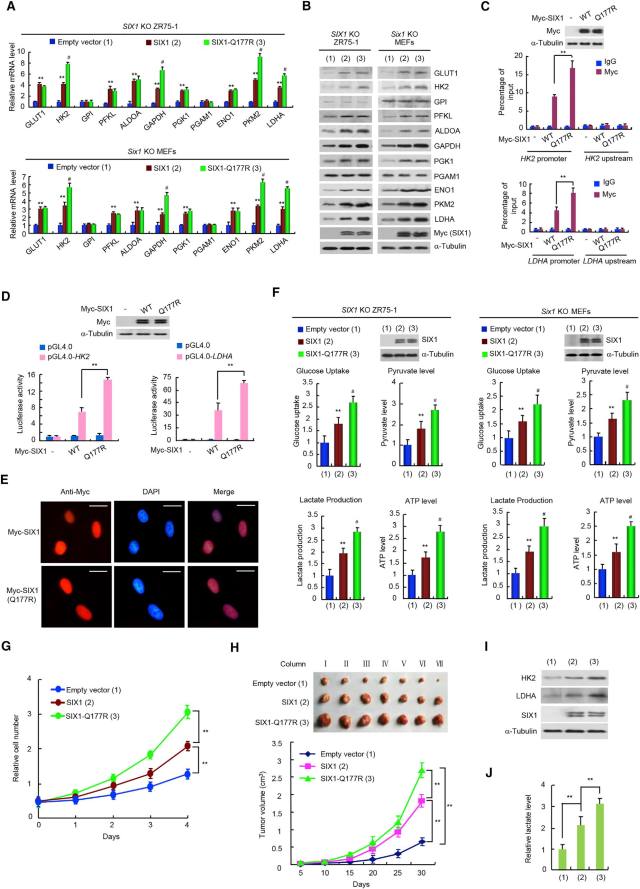
图 8. 临床肿瘤相关 SIX1 基因 Q177R 突变会促进糖酵解基因表达、有氧糖酵解以及肿瘤生长
• miR-548a-3p/SIX1 轴在乳腺癌中的临床相关性
对乳腺癌患者标本进行检测以及数据库分析发现,miR-548a-3p 表达与 SIX1 基因表达负相关、与 PGK1、LDHA 等糖酵解基因也成负相关,SIX1 与糖酵解基因表达成正相关(图 9A)。SIX1 被发现在多种肿瘤中有过表达,比如:超过 50% 的乳腺癌患者、超过 60% 的肝癌患者中 SIX1 高表达。但是 miR-548a-3p 表达在临床肿瘤中的情况尚不清楚。此研究发现乳腺癌肿瘤组织中 miR-548a-3p 是显著下调的,与肿瘤体积、淋巴结状态、肿瘤分级成负相关。另外,miR-548a-3p 表达高的患者预后比较好。(图 9B-C)
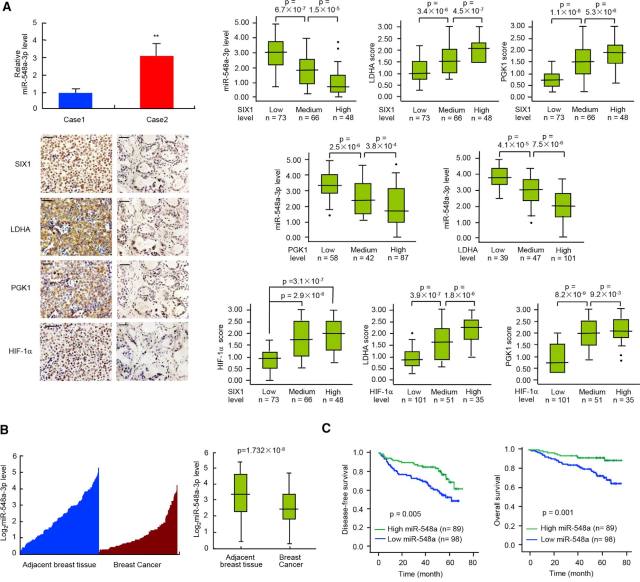
图 9. miR-548a-3p/SIX1 轴在乳腺癌中的临床相关性
• 总结
SIX1 是 Warburg 效应的关键转录因子。SIX1 通过与组蛋白乙酰转移酶 HBO1 和 AIB1 的相互作用激活糖酵解基因转录。 SIX1 直接被 miR-548a-3p 的抑制。 因此,miR-548a-3p / SIX1 轴将糖酵解基因表达与糖酵解和肿瘤生长联系起来。
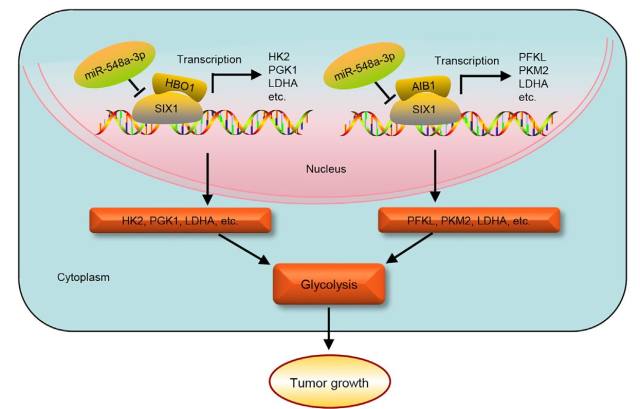
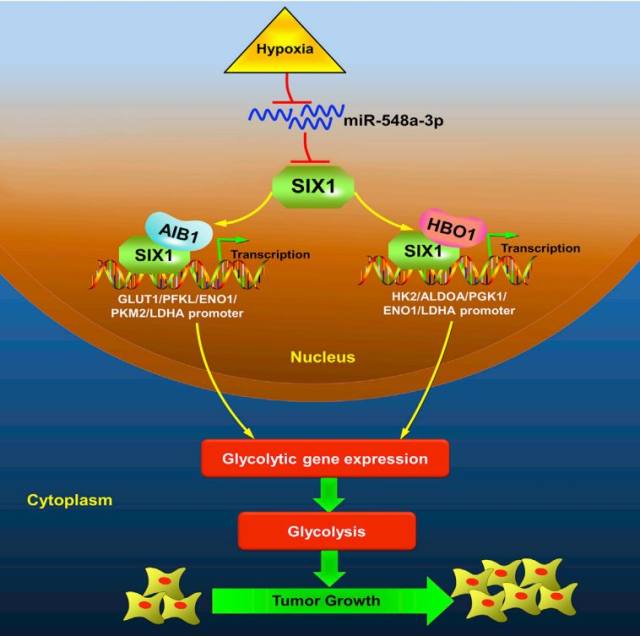
图 10. miR-548a-3p / SIX1 / HBO1 / AIB1 轴在肿瘤生长中的作用模式图
如封面示意图所示,在缺氧条件下,miR-548a-3p 表达被抑制,使下游靶基因 SIX1 活化,而 SIX1 通过与组蛋白乙酰转移酶 HBO1 和 AIB1 相互作用,激活一系列糖酵解基因表达,进而影响调控细胞糖酵解过程,最终促进细胞恶性转化及癌症发生。这一发现为新的抗肿瘤药物研发提供了新的靶点与思路。