癌症治疗最大的困难是什么?耐药!
在过去的数年中,人类投入了大量的人力、物力和财力用于和癌细胞的搏杀,我们对癌症的认识也有了长足的进步,一系列新的抗癌药物已经上市,新一代的免疫检查点抑制剂更是给许多晚期癌症患者带来了很大的希望,有些患者的癌症消失到了无法检测的程度。然而就在医生和患者欢呼雀跃的时候,新的数据给大家泼了一盆冷水:「神药」对有的患者并没有效果,甚至出现了肿瘤超进展的情况!
这就是人类和癌症做斗争中所面临的最残酷的现实和挑战:抗药性和变异性。以免疫检查点抑制剂为例,其耐药机制与免疫识别缺陷,对免疫效应分析的敏感性,肿瘤微环境和新生血管,肿瘤多能性和可塑性,肠道微生物以及染色质重塑复合物等相关。今天为大家阐述免疫识别缺陷中影响抗原呈递的两个重要因素:HLA 杂合性缺失与 B2M 缺陷。
1、HLA 杂合性缺失
人类白细胞抗原 (human leucocyte antigen,HLA) 是人类组织相容性复合体(MHC)的表达产物,肿瘤细胞表面上也存在 HLA,参与抗原的处理和呈递。HLA 对 CD8+ T Cell 识别肿瘤细胞必不可少。人体大部分细胞含有两套 HLA 分子编码基因:一套基因遗传自母亲,另一套基因遗传自父亲。有时,基因变化能够导致一套基因全部或部分丢失,称为杂合子缺失(LOH)。当 HLA 位点发生 LOH,有可能促进免疫逃避,从而导致免疫治疗耐药(图 1)。

图 1 癌细胞表面杂合性缺失导致免疫逃逸
2017 年 11 月,《Cell》杂志发表的一篇文章:Allele-Specific HLA Loss and Immune Escape in Lung Cancer Evolution1。文章中作者及其团队开发了一款从测序数据中确定 HLA 等位基因特定拷贝数的软件,叫做 LOHHLA,并对 90 位非小细胞肺癌患者进行了 HLA LOH 鉴定,发现 40% 的患者具有 HLA 杂合性缺失。杂合性缺失在非小细胞肺癌里面呈现正向选择(图 2),这些数据显示了 HLA LOH 在肺癌进化过程中是一种常见的免疫逃避机制。
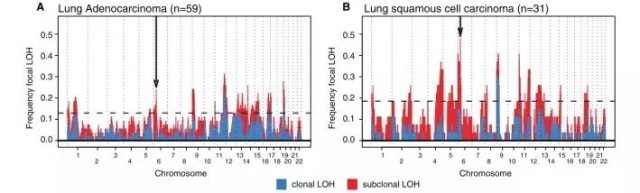
图 2 LOH 在非小细胞肺癌里面呈现正向选择
紧接着,2017 年 12 月,《Science》杂志发表的一篇文章:Patient HLA class I genotype influences cancer response to checkpoint blockade immunotherapy2。 CD8+ T 细胞杀死癌细胞,需要通过 HLA-I 型分子有效地呈递肿瘤抗原。然而,针对特定患者的 HLA-I 基因型对抗 PD-1/CTLA-4 响应的程度目前还不清楚。
为了阐明 HLA-I 基因型与免疫检查点抑制剂疗效之间的关系,作者分析了 1535 名接受免疫检查点抑制剂的晚期癌症患者的 HLA-I 基因型。将所有的患者分成了两组,Cohort1:有 269 位晚期黑色素瘤患者和 100 位晚期非小细胞肺癌患者接受 anti-CTLA-4 或者 anti-PD -1 治疗;Cohort2:有 1166 位不同晚期肿瘤类型的患者,接受 anti-CTLA-4,或 anti-PD-1/PD-L1,或者是两者联合治疗。杂合型 HLA-I 可以提高患者的 OS(图 3)。
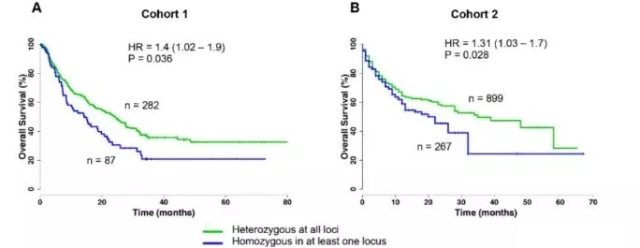
图 3 杂合型 HLA-I 可以提高患者的 OS
作者在研究过程中思考,既然如此,是否有更大的多样性 (杂合性) 可以在免疫检查点抑制剂治疗过程中获得更好的生存期呢?作者将黑色素瘤的 27 个 HLA-A 等位基因划分为 6 个超亚型,50 个 HLA-B 等位基因划分为 6 个超亚型。其中,使用 anti-PD-1 或 anti-CTLA-4 治疗的黑色素瘤患者有 HLA-B44 超亚型的整体存活率显著提高(图 4)。
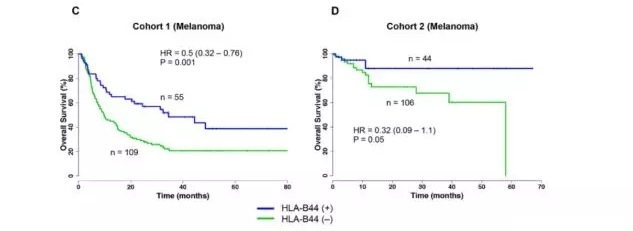
图 4 有 HLA-B44 超级型的黑色素瘤患者整体存活率显著提高
相反,具有 HLA-B62(HLA-B*15:01)超级型的患者与更差的预后相关(图 5)。这项研究结果显示,HLA-I 基因型会影响使用免疫检查点抑制剂患者的生存期。表明可以在未来临床试验的设计中考虑这个因素。
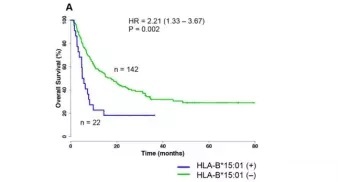
图 5 HLA-B62 超级型患者 OS 较差
2、B2M 缺陷
大量的证据已经表明 B2M 基因缺陷会影响 MHC I 的正常折叠和运输到细胞表面(图 6),从而产生对免疫检查点抑制剂的耐药。
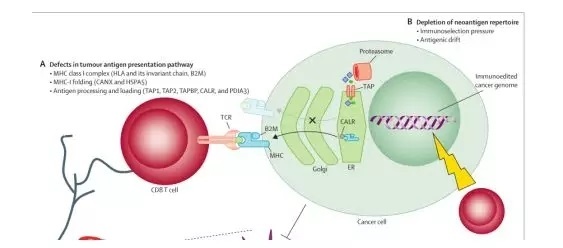
图 6 B2M 是 MHC 折叠和运送到细胞表面的关键基因
2016 年 9 月,《NEJM》发表的:Mutations Associated with Acquired Resistance to PD-1 Blockade in Melanoma3,文中提到 B2M 的截断突变导致了 MHC I 的细胞表面表达的丢失。其中一名 B2M 突变的患者的肿瘤细胞进行 MHC I 型免疫组织化学染色,显示出 B2M 突变的患者肿瘤细胞的外细胞膜缺乏 MHC I 型(图 7)。
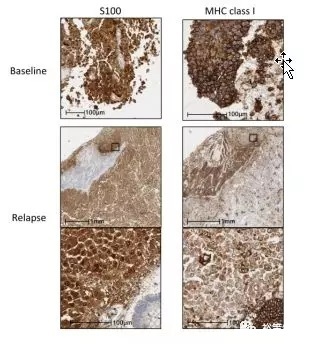
图 7 B2M 突变患者的肿瘤细胞的外细胞膜缺乏 MHC I 型
2017 年 3 月,《Science》发表的:Integrated molecular analysis of tumor biopsies on sequential CTLA-4 and PD-1 blockade reveals markers of response and resistance4,免疫检查点抑制剂对许多患者产生了临床效益。然而,仍需要更好的生物标记来反应治疗效果,而耐药性机制仍未完全被理解。
为了解决这个问题,作者最近研究了一组接受了 CTLA-4 抑制剂治疗,进展后接受 PD-1 抑制剂治疗的黑素瘤患者,并识别出反应和耐药的生物标记。在对包括 INF-γ通路的相关基因,HLA 突变,肿瘤突变负荷(TMB)等因素进行研究后,并没有发现获益人群和非获益人群之间有统计上的显著差异。进一步对 CNAs(copy number alterations)的分析发现,对 CTLA-4 和 PD-1 抑制剂治疗无效者的拷贝数丢失程度更高,这与免疫相关途径的基因表达减少有关。需要同时评估突变负荷和拷贝数丢失情况,才能较好地解释治疗应答的情况,这表明一个组合生物标记对免疫检查点抑制剂治疗优化的潜在效用。其中也发现有 4 名非应答的患者,存在 B2M 的缺失。
总的来说,HLA 的杂合性缺失以及 B2M 的突变是目前研究的较多的影响抗原呈递,从而引起免疫治疗原发性或者获得性耐药的机制。所以在检测免疫治疗敏感标志物的同时检测可能的耐药突变,对于精确筛选免疫治疗的获益人群也是十分重要的。
当然,除了 HLA 杂合性缺失以及 B2M 的突变外,抗原本身以及 T 细胞的状态也是影响抗原呈递的重要因素,下一期我们会一一探讨为什么免疫治疗过程中有敏感标志物,却对免疫治疗无效的各种可能因素。
参考文献:
(1) Mcgranahan N, Rosenthal R, Hiley C T, et al. Allele-Specific HLA Loss and Immune Escape in Lung Cancer Evolution[J]. Cell, 2017, 171(6):1259.
(2) Diego Chowell, Luc G.T. Morris, Claud M. Grigg et al. Patient HLA class I genotype influences cancer response to checkpoint blockade immunotherapy. Science, Published online:07 Dec 2017.
(3) Zaretsky J M, Garciadiaz A, Shin D S, et al. Mutations Associated with Acquired Resistance to PD-1 Blockade in Melanoma.[J]. New England Journal of Medicine, 2016, 375(9):819.
(4) Roh W, Chen P L, Reuben A, et al. Integrated molecular analysis of tumor biopsies on sequential CTLA-4 and PD-1 blockade reveals markers of response and resistance[J]. Science Translational Medicine, 2017, 9(379).