肿瘤是人类健康的头号杀手,肿瘤免疫治疗具有独特的疗效和多癌种适应性,有别于放化疗、靶向治疗等手段,免疫治疗一旦起效,可诱导产生持久的临床反应,具有不可比拟的优势。未来已来,肿瘤治疗已经进入了免疫治疗时代。3 月 15 日-17 日由 CSCO、CSCO 免疫治疗专委会主办「CSCO 第二届全国肿瘤免疫治疗高峰论坛」在重庆召开,作为开年最重要的肿瘤免疫治疗大事件,大会提出,2018 年肿瘤免疫治疗药物即将在国内陆续上市,中国迎来了「肿瘤免疫治疗的元年」,这对免疫治疗的诊断、治疗、副作用管理等方面的规范,尤其是如何筛选潜在获益的患者,提出了更高的要求。大会主席王宝成教授指出,免疫治疗不仅颠覆了肿瘤治疗的理念,更有望从根本上真正治愈肿瘤,临床医师需要不断学习,与时俱进地掌握应用要点。
肿瘤免疫治疗三驾马车:免疫检查点抑制剂、过继细胞治疗、肿瘤疫苗
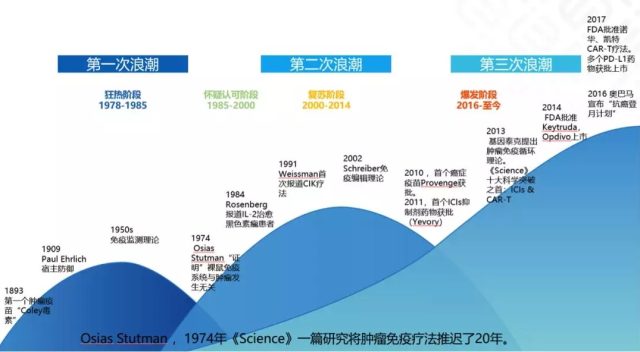
虽然免疫治疗的概念产生了近百年,但真正扭转「理论很丰满、现实很骨感」这一状况,成功开始进入临床应用还是在最近几年,免疫治疗正向着精准、联合、多样化的方向发展。马军教授指出,免疫治疗的这三大策略在 2018 年度都取得了显著进步。
免疫检查点抑制剂是通过抑制肿瘤细胞的免疫逃逸,调动自身免疫系统来消除肿瘤,代表为 CTLA-4/PD-1/PD-L1 单抗。免疫检查点抑制剂治疗(简称 I-O 免疫治疗)是目前研究最为充分的一种免疫治疗手段。目前国内已有 19 家 PD-1/PD-L1 抗体研发企业进入临床试验阶段,已有 6 种免疫检查点抑制剂,在肺癌、肝癌、胃癌等 10 个领域获得 FDA 批准上市。秦叔逵教授预计今年下半年进口或国产 PD-1/PD-L1 抗体会在国内陆续上市,首先获批在霍奇金淋巴瘤或黑色素瘤领域。周彩存教授指出,I-O 免疫治疗已成为 NSCLC(非小细胞肺癌)二线治疗新标准。郭军教授指出,免疫治疗的 leading tumor-黑色素瘤,已经经过了单药到联合治疗,再到姑息治疗的进展过程。
过继细胞治疗是通过体外激活和扩增肿瘤特异或非特异性杀伤细胞,然后回输至患者体内,以激活患者自身 T 细胞来杀死肿瘤,代表为 CAR-T/TCR-T。携带肿瘤特异性抗原(肿瘤新生抗原/neoantigen)的过继性细胞,能够特异性的激活携带 neoantigen 的 T 细胞,以针对性的杀死肿瘤细胞,避免出现杀敌一千自损八百的情况。目前,中国的 CAR-T 疗法临床试验数量已经超过了美国,CAR-T 疗法最敏感的是血液癌症,而对实体瘤的治疗较为薄弱,CAR-T 对抗实体瘤需要解决的难题有抗原异质性、难以透过基质和免疫微环境等问题。
个性化肿瘤疫苗是通过将肿瘤相关抗原或肿瘤特异性抗原(neoantigen)的肽段或 RNA 注入患者体内,来激活患者的免疫系统,个性化肿瘤疫苗技术的突破,关键在于 neoantigen 的检测及预测技术的发展,以制备 neoantigen 疫苗。
另外,免疫治疗联合放化疗、靶向治疗、其他免疫治疗的研究如火如荼,但试验结果千差万别,biomarker 如何选择已成为未来联合治疗的重要方向。以泌尿系统肿瘤为例,聂勇战教授指出,尿路上皮癌/肾癌等肿瘤的免疫治疗呈现出,从二线治疗向一线治疗挺进,从晚期系统治疗逐步向早期疾病阶段前移,从单药治疗到多种联合治疗的趋势。联合治疗的最终落脚点为肿瘤新生抗原(neoantigen),联合治疗的策略就是把冷肿瘤变为热肿瘤。
Biomarker 是精准免疫治疗的基础
CFDA 即将批准 PD-1 抑制剂上市,我们怎么选择病人?
免疫检查点抑制剂治疗(I-O 免疫治疗)被誉为是抗癌抗生素,对多种癌症有着很好的治疗效果。但是 I-O 免疫治疗用药同时还面临这一些挑战,比较突出的是有效率低(只有 20-30% 的患者获益)、起效慢、费用昂贵。治疗过程中还会面临耐药和超进展,以及假性进展的风险。此外,由于治疗过程中释放了更强的免疫响应,其毒副作用管理也是值得注意的问题。精准诊断在于优化患者选择,免疫检查点抑制剂马上将在国内上市,通过合理的 biomarker 筛选获益人群、预测治疗有效性迫在眉睫。目前明确的三大 biomarker 为 PD-L1 的表达、微卫星不稳定性(MSI)、肿瘤突变负荷(TMB)。
PD-L1 表达是目前应用最广泛的 biomarker,也是目前唯一有循证医学的 biomarker(褚倩教授指出);多个临床试验(如 keynote-024),多项分析指标(ORR、PFS、OS)提示 PD-L1 表达能够预测 I-O 免疫疗效,FDA 已批准 PD-L1 表达作为 I-O 免疫治疗的伴随诊断。PD-L1 高表达,ORR 更高。但是,束永前教授指出,在肺癌中仍有 5-10%PD-L1 阴性的获益患者,在肺癌的二线治疗中,除 Pembrolizumab 单抗外,Nivolumab 和 Atezolizumab 都不考虑 PD-L1 的表达水平,尿路上皮癌的二线治疗中 PD-L1 的高表达,ORR 更高,但是针对一线治疗的 IMVigor II 试验显示 ORR 与 PD-L1 的表达并无直接关系,在其他癌种如胃癌肝癌中也出现了类似的现象。总体 PD-L1 阳性 ORR 高于阴性,总体敏感性为 72%,也就说另有 28%PD-L1 阴性的患者也有临床获益。PD-L1 的表达受多种机制的调控、肿瘤时空异质性、检测标准不统一、缺乏中国数据等因素影响,导致 PD-L1 的表达作为单一 biomarker 远远不够,周彩存教授指出,我们迫切需要寻找可以预测免疫治疗疗效的更好的 biomarker。
MSI 是 FDA 已批准的另一个免疫治疗 biomarker。FDA 批准 Pembrolizumab 用于 dMMR/MSI-H 型的转移性实体瘤,Nivolumab 用于 dMMR/MSI-H 的转移性结直肠癌。Science 发表了 NCT01876511 的临床研究结果显示,Pembrolizumab 用于治疗 MSI-H 的晚期肿瘤患者,MSI-H 型肿瘤患者 ORR 高达 54%。2017 年 11 月,FDA 连续批准了 2 个基于 NGS 技术的大 panel 用于 MSI 检测,这意味着 NGS 大 panel 作为伴随诊断是趋势,NGS 检测 MSI 结果非常准确,宋勇教授指出。基于 10 万肿瘤患者数据发现,83% 的 MSI-H 型患者属于 TMB-H 的,但 TMB-H 的患者只有 16% 是 MSI-H 的,表明单独检测 MSI 会使部分 TMB-H 的患者失去治疗机会,我们需要更多的 biomarker。
TMB 是更广谱的免疫治疗 biomarker,已从临床研究热点正逐步走向临床应用。TMB 越高(TMB-H),肿瘤产生的 neoantigen 越多,肿瘤免疫原性越强,越适合 I-O 免疫治疗。CheckMate-026、 CheckMate-227 等多项大型临床试验已证实 TMB 临床应用价值,I-O 免疫治疗的 ORR(客观缓解率)与 TMB 呈正相关。束永前教授、宋勇教授都指出 TMB 越高,临床获益越多,各种肿瘤(肺癌、黑色素瘤、泌尿系统肿瘤等)趋于一致。郭军教授指出,中国的黑色素瘤亚型免疫原性低于国外的患者,原因在于中国亚型的患者 TMB 值低,而 TMB 低代表了免疫治疗总体有效率低。
然而,TMB 也有缺陷。周彩存教授指出,TMB 的检测远比想象的复杂,基因突变有点突变、插入缺失突变、拷贝数变异等,显然不同种类突变的预测意义是不一样的,插入/缺失突变产生新生抗原的机会可能更大,不同种类突变的权重需要专业的检测公司来评价。例如肾癌的抗 PD-1/PD-L1 疗效,无法简单通过 TMB 预测,原因可能是插入/缺失突变导致的 neoantigen 更多,而实际其 TMB 的权重可能没有那么高。全外显子检测 TMB 存在检测周期长,经济成本高等缺点,Foundation medicine 的大 panel(315 个基因)、MSKCC 的大 panel(341 基因)、裕策生物的大 panel(811 基因)检测结果与 WES 相关性都非常好。Panel 做的足够大设计的又合理,可以取代 WES,NGS 大 panel 作为伴随诊断是大趋势。单纯地 TMB 并不能解决所有的问题,例如对于炎性肿瘤和非炎性肿瘤都有 TMB 值高的情况,但是非炎性肿瘤的免疫治疗效果却并不好,况且 TMB 的 cutoff 值与 PD-L1 表达一样,并没有统一标准。宋勇教授指出 PD-L1 表达与 TMB 弱相关,即高 TMB 与高 PD-L1 表达不是同一人群,我们需要更多 Biomarker。
除了上述三种明确的 biomarker 外,免疫检查点抑制剂疗效与 HLA 突变或杂合子缺失、JAK1/2 基因突变、B2M 突变等耐药标志物呈显著负相关关系。高志博博士指出,HLA LOH(杂合性缺失)与 PD-1/PD-L1 疗效密切相关,例如肺腺癌免疫治疗的有效响应率往往高于肺鳞癌,这可能是因为 HLA 的杂合性缺失在肺腺癌中发生率低于肺鳞癌(20% vs 50%),HLA 杂合性缺失影响了 neoantigen 的递呈,成为免疫耐药的重要影响因素。另外 MDM2/4 基因扩增、DNMT3A 基因突变与 I-O 免疫治疗独有的副作用超进展有关。
Neoantigen——更直接更有潜力的 Biomarker
肿瘤新生抗原(neoantigen)是基因组与肿瘤免疫治疗结合点,免疫治疗疗效敏感的多种 biomarker(TMB、MSI、HLA 等)的研究,最终都能归结到寻找高质量的 neoantigen。
I-O 免疫治疗的基础是肿瘤的免疫原性,neoantigen 是只在肿瘤细胞中特异性表达的蛋白,能被免疫系统 T 细胞识别,是肿瘤免疫治疗的理想靶标。 Neoantigen 越多,免疫原性越强,I-O 免疫治疗效果越好。张力教授指出,neoantigen 的研究是中国免疫治疗的重要机遇之一。在国内,有这样一家公司-裕策生物,不但是国内首个参与国际肿瘤新生抗原筛查联盟(TESLA)的单位,还是唯一参与国际新生抗原预测验证的机构。研究表明,TMB 与免疫药物疗效具有相关性的本质,是因为突变导致了 neoantigen 的产生, TMB 越高,产生的 neoantigen 越多,即肿瘤新生抗原负荷(TNB)越高; dMMR(错配修复缺陷)会导致基因修复出现问题,从而编码出更多的 neoantigen,TNB 也越高;HLA 杂合性缺失的出现则影响了 neoantigen 递呈到肿瘤细胞表面(TNB 变低),降低了肿瘤细胞被 T 细胞识别的概率,进而负向调节了免疫治疗效果。临床数据表明,对 Pembrolizumab 有持续获益的 NSCLC 患者 TNB 的水平明显高于无持续响应的患者,并且 TNB 高的患者的 PFS 显著延长(中位 PFS14.3 个月 vs 3.5 个月)。高志博博士指出,TNB 与免疫检查点抑制剂疗效直接相关。Science 发表的一篇回顾性研究表明,I-O 免疫治疗对高 TNB 患者表现出高缓解率,提示 TNB 是预测 I-O 免疫治疗的良好的 biomarker,在本次会议中,多位教授对此也表示了肯定。Neoantigen 的准确预测是免疫治疗最主要的挑战,生物信息算法是其中的核心。张毅教授指出,目前国内 neoantigen 的预测存在很多难题,预测哪些癌症突变会产生能被免疫系统识别的新生抗原,每个实验室都有一套自己的算法和流程,标准不统一,且数据分析复杂,其中涉及基因数据预处理,突变检测,HLA 分型鉴定,表达定量,neo-peptide 预测,蛋白裂解,TAP 转运,MHC 亲和力预测,克隆状态分析以及新抗原筛选等。Neoantigen 的筛选、验证、临床试验及拓展研究是一个系统工程,需要形成联盟,合力解决这一难题,天梯计划就是目前国内较为典型的联盟,周彩存教授在接受采访时对天梯计划表示了高度认可和良好祝愿。
Biomarker 未来的方向——多个指标综合评估
Biomarker 是精准免疫治疗的基础,单一 Biomarker 无法解决全部问题。高志博博士等多位专家都指出,多种生物标记物的组合可能为治疗结果提供更强的预测价值。实际上已经有很多研究证实了这一点,Checkmate-026 提示高 TMB 同时 PD-L1≥50%(ORR 为 75%),相比单一 PD-L1≥50%(ORR 为 45.6%),获益增加;TMB & HLA 比 TMB 单用效果更好,这一结果发表在今年 2 月份 science(Science. 2018 Feb 2;359(6375):582-587)上。那么,是否有一个全面的 biomarker 检测方案?该方案能否准确检测 TMB?该方案能否有效检测 HLA、Neoantigen、TNB?拿到多种 biomarker,该怎么用于临床指导?
YuceOne® ICIs 正是这样一款大 panel,YuceOne® ICIs 是国内首个基于多项指标专为 PD-1/PD-L1 抗体疗效评估开发的检测产品。依据肿瘤免疫循环理论,严格筛选出 10 个用药敏感和用药风险 biomarker,从疗效预测、耐药性预测和超进展预测等多个角度和环节综合评估患者的肿瘤细胞和自身免疫系统,克服单一指标评估不全面的缺陷,准确预测患者获益潜力。