
图 1 封面图片
阿尔茨海默病(Alzheimer’s disorder, AD)是一种中枢神经系统原发性退行性疾病,全世界约有 4600 万人患有痴呆症,大多数为 60 岁以上人群, 这一数字到 2050 年预计将增加至 1 亿 3150 万。统计数据显示该领域药物研究临床失败率高达 99.6%。因此,临床上急需新的疗法来治疗 AD。应用脑深部电刺激治疗 AD 的靶点目前有 2 个,分别是穹隆和 Meynert 基底核。本期介绍加拿大多伦多大学的神经外科医生 Andres Lozano 团队应用脑深部电刺激穹隆(deep brain stimulation fornix, DBS-f)治疗轻度 AD 的Ⅰ期和Ⅱ期临床试验。研究结果表明脑深部电刺激穹隆能够逆转轻度 AD 患者记忆功能衰退,增强大脑内葡萄糖代谢,且安全性、耐受性良好。
发现——DBS-f 改善记忆功能
2008 年,加拿大多伦多大学神经外科医生 Andres Lozano 在给一例 50 岁、体重 190 公斤受试者进行 DBS 减肥手术时发现,当电极植入大脑视丘下部(hypothalamus)进行刺激时,患者称有强烈的「似曾相识」感,即回忆起了 30 年前与朋友们在公园里相聚的一个愉快经历,电流加强时,受试者能回忆起更多的细节。Lozano 认为出现这种结果是由刺激穹隆而激活海马记忆环路引起的 [1]。观察动物实验和人类穹隆病变产生记忆缺失的研究发现,穹隆在记忆功能中发挥重要作用 [2]。因此,这一意外的发现为改善 AD 患者的记忆功能带来了希望 [1]。
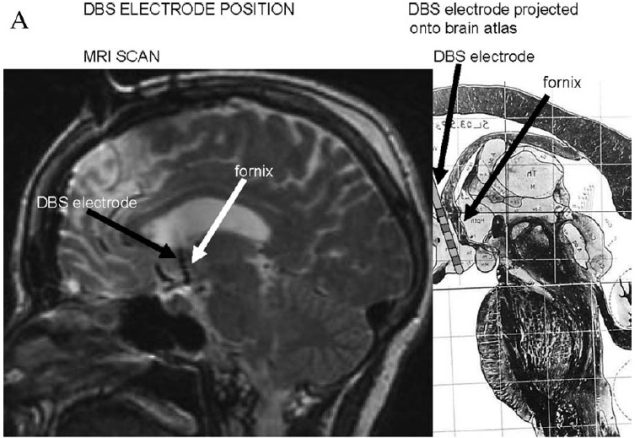
图 2 DBS 植入穹隆 [2]
Ⅰ期临床试验--减缓认知功能衰退,逆转葡萄糖代谢损伤
2010 年,DBS-f 治疗 AD 的 I 期(NCT00658125)临床试验研究结果发表在《ANNALS of Neurology》上。Ⅰ期临床试验持续 3 年左右。
文章报道了 6 例轻度 AD 患者在接受药物治疗的同时,接受为期 12 个月的 DBS 持续刺激。结果显示,DBS 驱动神经元在记忆环路中的活动,包括内嗅皮层和海马区域,以及激活大脑默认的模式网络。PET 扫描显示,DBS 刺激在早期就能逆转颞叶和顶叶的葡萄糖利用损伤,且在连续 12 个月的刺激后,这种逆转作用仍能维持。 AD 认知评估量表(DAS)、简易精神状态评估量表(MMSE)评估显示,部分患者在 6 个月和 12 个月时出现症状改善,且认知功能降低変缓。研究过程中未出现严重不良事件。因此,应用 DBS 调节 AD 患者病理性大脑活动值得进一步研究 [2]。
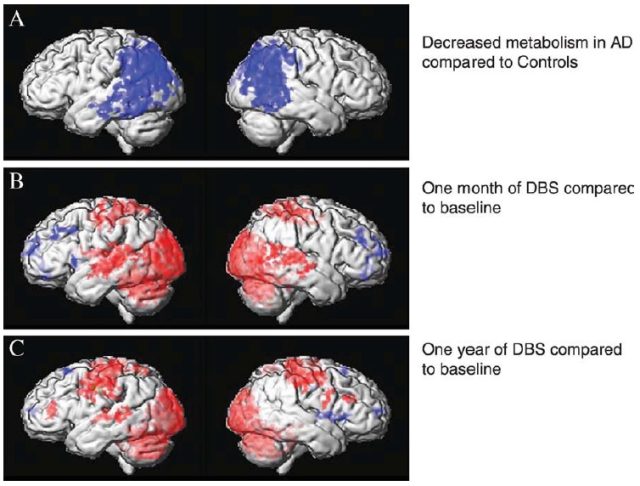
图 3 PET 扫描糖代谢,蓝色表示糖代谢减少,红色表示糖代谢增加 [2]
安全性——DBS-f 准确,安全,耐受性良好
2015 年,ADvance Study 研究团队在《J Neurosurg》发表了 Advance 临床试验——双侧 DBS-f 治疗 AD 手术安全性的文章。Advance Study <http://www.advancestudy4ad.com/> 是一项双盲、随机对照研究,7 个中心共同参与,用来评价 DBS-f 治疗轻度 AD 患者的安全性、有效性及耐受性。2012 年至 2014 年,共 42 例轻度 AD 患者接受了双侧 DBS-f 治疗。术后 MRI 扫描显示,电极与目标靶点间的平均误差为 1.5±1.0mm。患者平均住院时间为 1.4±0.8 天。26 例(61.9%)患者发生 64 起与手术相关的不良事件,其中 5 例(11.9%)发生 7 起较为严重的不良事件。严重不良事件包括:1 例患者出现两次严重的头痛、恶心、呕吐,导致住院时间延长;1 例因 IPG 感染接受口服抗生素治疗;2 例因严重感染而导致 IPG 外置;1 例因电极位置偏差而重新调整,1 例并发慢性硬膜下血肿。无患者出现神经功能障碍,也未发生病例死亡事件 [3]。
此研究表明在治疗中心,外科医生能够准确将 DBS 植入穹隆。且术后 90 天内,双侧 DBS-f 治疗轻度 AD 的患者耐受性良好 [3]。
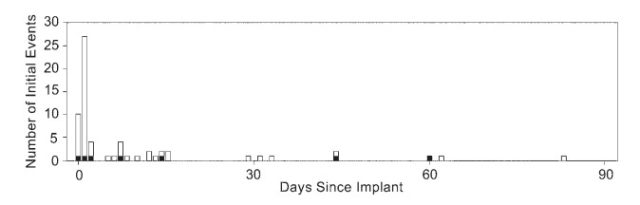
图 4 按时间顺序排列 Advance 临床试验发生的不良事件,黑色表示严重不良事件
Ⅱ期临床试验——DBS-f 安全有效,减缓认知功能下降,增加大脑葡萄糖代谢
2016 年,DBS-f 治疗轻度 AD 的Ⅱ期(NCT01608061)临床试验研究结果已在《Journal of Alzheimer’s Disease》发表。Ⅰ期临床试验已证明 DBS 能够调节功能异常的大脑环路活动,Ⅱ期临床试验主要研究 DBS 治疗 AD 的安全性和有效性。

图 5 ADvance Study 主要研究通过手术植入设备向大脑特定区域提供微弱的电脉冲治疗 AD
对 42 例轻度 AD 患者行双侧 DBS 手术,植入靶点为穹隆,随机双盲情况下,比较 12 个月内 DBS 开机和关机状态下的认知功能和大脑内葡萄糖代谢。
结果显示,手术和电刺激显示安全性和耐受性良好。在开机组和关机组,12 月内的初级认知结果(Alzheimer’s Disease Assessment Scale-13, ADAS-Cog 13; Clinical Dementia Ratings, CDR) 未出现显著性差异。AD 患者接受刺激 6 个月时显示葡萄糖代谢显著性增加,但 12 个月时这种显著性未出现。事后分析显示,年龄与治疗结果存在显著相关性,患者年龄<65 岁(n = 12)时,DBS-f 开期的结果比关期的结果更差;患者年龄 ≥ 65 岁(n = 30)时,DBS-f 治疗与较好的临床结果及大脑葡萄糖代谢增加都有关。
综上,Ⅱ期临床试验证明了 DBS 治疗 AD 的安全性,且 DBS-f 能增加大脑葡萄糖代谢 [4]。对于超过 65 岁的患者,DBS-f 治疗一年后,认知功能下降减缓。这些研究结果为继续进行Ⅲ期临床试验--DBS-f 治疗老年 AD 患者的研究,进行进一步评价及其样本量估计提供了支持 [4]。
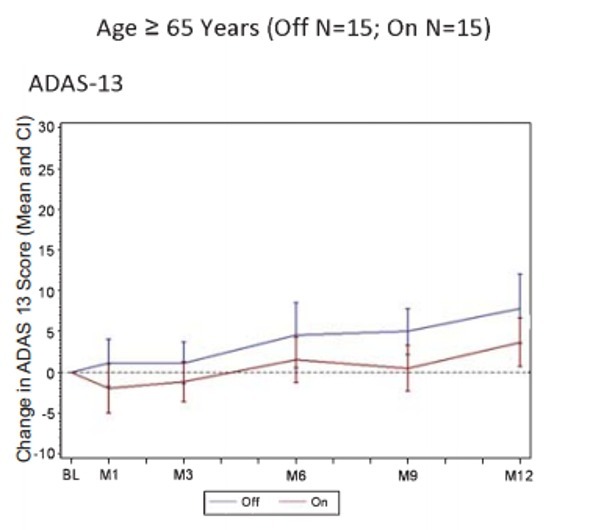
图 6 受试者一年临床疗效随访结果:横坐标为月份,纵坐标为 ADAS-Cog 13 评分,评分在 0 轴以上表示疗效恶化,0 轴以下表示疗效改善,年龄和评分相关,大于等于 65 的患者开机效果好于关机 [4]。
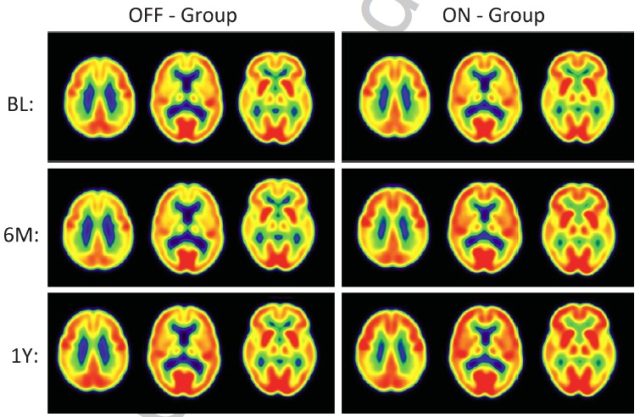
图 7 受试者脑部葡萄糖代谢 PET 影响,BL 表示基线,6M 表示 6 个月,1Y 表示 1 年,从图上可以看到「关机组」受试者的脑部葡萄糖代谢情况基本稳定或略有下降,而「开机组」受试者脑部的葡萄糖代谢活动明显增强,尤其是在颞叶和顶叶区域,红色、黄绿色、蓝色分别表示高、中、低三个代谢强度 [4]
主要研究人员介绍——Dr. Andres Lozano

图 8 Andres Lozano
多伦多大学教授 Andres Lozano, MD,PhD,是应用 DBS-f 驱动神经活动和调节大脑记忆环路的创始人和主要研究者。Dr. Lozano 率先使用 DBS 治疗帕金森病、抑郁症、厌食症、肌张力障碍、亨廷顿氏舞蹈病和 AD。Dr. Lozano 发表著作 400 多篇,是多家国际组织的委员,也是 Michael J. Fox Foundation 科学委员会的创始人之一。Dr. Lozano 获得多项奖励,包括 Olivecrona Medal 和 the Pioneer in Medicine award,当选为加拿大皇家学院和加拿大健康科学院院士。
Dr. Lozano 在 2010 年成立功能性神经调控有限公司 (Functional Neuromodulation Ltd, FNM),致力于应用 DBS 疗法改善 AD 和其他记忆认知障碍患者的生活质量。FNM 公司近期报道了 ADvance Study——多中心 DBS-f 治疗 42 例轻度 AD 患者可行性研究的 12 个月的结果。ADvance Study 主要研究通过手术植入设备向大脑特定区域提供微弱的电脉冲治疗 AD。如将 DBS 植入在记忆中发挥重要作用的穹隆。
背景资料
阿尔茨海默病(Alzheimer’s disorder, AD)——发现,病理,病程流行病学及药物研发现状阿尔茨海默病(Alzheimer’s disorder, AD)是一种中枢神经系统原发性退行性疾病,是痴呆中最常见的一种类型,占所有痴呆病例的 60% 至 80%。AD 患者会出现记忆、思维和行为症状,症状通常发展缓慢,并且会随着时间而加剧,严重时会干扰日常生活功能。
德国医生 Alois Alzheimer 于 1906 年首次报告了一例 51 岁脑功能渐进性衰退女患者长达 4 年 9 个月的观察、诊治、随访及研究的结果。1901 年,51 岁的女性患者 Auguste Deter 入院时,其家人陈述:患者 5 年来,发生渐进性的记忆力和理解力减退、说话不顺畅乃至错乱、听幻觉、失去辨别事物与方向的能力、性格偏执、日常生活中拒绝家人的帮助等。经过反复对症治疗,其症状未能改善却继续加重,直至 1906 年病逝。1910 年,德国精神病学家 Emil Kraepelin 首次将 Alois Alzheimer 报道的上述病症冠以 Alzheimer 的名字,称为 AD [5]。

图 9 Auguste Deter 图 10 Alois Alzheimer(1864~1915)
AD 的特征性病理改变有:淀粉样蛋白为核心的淀粉样斑块,淀粉样蛋白直接毒害细胞、破坏神经传递。这些细胞外斑块由β分泌酶与 γ 分泌酶分解淀粉样前体蛋白(APP)产生的不可溶性β样淀粉样蛋白(Aβ)肽结节。AD 的另一个特征是神经细胞内由双股螺旋微丝构成的神经纤维缠结,由不可溶性纤维蛋白 tau 引起。此外还有神经元颗粒空泡变性、血管壁淀粉样蛋白变性。
AD 呈慢性进行性病程,总病程一般为 2~12 年,通常可将病程分为三期。第一期(早期),一般持续 1~3 年,以近记忆障碍、学习新知识能力下降、视空间定向障碍、缺乏主动性为主要表现。第二期(中期),病情继续发展,智力与人格改变日益明显,出现皮质受损症状,如失语、失用和失认等,也可以出现幻觉和幻想。生活部分自理或不能自理。第三期(后期)呈明显痴呆状态,生活完全不能自理。
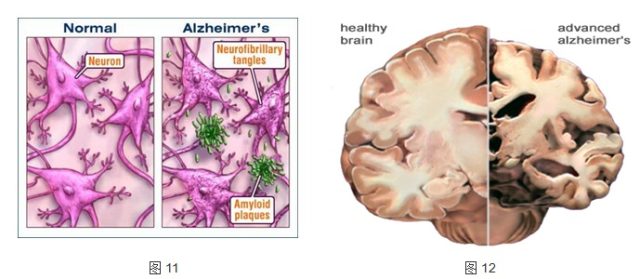
图 11 左:正常;右:AD(绿色物为β淀粉样蛋白) ; 图 12 AD 患者脑室变大,海马区和皮层萎缩
流行病学研究显示,AD 的患病率随年龄增高而增高,在 65 岁以上人群中约为 5%,而在 85 岁以上人群中约为 20%[6]。全世界约有 4600 万人患有痴呆症,大多数为 60 岁以上人群, 这一数字到 2050 年预计将增加到 1 亿 3150 万 [7, 8]。我国学者贾建平教授 2014 年在《Alzheimer’s & Dementia》上发表了中国农村和城市痴呆症的患病率调查结果。中国 65 岁及 65 岁以上人群痴呆症、AD 和 VaD 的患病率分别为 5.14%、3.21% 和 1.50%。此研究中的患病率比之前的调查结果显著增高 [9]。
(贾建平,首都医科大学宣武医院神经内科主任,教授,首都医科大学脑重大疾病研究院 AD 研究所所长,擅长治疗 AD 及认知障碍疾病、脑血管病及神经科疑难杂病)
AD 是目前医学界所面临的最大挑战之一,美国每年与 AD 直接相关的支出达到 2030 亿美元,到 2050 年,这一数字有望增加到 1 万亿美元。AD 是新药研发的重灾区,统计数据显示该领域临床失败率高达 99.6%。各大制药巨头先后在大型临床试验中惨败,包括辉瑞(Pfizer)和强生(JNJ)的单抗 bapineuzumab 及礼来(Eli Lilly)的单抗 solanezumab,这 2 种单抗投资均超过 10 亿美元;此外,罗氏(Roche)也因单抗药物 gantenerumab 未表现出明显的疗效迹象和新的安全性信号而宣布终止相关临床试验。在过去的 16 年中,仅有四种药物获批,另外 123 种药物临床实验失败或未获得监管部门批准,这 123 种还不包括尚未进入临床实验的药物。因此,急需新的疗法来治疗 AD。
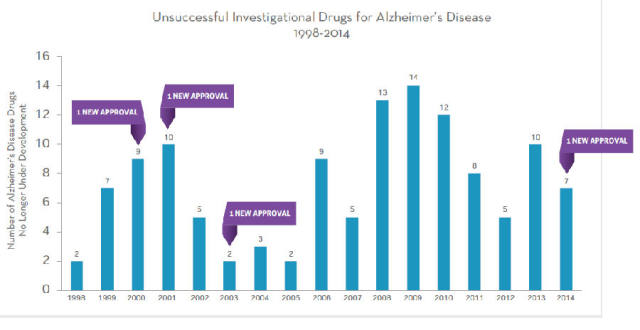
图 15 1998~2014 年未能取得进展的 AD 药物数量
参考阅读
5. 傅维康: 认识「阿尔茨海默病」100 年. 家庭用药 2006(1):30-31.
6.Behl C: The search for novel avenues for the therapy and prevention of Alzheimer's disease. Drug News Perspect 2006, 19(1):5-12.
7.Scheltens P, Blennow K, Breteler MM, de Strooper B, Frisoni GB, Salloway S, Van der Flier WM: Alzheimer's disease. Lancet 2016, 388(10043):505-517.
8.Prince M: World Alzheimer report 2015: the global impact of dementia.
9.Jia J, Wang F, Wei C, Zhou A, Jia X, Li F, Tang M, Chu L, Zhou Y, Zhou C et al: The prevalence of dementia in urban and rural areas of China. Alzheimers Dement 2014, 10(1):1-9.
10.《精神病学》第五版,沈渔邨 主编